
名前:宮内 将【東京大学大学院医学系研究科 血液・腫瘍病態学】
発表日時:2018年6月15日
発表形式:Poster
Title:
Patient-derived induced pluripotent stem cells revealed calcium/calmodulin dependent protein kinase 2 as a potential therapeutic target of myelofibrosis
Authors:
Masashi Miyauchi, Kazuki Taoka, Yosuke Masasmoto, Sho Yamazaki, Shunya Arai, Mineo Kurokawa
Affiliations:
Department of Hematology and Oncology, Graduate School of Medicine, The University of Tokyo, Tokyo, Japan
Abstract:
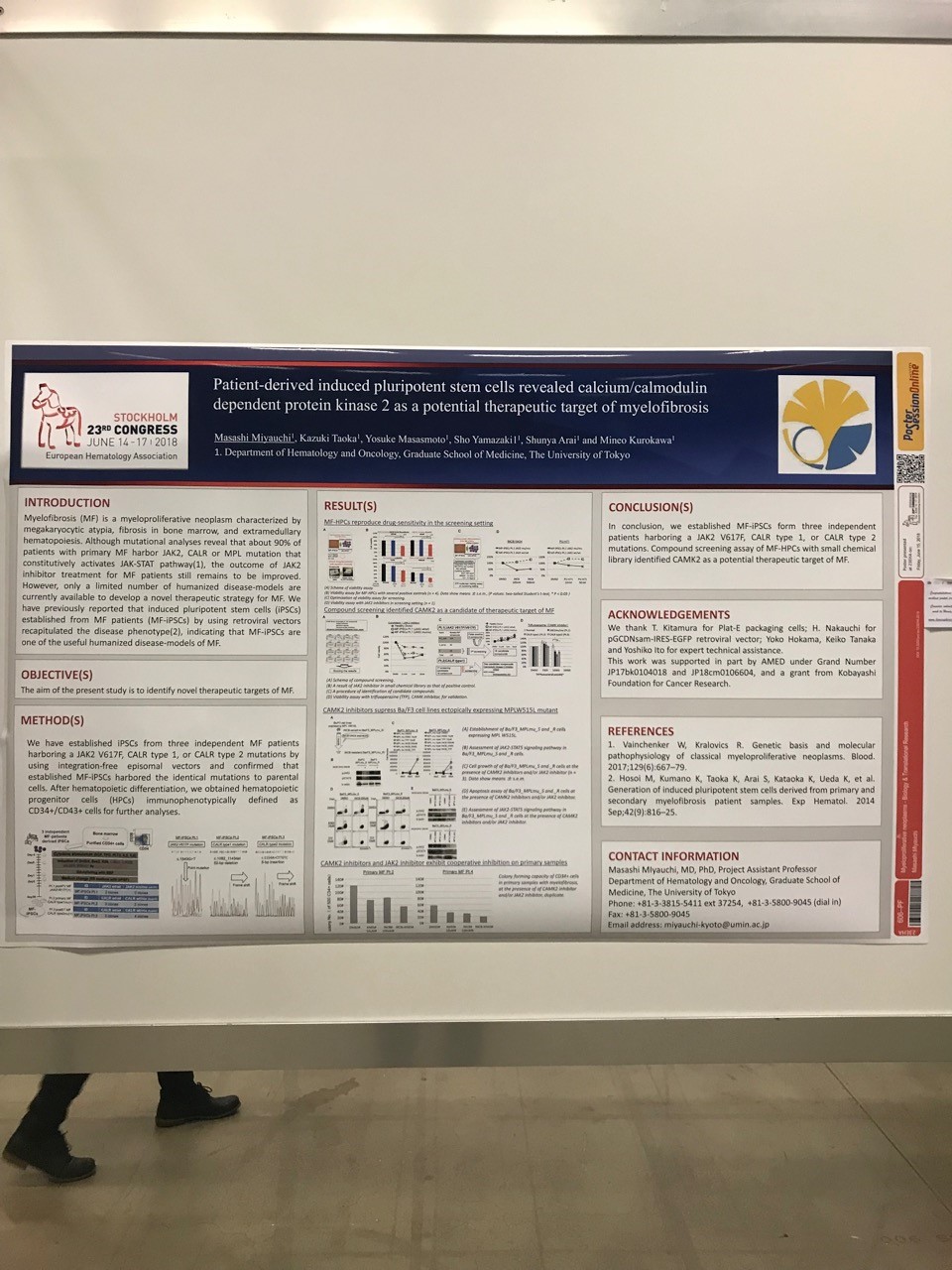
Background: Myelofibrosis (MF) is a myeloproliferative neoplasm characterized by megakaryocytic atypia, fibrosis in bone marrow, and extramedullary hematopoiesis. Although mutational analyses reveal that about 90% of patients with primary MF harbor JAK2, CALR or MPL mutation that constitutively activates JAK-STAT pathway, the outcome of JAK2 inhibitor treatment for MF patients still remains to be improved. However, only a limited number of humanized disease-models are currently available to develop a novel therapeutic strategy for MF. We have previously reported that induced pluripotent stem cells (iPSCs) established from MF patients (MF-iPSCs) by using retroviral vectors recapitulated the disease phenotype (Hosoi et al. 2014), indicating that MF-iPSCs are one of the useful humanized disease-models of MF.
Aims: The aim of the present study is to identify novel therapeutic targets of MF.
Methods: We have established iPSCs from three independent MF patients harboring a JAK2 V617F, CALR type 1, or CALR type 2 mutations by using integration-free episomal vectors and confirmed that established MF-iPSCs harbored the identical mutations to parental cells. After hematopoietic differentiation, we obtained hematopoietic progenitor cells (HPCs) immunophenotypically defined as CD34+/CD43+ cells for further analyses.
Results:
Viability assays revealed that JAK2 inhibitors (ruxolitinib and HSP90) impaired cell survival of MF-HPCs compared to normal-HPCs, suggesting that MF-HPCs also reproduce drug-sensitivity. To investigate therapeutic targets of MF, we optimized culture condition of HPCs to perform compound screening. By the use of small chemical library containing 192 compounds and two MF-iPSCs harboring a JAK2 or CALR mutation, we identified KN93, calcium/calmodulin dependent protein kinase (CAMK) 2 inhibitor, as a compound which inhibited the viability of MF-HPCs from all three patients in dose-dependent manner, compared to normal-HPCs. For validation, we used Trifluoperazine (TFP), another CAMK inhibitor and TFP had similar inhibitory effects on MF-HPCs, indicating that CAMK2 is a candidate of therapeutic target for MF. To address the efficacy of CAMK2 inhibition in other models mimicking MF, we used Ba/F3 mouse cell line ectopically expressing MPL W515L mutant (Ba/F3_MPLmu; IC50 of ruxolitinib=112 nM), along with ruxolitinib-resistant Ba/F3_MPLmu (Ba/F3_MPLmu_R; IC50 of ruxolitinib=642 nM) cells established through one-month exposure to ruxolitinib. KN93 and TFP decreased cell growth, induced apoptosis, and suppressed the phosphorylation of Stat5, a major signaling event in MF, in both Ba/F3_MPLmu_R and Ba/F3_MPLmu cells. Moreover, combination of CAMK2 inhibitors and ruxolitinib induced apoptosis and inhibited the phosphorylation of Stat5 more efficiently than single agent, suggesting that CAMK2 inhibitors and ruxolitinib exhibited a cooperative effect against MF cells. To address the effectiveness of CAMK2 inhibition in primary samples, we used CD34+ cells isolated from peripheral blood mononuclear cells of MF patients. Although either KN93 or ruxolitinib inhibited the colony forming capacity of primary MF cells with similar efficiency, combination of KN93 with ruxolitinib showed cooperative inhibition. Taken together, these findings indicate that CAMK2 would be a therapeutic target of MF patients.
Conclusions: In conclusion, we established MF-iPSCs form three independent patients harboring a JAK2 V617F, CALR type 1, or CALR type 2 mutations. Compound screening assay of MF-HPCs with small chemical library identified CAMK2 as a potential therapeutic target of MF.
EHA2018参加レポート
この度は23rd EHA Congress参加に際しまして,日本血液学会EHA Travel Awardに採択していただき心より御礼申し上げます。私は今年初めてEHAに参加にさせていただき,開催地であるスウェーデンのストックホルムに渡欧いたしました。ストックホルムの町並みは歴史的な建造物と近代的な町並みが共存し調和しており,地区間の移動や会場までのアクセスの利便性も高く,非常に整備された都市で有意義な時間を過ごすことができました。EHAの会場ではPlenary sessionやJoint sessionなどの口演発表を中心に聴講し,欧州の第一線で活躍されている研究者のインパクトのある研究内容を拝聴するとともに,その研究プロセスや経験を直接聞ける機会をもつことができ大変有意義な時間を過ごせました。Poster sessionでは発表者とのdiscussionをより時間をとって行えることもあり,自身の発表分野である骨髄増殖性腫瘍をテーマとした研究者と実験の方法や仮説の立案・検証について自身の研究内容につながる様々な意見交換をすることができました。
私の発表した研究内容は,疾患由来iPS細胞を用いた骨髄線維症に対する治療標的分子の同定でありました。iPS細胞は再生医療分野のみならず,病態解析の分野においても活用され,疾患細胞からiPS細胞を樹立することで新たな疾患モデルを構築することが可能となります。骨髄線維症は骨髄の線維化による汎血球減少を特徴とし有効なヒト疾患モデルが限定的であった疾患の一つでありますが,iPS細胞化技術を応用することで従来困難であった薬剤のスクリーニングを行いました。スクリーニングにより骨髄線維症の治療標的候補遺伝子としてcalcium/calmodulin dependent protein kinase 2遺伝子を抽出し,マウス細胞株を使用した骨髄線維症モデル,患者検体などを用いて治療標的として有望であることを検証し,その結果を報告いたしました。EHAでの発表の際には世界各国からの参加者に多くのご意見をいただき,今後の研究の推進にあたって有意義なアドバイスを得ることができました。このことは,今回EHAに参加することで得られた大きな経験の一つであると強く感じております。
今回,EHA Travel Awardに採択いただき改めて心より御礼申し上げます。また,このような機会を与えていただきました日本血液学会事務局および国際委員会の諸先生に心より感謝申し上げます。今回のEHAで得られた経験,様々な臨床・研究分野からの刺激を糧としまして,今後自身の研究のフィールドを病態解析のみならず幹細胞解析や,再生医療の分野など,さらに広がりをもたせていく必要があることを実感し,幅広い分野を統合的に解析する研究へと発展させていきたいと考えております。最後になりますが,臨床・研究分野ともに大変丁寧な御指導いただいております東京大学医学部附属病院 黒川峰夫教授をはじめとし本研究を進めるためにご尽力いただいております全ての皆様にこの場をお借りして心より御礼申し上げ,私の23rd EHA Congress Travel Award受賞報告とさせていただきます。





