第Ⅲ章 骨髄腫
Ⅲ 骨髄腫
1 多発性骨髄腫
(multiple myeloma:MM)
総論
1.診断・病期・治療効果判定
多発性骨髄腫(multiple myeloma:MM)は,形質細胞の単クローン性(腫瘍性)増殖と,その産物である単クローン性免疫グロブリン(M蛋白)の血清・尿中増加により特徴付けられる疾患である1)。わが国では人口10万人あたり約5人の発症率で,本邦での死亡者数は年間4,000人前後である。全悪性腫瘍の約1%,全造血器腫瘍の約10%を占め,発症率,死亡率ともに年々増加傾向にある。国際骨髄腫作業部会(International Myeloma Working Group:IMWG)による診断規準が広く用いられている(表1)2, 3)。
表1 IMWGによる形質細胞腫瘍の診断規準
|
Non-IgM MGUS 非IgM型意義不明の単クローン性免疫グロブリン血症 |
①血清中非IgM型M蛋白<3 g/dL ②クローナルな骨髄中形質細胞<10% ③臓器障害(CRABまたはアミロイドーシス)を認めない ①〜③のすべてを満たす |
|---|---|
|
IgM MGUS IgM型意義不明の単クローン性免疫グロブリン血症 |
①血清中IgM型M蛋白<3 g/dL ②骨髄中リンパ形質細胞浸潤<10% ③次の症候を欠如(貧血,全身症状,過粘稠,リンパ節腫大,肝脾腫とそれ以外の臓器障害) ①〜③のすべてを満たす |
|
Light-chain MGUS 軽鎖型意義不明の単クローン性免疫グロブリン血症 |
①血清遊離軽鎖比の異常(<0.26 または>1.65) ②該当する血清遊離軽鎖の増加 ③免疫固定法にて重鎖発現を認めない ④臓器障害(CRABまたはアミロイドーシス)を認めない ⑤クローナルな骨髄中形質細胞<10% ⑥尿中M蛋白量<500mg/24時間 ①〜⑥のすべてを満たす |
|
Solitary plasmacytoma of bone/of soft tissue 孤立性形質細胞腫(骨の/軟部組織の) |
①生検にてクローナルな形質細胞から成る骨あるいは軟部組織の形質細胞腫の存在 ②骨髄中にクローナルな形質細胞を認めない ③孤立性形質細胞腫病変以外には骨X線,椎体および骨盤MRI(またはCT)で異常を認めない ④臓器障害(CRAB)を認めない ①〜④のすべてを満たす |
|
Solitary plasmacytoma with minimal marrow involvement of bone/of soft tissue 微小骨髄浸潤を有する孤立性形質細胞腫(骨の/軟部組織の) |
①生検にてクローナルな形質細胞から成る骨あるいは軟部組織の形質細胞腫の存在 ②骨髄中のクローナルな形質細胞<10% ③孤立性形質細胞腫病変以外には骨X線,椎体および骨盤MRI(またはCT)で異常を認めない ④臓器障害(CRAB)を認めない ①〜④のすべてを満たす |
|
Smouldering(Asymptomatic)multiple myeloma くすぶり型(無症候性)多発性骨髄腫 |
①血清中M蛋白(IgGまたはIgA型)≧3 g/dLまたは尿中M蛋白≧500mg/24時間 ②クローナルな骨髄中形質細胞が10%以上で60%未満 ③myeloma defining events(MDE)またはアミロイドーシスを認めない ①または②に加えて③を満たす |
|
(Symptomatic)multiple myeloma secretary/non-secretary (症候性)多発性骨髄腫(分泌型/非分泌型) |
①クローナルな骨髄中形質細胞≧10%または生検にて診断された骨性または軟部組織の形質細胞腫を認める ②MDEの1つ以上,またはbiomarkerの1つ以上を満たす(付表) ①と②の両者を満たす ①の骨髄中形質細胞が10%未満の場合は,2カ所以上の骨病変を認めることが必要 |
|
Multiple solitary plasmacytoma 多発性形質細胞腫 |
①血清または尿中にM蛋白を検出しないか,検出しても微量である ②クローナルな形質細胞による2カ所以上の形質細胞腫または骨破壊を認める ③正常骨髄 ④形質細胞腫病変以外の骨所見に異常を認めない ⑤臓器障害(CRAB)を認めない ①〜⑤のすべてを満たす |
|
Plasma cell leukemia 形質細胞白血病 |
①末梢血中形質細胞>2,000/μL ②白血球分画中形質細胞比率≧20% ①と②の両者を満たす |
|
POEMS syndrome POEMS症候群 |
POEMS症候群の項参照 |
|
Systemic AL amyloidosis 全身性ALアミロイドーシス |
全身性ALアミロイドーシスの項参照 |
注)形質細胞白血病については白血球分画中形質細胞比率≧5%が≧20%と同様に予後不良であったとする報告もある4)。
(文献3)より作成)
付表:Myeloma-defining events(MDE)とMyeloma-defining biomarkers
| Myeloma-defining events(MDE) |
|---|
|
形質細胞腫瘍に起因する下記の臓器障害(end organ damage) 高カルシウム血症:血清Ca>11mg/dL または正常上限値よりも1mg/dL を超えて増加 腎不全:CrCl<40mL/min または血清Cr>2.0mg/dL 貧血:ヘモグロビン値<10g/dL または正常下限値よりも2g/dLを超えて低下 骨病変:1つ以上の病変を骨X線,CTまたはPET/CT検査で認める |
| Myeloma-defining biomarkers |
|
下記のバイオマーカー(biomarker)の1つ以上を有する ①骨髄中のクローナルな形質細胞 ≧60% ②involved/uninvolved FLC(血清遊離軽鎖)比≧100(involved FLC≧100mg/Lであること) ③MRIで2カ所以上の5mm以上の巣状骨病変あり |
(文献3)より作成)
この中で全身化学療法の対象となるのはCRABと称される臓器障害,すなわち高カルシウム血症,腎不全,貧血,骨病変(骨髄腫診断事象,myeloma defining events:MDE)のうち1つ以上を有している(症候性)多発性骨髄腫(symptomatic)multiple myelomaであり,M蛋白量は治療開始の指標としては用いないことに注意が必要である。2014年に改訂されたIMWG規準において,myeloma-defining biomarker(SLiM:骨髄中形質細胞≧60%,involved/uninvolved血清遊離軽鎖比≧100,またはMRIで2カ所以上の5 mmを超える巣状病変ありのいずれか1つ以上)を有する場合も(症候性)多発性骨髄腫の範疇に含められた3)。これらは,従来のくすぶり型(無症候性)骨髄腫の中で2年以内に80%以上の確率で症候性骨髄腫に進行する可能性の高い病態であるが,myeloma-defining biomarkerのみを有しMDE(CRAB症候)を示さない多発性骨髄腫の中には長期間進行しない患者も一部含まれており,日常診療においては直ちに治療開始すべきか注意深い経過観察を行うかは個別に判断することが望ましい。
多発性骨髄腫患者の診療において治療開始前のベースライン評価として勧められる検査項目を列挙する(表2)。
表2 治療前検査一覧
|
一般検査 検尿,便ヘモグロビン,血算・血液像,凝固検査,生化学・免疫検査(総蛋白,アルブミン,総ビリルビン,AST,ALT,ALP,LDH,アミラーゼ,アンモニア,尿酸,血糖,BUN,クレアチニン,ナトリウム,カリウム,カルシウム,蛋白分画,β2ミクログロブリン,CRP),HBs抗原,HBc抗体,HBs抗体,HCV抗体,HIV抗体,胸部X線検査,心電図,動脈血酸素飽和度 |
|---|
|
M蛋白の同定と定量 蛋白分画(血清,尿),24時間尿蛋白定量 |
|
骨髄形質細胞の増加,形質細胞腫の証明 骨髄穿刺・骨髄生検 |
|
臓器障害の診断 全身骨X線検査(頭蓋骨:正・側,頸椎,胸椎,腰椎:正・側,肋骨:正面,骨盤骨:正面,左右の上腕骨:正面,左右の前腕骨:正面,左右の大腿骨:正面,左右の下腿骨:正面) |
|
その他の検査(必要に応じ追加) 生検(皮下組織,骨髄,口唇,胃,あるいは腎),血液・血漿・血清粘稠度,眼底検査,チミジンキナーゼ,クリオグロブリン |
症候性骨髄腫に対して患者予後を推定するための病期分類として,血清β2ミクログロブリン値とアルブミン値のみを用いる国際病期分類(International Staging System:ISS)の使用が推奨される(表3)5)。プロテアソーム阻害薬や免疫調節薬が使用可能となり,患者予後が著明に改善した時代により即した病期分類として改訂国際病期分類(Revised-ISS:R-ISS)が提唱された6)。R-ISSは,従来のISSに間期核FISH(interphase fluorescence in situ hybridization:iFISH)法における高リスク染色体異常の有無と,増殖能を反映する血清LDH濃度を追加した病期分類であり,新規薬剤時代における予後因子としての意義が示されている(表4)6)。ただし,現時点ではISSやR-ISSに基づく治療の層別化は実施されていない。
表3 International Staging System(ISS)
| Stage | 基準 | 50%生存期間 |
|---|---|---|
| Ⅰ |
血清β2ミクログロブリン<3.5mg/L 血清アルブミン≧3.5g/dL |
62カ月 |
| Ⅱ | ⅠでもⅢでもないもの | 44カ月 |
| Ⅲ | 血清β2ミクログロブリン≧5.5mg/L | 29カ月 |
・Stage Ⅱには以下の2つが含まれる。
1)血清β2ミクログロブリン<3.5mg/Lで血清アルブミン<3.5g/dLのもの
2)血清アルブミン値にかかわらず血清β2ミクログロブリン≧3.5mg/Lかつ<5.5mg/Lのもの
・表3における50%生存期間は新規薬剤(プロテアソーム阻害薬,免疫調節薬)登場前のデータに由来する。
Reprinted with permission from Greipp PR, et al., International Staging System for Multiple Myeloma, J Clin Oncol. 2005; 23(15): 3412-3420.(https://ascopubs.org/doi/10.1200/JCO.2005.04.242); Copyright © 2005 American Society of Clinical Oncology.
表4 Revised-International Staging System(R-ISS)
| 予後因子 | 基準 |
|---|---|
|
ISS stage Ⅰ Ⅱ Ⅲ |
血清β2ミクログロブリン < 3.5mg/L,血清アルブミン ≧ 3.5g/dL ISS stageⅠでもⅢでもないもの 血清β2ミクログロブリン ≧ 5.5mg/L |
|
CA by iFISH high risk standard risk |
Del(17p)かつ/またはt(4;14)かつ/またはt(14;16)あり high risk染色体異常を認めない |
|
LDH Normal High risk |
血清LDH ≦ 正常上限 血清LDH > 正常上限 |
A new model for risk stratification for MM
|
R-ISS stage Ⅰ Ⅱ Ⅲ |
ISS stageⅠかつ iFISH にてstandard-risk CAかつ血清LDH正常範囲 R-ISS stageのⅠでもⅢでもない ISS stageⅢかつiFISHでhigh-risk CAまたは血清LDH高値 |
CA:chromosomal abnormalities (染色体異常),iFISH:interphase fluorescence in situ hybridization (間期核FISH),ISS:International Staging System(国際病期分類),LDH:lactate dehydrogenase,MM:multiple myeloma,R-ISS:revised International Staging System
Reprinted with permission from Palumbo A, et al., Revised International Staging System for Multiple Myeloma : A Report From International Myeloma Working Group, J Clin Oncol. 2015; 33(26): 2863-2869. (https://ascopubs.org/doi/10.1200/JCO.2015.61.2267); Copyright © 2015 American Society of Clinical Oncology.
治療効果判定には,IMWGによる統一効果判定規準(uniform response criteria)が広く用いられている7,8)。効果判定に必要な検査項目と判定規準を示す(表5,6)。臨床試験においては,EuroFlow-NGF(next generation flow)を用いたmultiparameter flow cytometry(MFC)や免疫グロブリン重鎖や軽鎖のVDJ領域の次世代シーケンス(next-generation sequencing:NGS)によるdeep sequencingを用いた微小残存病変/測定可能残存病変(minimal/measurable residual disease:MRD)の意義も検討され,患者予後の予測に有用であることが示唆されている9-11)。さらに骨髄中のMRDと,PET/CTを含む画像診断による残存病変を統合したIMWG MRD criteriaも提唱されている(表7)9)。
表5 治療効果判定のために必要な検査
|
M蛋白量測定のための検査 ・血清M蛋白量は,血清蛋白電気泳動(serum protein electrophoresis:SPEP)を行いdensitometryで定量する。ただしIgA型のようにM蛋白がβ分画にあるような場合には,SPEPの信頼性が低いため,免疫グロブリン(IgA)の絶対値(nephelometryまたはturbidometryにて測定)をM蛋白量として用いる。 ・尿中M蛋白量は,24時間尿の尿蛋白電気泳動(urine protein electrophoresis:UPEP)法で測定する。随時尿や24時間尿を用いたκ,λ軽鎖の定量検査は信頼に値せず,推奨できない。 |
|---|
|
測定可能病変(measurable disease)の定義 ・すべてのカテゴリーおよび,CRを除くサブカテゴリーの効果判定には,下記の測定可能病変のうち,最低1つを有する必要がある。 血清M蛋白≧1g/dL ・CRの効果判定を行う際は,上記の3つの測定可能病変のどれかを有することが必要であるが,stringent CRだけは上記3つのどれも有さない場合であっても判定可能である。 |
|
PRもしくはSD規準の判断のためのフォローアップ ・新規治療開始後1年間は,月1回のフォローアップ,そして1年経過後は2カ月ごとのフォローアップが推奨される。 ・測定可能病変を有する患者は,SPEPとUPEP両者をフォローアップすることが必要である。 ・CR判定を除き,SPEPのみでしか測定可能病変を有さない患者はSPEPのみでのフォローアップを,そして同様にUPEPのみでしか測定可能病変を有さない患者ではUPEPのみでのフォローアップを行えばよい。 ・SPEPもしくはUPEP,あるいはその両者の測定可能病変を有する患者では,これら2種類のM蛋白測定に基づいて効果判定を行うべきであって,FLC測定に基づく効果判定は行わない。FLCを用いた効果判定は,あくまでSPEPやUPEPにおいてM蛋白量測定が行えない患者に用いる場合と,stringent CRのカテゴリーを満たすか否かの判断に対して用いられるものである。 ・CRの判定には,必ず血清と尿の両者の免疫固定法(immunofixation)が行われ,治療前のM蛋白量にかかわらず両者とも陰性であることを確認する必要がある。治療前にUPEPが陰性であった患者においてもCRの確認のためには再度UPEP検査を行うべきである(light chain/Bence-Jones escapeを除外するため)。 ・全身骨の画像検査は,臨床症状がない限りは効果判定目的に行う必要はない。しかし一般臨床では,年に1回は実施することが推奨される。骨髄検査は,CRカテゴリーの判断と非分泌型骨髄腫患者の効果判定に限って必要とされる。 |
(文献7)より作成)
表6 国際骨髄腫作業部会統一効果判定規準IMWG Uniform Response Criteria
| Response subcategory | Response criteria |
|---|---|
| sCR(stringent CR) |
CR規準を満たすとともに下記の条件を満たす。 FLC比(κ/λ)が正常(0.26〜1.65)で,かつ免疫組織化学,または2〜4カラーのフローサイトメトリーにて骨髄中にclonal plasma cell(PC)を証明しない。 |
| CR(complete response) | 免疫固定法にて血清と尿中のM蛋白がともに陰性化,かつ軟部形質細胞腫の消失,かつ骨髄中PCが5%未満まで減少。 |
| VGPR(very good partial response) | 血清と尿中M蛋白が免疫固定法では検出されるが,蛋白電気泳動では検出されないか,または90%以上にM蛋白が減少し,かつ尿中M蛋白も100mg/24時間未満まで減少。 |
| PR(partialresponse) |
血清M蛋白が50%以上減少し,かつ24時間尿中M蛋白量が90%以上減少するか,200mg/24時間未満まで減少。血清と尿中M蛋白が測定可能病変でない場合(血清M蛋白<1g/dL,尿中M蛋白<200mg/24時間)には,M蛋白規準の代わりに血清FLC値のinvolved-uninvolved FLCの差が50%以上減少する必要がある。 血清と尿中M蛋白が測定可能病変ではなく,かつ血清FLC値も測定可能病変でない場合(FLC<10mg/dL)に限って,M蛋白規準の代わりに骨髄中PCが50%以上減少していることを必要とする(ただし治療前の骨髄PC≧30%の場合のみ)。 上記の規準に加えて,治療前に軟部形質細胞腫が存在した場合には測定可能病変の最長径と直交する短径の積和が50%以上減少していることも必要条件とする。 |
| MR(minor response)* |
下記のすべての項目を満たす ・血清M蛋白の≧25%,<50%の減少,および24時間尿中M蛋白量の≧50%,<90%の減少 ・軟部形質細胞腫の≧25%,<50%の縮小 ・溶骨病変の増大や数の増加を認めない |
| SD(stable disease) | CR,VGPR,PR,PD のいずれの規準をも満たさない場合。 |
|
PD(progressive disease) PFS/TTP評価目的の計算に用いる。効果判定としてのprogressive disease(進行)と,治療中または治療終了後のdisease progression(増悪)の両者の判定に用いる。また,CR到達後の増悪に対しても同じ規準を使用する。 |
下記の項目の1つあるいはそれ以上を満たす場合。 ・最低値に比して下記の25%以上の増加 血清M蛋白値(ただし絶対値にして0.5g/dL以上であること)(ベースライン値が5g/dL≧であれば1g/dLのM蛋白増加でよい),尿中M蛋白量(ただし絶対値にして200mg/24時間以上),血清あるいは尿中M蛋白値が測定可能病変でない場合はinvolved-uninvolved FLCの差(ただしinvolved FLCの絶対値が10mg/dL以上であること),骨髄中PC%(ただし絶対値で10%以上であること) ・明らかな新規の骨病変出現または軟部形質細胞腫の出現,または既存の骨病変や軟部形質細胞腫の明らかな増大 ・高カルシウム血症の出現(補正血清Ca値≧11.5mg/dL で,純粋に骨髄腫に起因すると判断される場合) |
・すべてのresponse の判定には連続した2回の判定が必要である(判定間隔は問わない)。
・VGPR以上の判定には,ベースライン評価で測定可能病変が存在したか否かにかかわらず,血清M蛋白と尿のM蛋白の両者の検査を必要とする。
・sCR,CR判定の目的での骨髄検査は1回の判定のみでよい。
・Clonal PC の存在は,κ/λ比をもとに判定する。最低100以上のPCをカウントしκ/λ比が>4:1または<1:2である時には異常な比率と判断する。
・これまでのnear CR判定,プラトーの定義は用いない。
・測定可能病変(measurable disease)の定義は,表5を参照のこと。
*European Group for Blood and Marrow Transplantation(EBMT)規準から採用し,再発・難治性骨髄腫患者の治療効果判定に用いる。
(文献7,8)より作成)
表7 IMWGで用いられるMRD効果判定規準
| Response subcategory | Response criteria |
|---|---|
| Sustained MRD-negative | 骨髄MRD陰性(NGFまたはNGSによる感度<10-5)および画像検査の陰性所見が少なくとも1年以上継続 |
| Flow MRD-negative | EuroFlow標準法または検証された同様の方法により(NGF),表面形質の異常な形質細胞を骨髄中に認めない(感度<10-5) |
| Sequencing MRD-negative | ClonoSEQ法または検証された同様の方法により(NGS),クローナルな形質細胞を検出できない(感度<10-5) |
| Imaging plus MRD-negative | NGFやNGSによるMRD陰性に加え,PET/CTによる治療前集積の全消失,または縦隔血液プールや周囲の正常組織よりの集積低下 |
(文献9)より作成)
2.治療
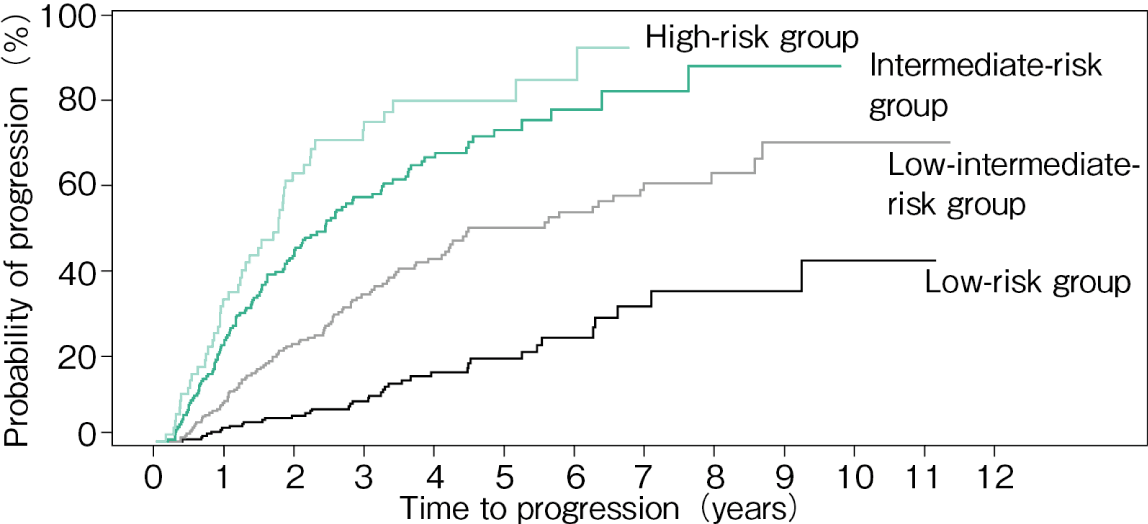
症候性骨髄腫の前癌病態である意義不明の単クローン性免疫グロブリン血症(monoclonal gammopathy of undetermined significance:MGUS)やくすぶり型(無症候性)多発性骨髄腫は無治療経過観察(watchful waiting)が原則であり,(症候性)多発性骨髄腫に進行した時点で全身化学療法を開始する(MGUS・くすぶり型骨髄腫:CQ1)。MGUSは,年約1%の割合で多発性骨髄腫や全身性アミロイドーシスへ進行することが知られており,10年後で12%,20年後で25%,25年後で30%の患者で疾患の進行が認められる12)。疾患進行のリスク因子として,①血清M蛋白濃度1.5g/dL以上,②非IgG型,③血清遊離軽鎖(κ/λ)比異常の3因子が示されており,進行割合を予測するモデルが提唱されている(図1)13)。くすぶり型骨髄腫から(症候性)多発性骨髄腫あるいは全身性アミロイドーシスへの進行は,診断後の5年間は年10%,次の5年間は年3%,10年を超えると年1%に認められる14)。また,進行のリスク因子として①骨髄中形質細胞比率20%以上,②血清M蛋白濃度2g/dL以上,③血清遊離軽鎖比の大きな異常(κ/λ比で0.05以下もしくは20以上),④予後不良の染色体異常[t(4;14),t(14;16),+1q,and/or del 13q]の4因子を用いた予測モデルがIMWGより提唱されている(図215),くすぶり型骨髄腫:CQ2)。
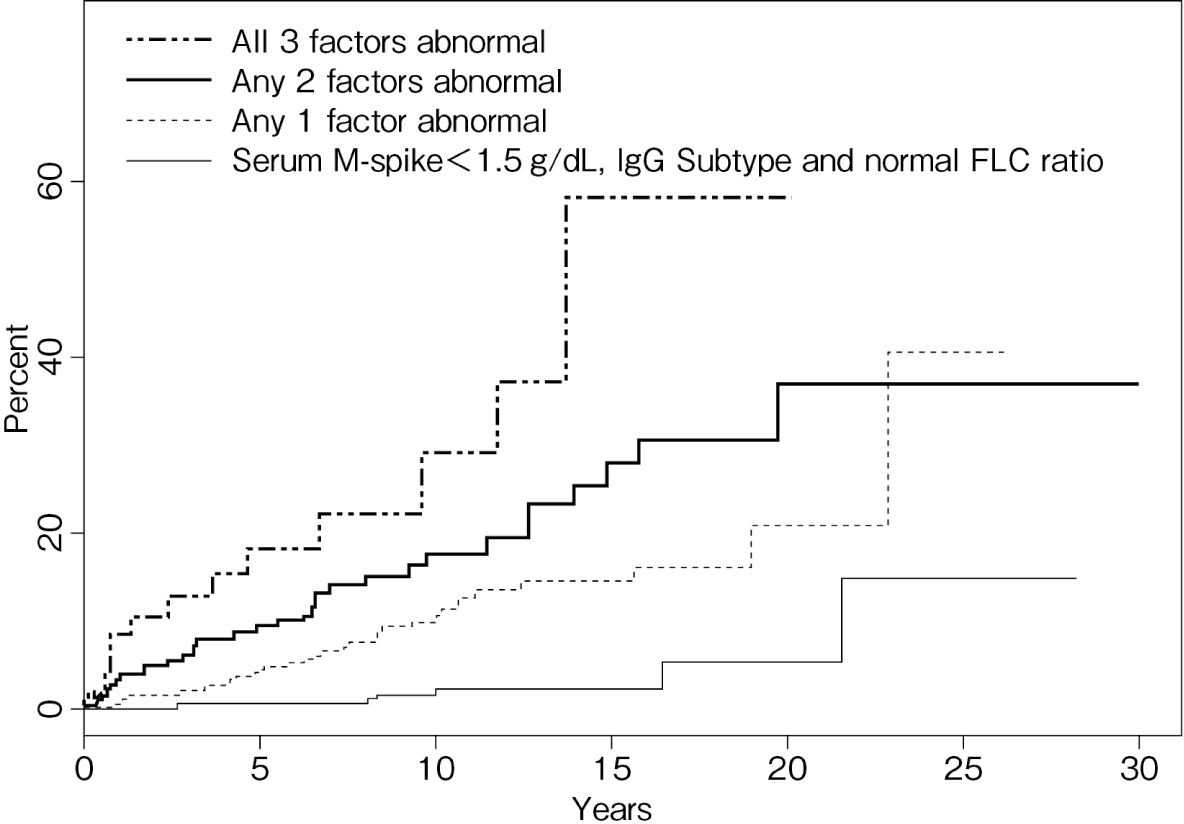
図1 MGUSの進行リスク
リスク因子:血清M蛋白濃度≧1.5g/dL,非IgG型,血清遊離軽鎖比率の異常(κ/λ比:<0.5または>2)
(文献13)より引用)
| Risk Stratification groups |
Number of risk factors |
Hazard Ratio (95% Cl) |
Risk of progression (2 years) |
# of patients |
|---|---|---|---|---|
| Low | 0 | Reference | 6.0% | 225(32.7%) |
| Low-intermediate | 1 | 4.16(2.26-7.67) | 22.8% | 224(32.5%) |
| Intermediate | 2 | 9.82(5.46-17.7) | 45.5% | 177(25.7%) |
| High | 3-4 | 15.5(8.23-29.0) | 63.1% | 63(9.1%) |
図2 くすぶり型骨髄腫の進行リスク
リスク因子:骨髄中形質細胞比率>20%,血清M蛋白濃度>2g/dL,血清遊離軽鎖比率の異常(κ/λ比:<0.05または>20),予後不良の染色体異常[t(4;14),t(14;16),+1q,and/or del 13q]
(文献15)より引用)
従来のくすぶり型骨髄腫のなかで,診断後2年以内に80%以上の確率で多発性骨髄腫へ進行する可能性を予測する因子としてmyeloma-defining biomarker(SLiM:骨髄中形質細胞≧60%,involved/ uninvolved 血清遊離軽鎖比≧100,またはMRIで2カ所以上の5mmを超える巣状病変あり)の3因子が抽出された。これらのバイオマーカーを1つでも有する場合には,2014年の新IMWG規準では多発性骨髄腫の範疇に含められた3)。ただし,バイオマーカーを有する患者や高リスクのくすぶり型患者のすべてが2年以内にCRAB徴候を発症するわけではなく,バリデーションも未実施であるため,日常診療において直ちに治療開始すべきか否かは議論のあるところである。日常診療においては,個々の患者の病態を見極めた上で,直ちに治療を開始するか,あるいは注意深い経過観察を行いCRAB徴候が出始めた時点で治療を開始するのかを判断することが望ましい(くすぶり型骨髄腫:CQ1,CQ3)。
骨や軟部組織(髄外)の孤立性形質細胞腫に対しては,40〜50Gy(20〜25分割)の局所放射線照射を行った後に無治療経過観察し,多発性骨髄腫に移行した場合にはじめて全身化学療法を考慮する16)。アジュバント療法としての化学療法は推奨されない。なお,多発性形質細胞腫に対しては,多発性骨髄腫と同様の治療方針が選択される。
現時点では,多発性骨髄腫は治癒を期待できる疾患ではない。しかし,治療介入により長期の生存が可能となっている疾患である。すなわち,QOLを維持しながら長期生存を目指すことが治療目標となる。一般に,自家造血幹細胞移植併用大量化学療法(high-dose chemotherapy with autologous hematopoietic stem cell transplantation:HDC/AH-SCT)の適応となる65歳未満の移植適応患者と,65歳以上あるいは重要臓器の障害のために自家造血幹細胞移植の適応とならない移植非適応患者によって異なった治療戦略が選択される。65歳という年齢はあくまで目安であり,日常臨床においては生物学的年齢を考慮した上で治療方針を決定する。移植適応患者では,化学療法および新規薬剤を用いた導入療法後の大量メルファラン(MEL)療法によるCRの達成が長期のPFS,ひいては長期生存の代替えマーカーとなることが示されている17,18)。また,移植非適応患者においても新規薬剤を併用した化学療法によりCR達成割合の増加が示されており,それまでゴールドスタンダードであったMP療法(MEL,PSL)を凌ぐ生存期間の延長が期待できるようになった19)。最近では,移植適応および移植非適応患者,さらに再発・難治患者においても,MRD陰性例におけるPFSや生存期間の有意な延長が明らかにされている(微小残存病変:CQ2,エビデンスレベル1iiA)20)。
支持療法としては,デノスマブ(Dmab)やビスホスホネート製剤の併用によって骨痛や病的骨折などの骨関連事象発生の減少効果のみならず,生存期間の延長効果も期待できるようになった21,22)(溶骨病変・合併症の治療:CQ1,CQ3,エビデンスレベル 1iiA)。また,腎障害のためにビスホスホネート製剤を使用しづらい場合にもヒト型抗RANKL(receptor activator of nuclear factor-κ B ligand)モノクローナル抗体であるDmabは使用可能である23)(溶骨病変・合併症の治療:CQ1,エビデンスレベル1iDiv)。Dmabは投与後に重篤な低カルシウム血症をきたすことがあるため,ビタミンDとカルシウムの補充を予防的に行う。また,これらの薬剤は顎骨壊死(antiresorptive agent-related osteonecrosis of the jaw:ARONJ)などの特徴的な有害事象を有しており,治療介入によりQOLを損なうことのないように適切な配慮が必要である(溶骨病変・合併症の治療:CQ2)。さらに,骨髄腫に高頻度にみられる合併症である腎障害,原疾患および治療薬の副作用として現れやすい感染症(溶骨病変・合併症の治療:CQ4),末梢神経障害や血栓症(溶骨病変・合併症の治療:CQ5)に対する予防や支持療法など,きめ細かい配慮が必要となる。なお,骨髄腫細胞は放射線感受性が比較的良好であるため,限局性の溶骨病変や病的骨折部の除痛を目的とした場合や,脊髄あるいは神経根の圧迫が懸念される椎体病変に対しては局所放射線照射が有効である。
参考文献
1) McKenna RW, et al. Plasma cell neoplasms. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, IARC; 2017: pp241-53.(テキストブック)
2) International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders : a report of the International Myeloma Working Group. Br J Haematol. 2003; 121(5): 749-57.(コンセンサスレポート)
3) Rajkumar SV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014; 15(12): e538-48.(コンセンサスレポート)
4) Fernández de Larrea C, et al. Primary plasma cell leukemia: consensus definition by the International Myeloma Working Group according to peripheral blood plasma cell percentage. Blood Cancer J. 2021; 11(12): 192.(コンセンサスレポート)
5) Greipp PR, et al. International staging system for multiple myeloma. J Clin Oncol. 2005; 23(15): 3412-20.
6) Palumbo A, et al. Revised international staging system for multiple myeloma: a report from International Myeloma Working Group. J Clin Oncol. 2015; 33(26): 2863-9.(コンセンサスレポート)
7) Durie BGM, et al. International uniform response criteria for multiple myeloma. Leukemia 2006; 20(9): 1467-73.(コンセンサスレポート)
8) Rajkumar SV, et al. Consensus recommendations for the uniform reporting of clinical trials: report of the International Myeloma Working Consensus Panel 1. Blood. 2011; 117(18): 4691-5.(コンセンサスレポート)
9) Kumar S, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. Lancet Oncol. 2016; 17(8): e328-46.(コンセンサスレポート)
10)Munshi NC, et al. Association of minimal residual disease with superior survival outcomes in patients with multiple myeloma: a meta-analysis. JAMA Oncol. 2017; 3(1): 28-35.(1iiA)
11)Takamatsu H, et al. Prognostic value of sequencing-based minimal residual disease detection in patients with multiple myeloma who underwent autologous stem-cell transplantation. Ann Oncol. 2017; 28(10): 2503-10.(3iiiDiii)
12)Kyle RA, et al. A long-term study of prognosis in monoclonal gammopathy of undetermined significance. N Engl J Med. 2002; 346(8): 564-9.(3iiiDii)
13)Rajkumar SV, et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood. 2005; 106(3): 812-7.(3iiiDii)
14)Kyle RA, et al. Clinical course and prognosis of smoldering(asymptomatic)multiple myeloma. N Engl J Med. 2007; 356(25): 2582-90.(3iiiDii)
15)Mateos MV, et al. International Myeloma Working Group risk stratification model for smoldering multiple myeloma(SMM). Blood Cancer J. 2020; 10(10): 102.(コンセンサスレポート)
16)Weber DM. Solitary bone and extramedullary plasmacytoma. Hematology Am Soc Hematol Educ Program. 2005; 373-6.(テキストブック)
17)Martinez-Lopez J, et al. Long-term prognostic significance of response in multiple myeloma after stem cell transplantation. Blood. 2011; 118(3): 529-34.(3iiiA)
18)Harousseau JL, et al. Achievement of at least very good partial response is a simple and robust prognostic factor in patients with multiple myeloma treated with high-dose therapy: Long-term analysis of the IFM99-02 and 99-04 trials. J Clin Oncol. 2009; 27(34): 5720-6.(3iiiA)
19)Gay F, et al. Complete response correlates with long-term progression-free and overall survival in elderly myeloma treated with novel agents: analysis of 1175 patients. Blood. 2011; 117(11): 3025-31.(3iiiA)
20)Munshi NC, et al. A large meta-analysis establishes the role of MRD negativity in long-term survival outcomes in patients with multiple myeloma. Blood Adv. 2020; 4(23): 5988-99.(1iiA)
21)Berenson JR, et al. Efficacy of pamidronate in reducing skeletal events in patients with advanced multiple myeloma. Myeloma Aredia Study Group. N Engl J Med. 1996; 334(8): 488-93.(1iDiii)
22)Morgan GJ, et al. First-line treatment with zoledronic acid as compared with clodronic acid in multiple myeloma(MRC Myeloma IX): a randomized controlled trial. Lancet. 2010; 376(9757): 1989-99.(1iiA)
23)Raje N, et al. Comparison of denosumab with zoledronic acid for the treatment of bone disease in patients with newly diagnosed multiple myeloma; An international, randomized, double blind trial. Lancet Oncol. 2018; 19(3): 370-81.(1iDiv)
アルゴリズム
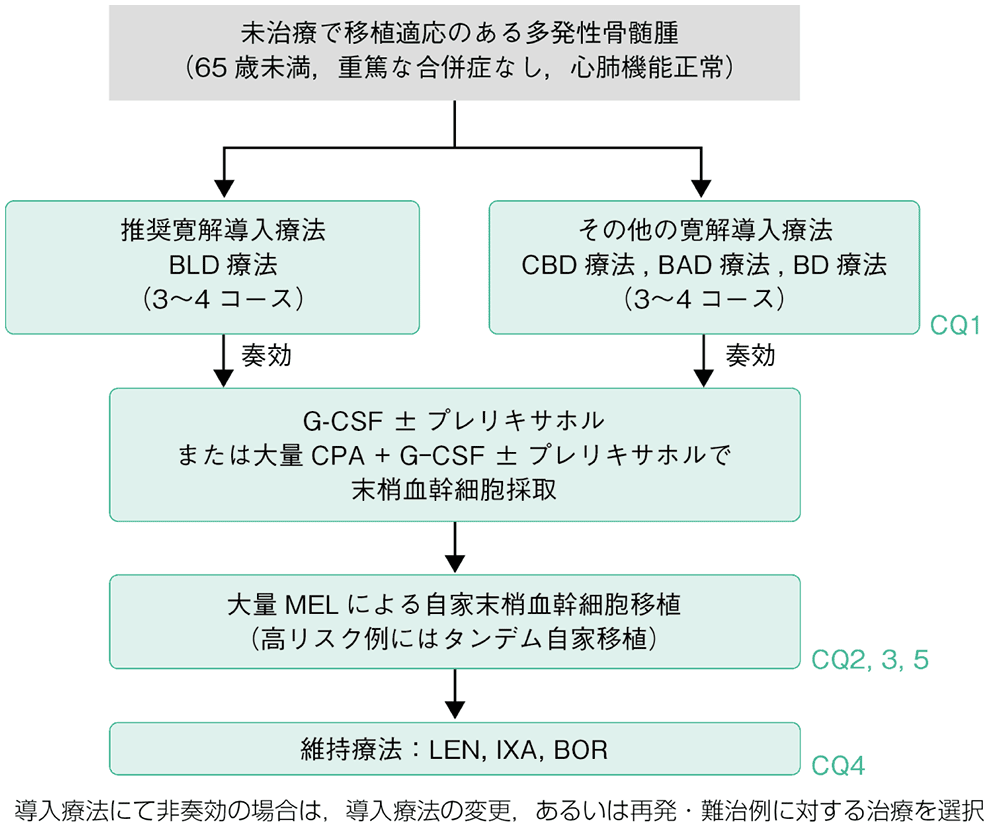
1 多発性骨髄腫
(multiple myeloma:MM)
1)未治療で移植適応のある多発性骨髄腫
65歳未満で重要臓器機能の保持されている初発多発性骨髄腫患者に対しては,効果が迅速で深い奏効を期待でき,かつ自家造血幹細胞採取効率に悪影響を与えない導入療法を施行(移植適応患者:CQ1,エビデンスレベル1iiDiii)後,自家造血幹細胞移植を併用した大量MEL療法を実施することが推奨される(移植適応患者:CQ2〜3,エビデンスレベル1iiA)。移植適応患者に対する導入療法としてメルファラン(MEL)などのアルキル化剤やレナリドミド(LEN)の長期投与を施行すると,造血幹細胞採取効率の低下につながることが知られており,注意が必要である。推奨導入療法としては,高い奏効割合が期待できるBLD療法(BOR,LEN,DEX)があり,3〜4コース施行後に自家末梢血幹細胞採取と保存を行う。腎障害などによりLENの使用が困難な例では,BCD療法(BOR,CPA,DEX)やBD療法(BOR,DEX)も選択肢となる。また,3剤併用療法としてBAD療法(BOR,DEX,DXR)があるが,同時に毒性も増強することに留意すべきである。腎障害を伴っていてもBORは使用しやすい薬剤である。しかし,肺の間質影や末梢神経障害が存在するなどBORによる毒性が懸念される場合には,Ld療法(LEN,低用量DEX),VAD療法(VCR,DXR,DEX)や大量DEX療法(high-dose dexamethasone:HDD)なども選択肢となる。
自家末梢血造血幹細胞は,G-CSF単独または大量CPA療法にG-CSFを併用して採取し,CD34陽性細胞で2×106 個/患者体重(kg)以上の造血幹細胞を得ることを目標とし凍結保存しておく。わが国においても,CX chemokine receptor 4(CXCR4)とstromal derived factor-1 alpha(SDF-1α)の相互作用を阻害するプレリキサホルが承認され,G-CSFとの併用でより効率的に造血幹細胞採取が実施できるようになった。また,再発時の救援療法としての2回目の自家造血幹細胞移植に備えて,2回分の造血幹細胞を凍結保存しておくことも選択肢となるが,使用期限を含めた凍結幹細胞の質的保証体制など施設の現状に合わせた運用が必要である。大量MEL療法は通常200mg/m2を2日間に分けて投与するが,腎障害がある場合には70%に減量する。2日目の大量MEL投与の翌々日に凍結しておいた自家末梢血造血幹細胞を輸注する。早期からの新規薬剤の使用により大量MEL療法を行うことなく同等のPFSが得られるかどうかの臨床試験が複数行われているが,これまでに報告された試験結果からは大量MEL療法を組み込むことが65歳未満の患者に対する標準治療である(移植適応患者:CQ2,エビデンスレベル1iiDiii)。また,後方視的解析では,染色体高リスク患者に対するタンデム移植のPFSやOS改善効果が示されている(移植適応患者:CQ5,エビデンスレベル3iiiA)。
最近の欧米の臨床試験では,1回目の移植後の地固め療法や維持療法としてLEN,ボルテゾミブ(BOR),イキサゾミブ(IXA)などの新規薬剤が使用されておりPFSの延長効果,そして一部の臨床試験においてはOSの延長効果も示されている(移植適応患者:CQ4,エビデンスレベル1iDiii)。しかし,いずれの薬剤を用いた場合も至適投与法(投与量,投与レジメンや投与期間など)は確立されておらず,今後の検討課題である。日常臨床においての地固め療法や維持療法は,薬剤耐性化や二次がんの発症を含めた有害事象のリスクと患者利益,そして医療経済的な側面をよく考えて,患者ごとに実施するかどうかを決定する必要がある。
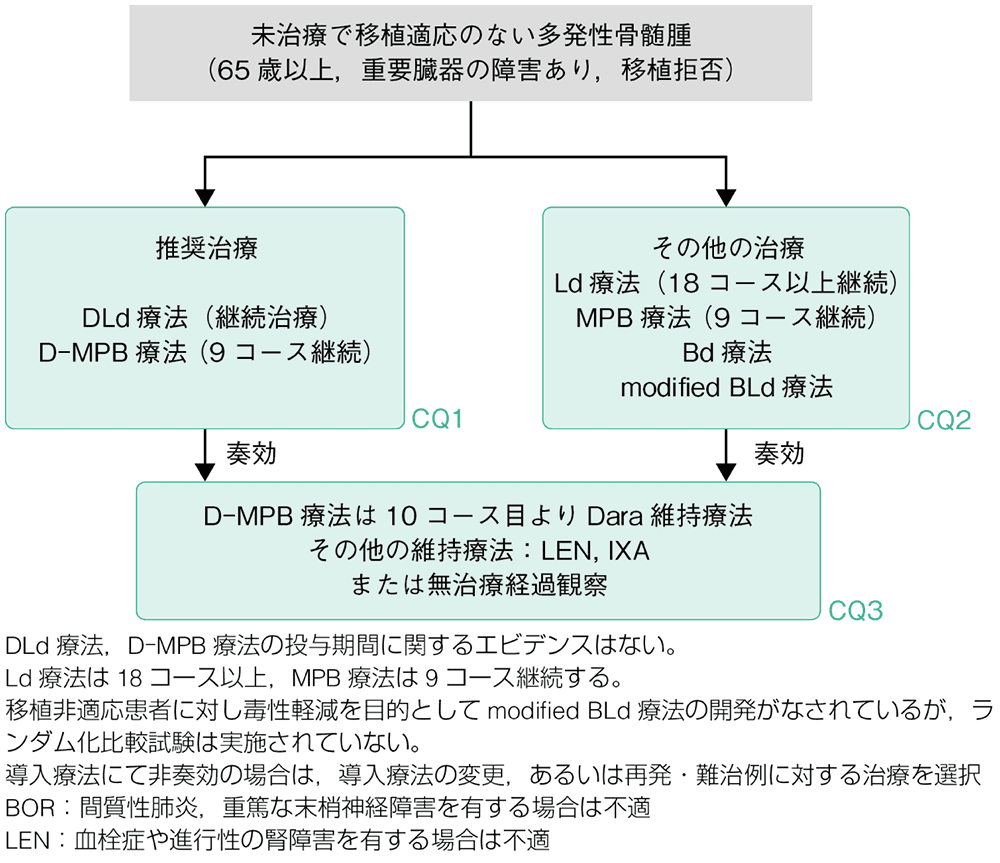
1 多発性骨髄腫
(multiple myeloma:MM)
2)未治療で移植適応のない多発性骨髄腫
移植非適応患者に対する現在の標準治療は,DLd療法(DARA,LEN,低用量DEX)またはD-MPB療法(DARA,MEL,PSL,BOR)である。Ld療法は,MP療法(MEL,PSL)よりもOS延長効果を示したMPT療法(MEL,PSL,THAL)とのランダム化比較試験において,PFSおよびOSの延長効果を示した。MPB療法は,40年以上にわたって標準治療であったMP療法に比してPFSの延長効果のみでなくOSの延長効果も示した。さらに,DLd療法はLd療法に比して,D-MPB療法はMPB療法に比して,PFSの延長効果を示した(移植非適応患者:CQ1,エビデンスレベル1iiDiii)。患者年齢や末梢神経障害,血栓症などのリスクや肺の間質影の合併の有無などを考慮して,従来のLd療法,MP療法やMPB療法,Bd療法などの化学療法の選択肢もある。Ld療法の継続投与は,18コースで終了した場合に比較してPFSの延長が示されている。MPB療法は,通常9コースまで継続することを目標とするが,治療継続期間を比較検討した臨床試験は存在しない。また,米国ではBLd療法(BOR,LEN,DEX)が移植非適応患者における標準治療と位置付けられている1)。しかし,その根拠となるSWOG S0777試験における登録患者の57%が65歳未満の患者であること,そしてBLd療法を受けた患者のおよそ1/3でGrade 3の末梢神経障害を認めたことから,わが国における移植非適応患者の標準治療と位置付けることは困難であるが,その後,薬剤を減量したmodified BLd療法の有効性と安全性が報告されており,選択肢の一つと考えられる。また,高齢患者に対する大量デキサメタゾン(DEX)の投与は感染症,血栓症や白内障を誘発することが示されており,年齢に応じた減量が勧められる(移植非適応患者:CQ2,エビデンスレベル1iiDi)。
移植非適応患者に対する導入療法後の維持療法については,DLd療法は継続療法であり,D-MPB療法は10コース目よりダラツムマブ(DARA)維持療法に移行するが,いずれもOS延長効果が示されており,推奨される(移植非適応患者:CQ2,エビデンスレベル1iiA)。LEN維持療法やIXA維持療法(2年間)のOS延長効果については明らかでなく,患者の利益と不利益を考慮して決定することが望ましい。
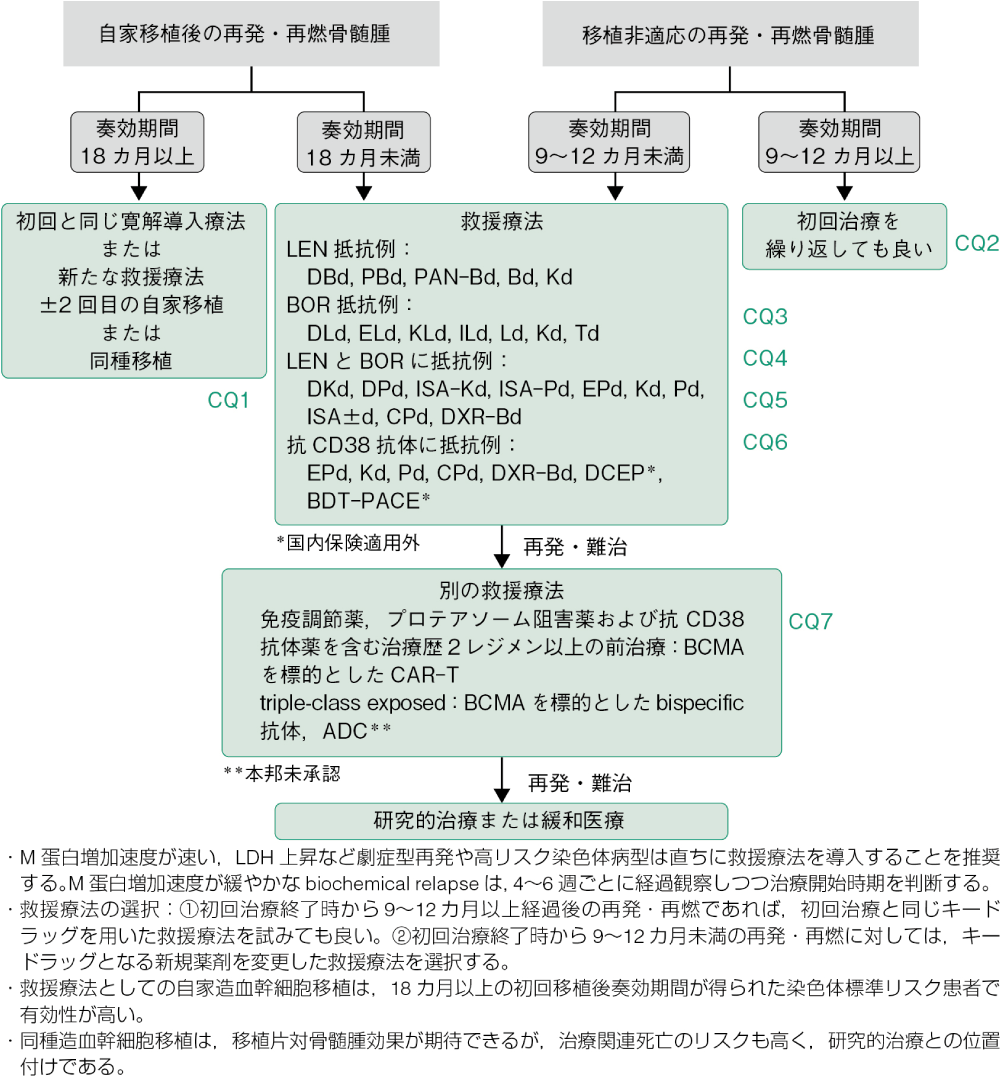
3)再発・難治性骨髄腫
再発・難治例に対しては,初回治療の最終投与日から9〜12カ月以上経過してからの再発・再燃であれば初回導入療法に対する感受性を有している場合も多く,初回導入療法で用いたキードラッグ(プロテアソーム阻害薬や免疫調節薬)を含む2〜3剤併用の救援療法を試みてもよいし,初回に使用していないキードラッグを含む治療レジメンに変更してもよい(再発・難治性骨髄腫:CQ1〜2,エビデンスレベル1Diiiまたは1A)。初回治療終了後9〜12カ月未満の再発・再燃や治療中の進行,増悪の場合には,初回治療で使用していないキードラッグを含む救援療法の選択が推奨される(表1)。薬剤選択においては,既治療レジメン内容や患者の有する合併症,臓器機能障害の有無などを考慮する必要がある。一般にプロテアソーム阻害薬または免疫調節薬とDEXの2剤併用療法は,外来で実施しやすく患者の負担が少ない。また,3剤併用療法の方が一般的に臨床的効果は高いが毒性も増強することがあり,前治療薬に対する抵抗性や個々の患者の状態を把握した上で治療レジメンを決定する(再発・難治性骨髄腫:CQ3〜6,エビデンスレベル1iiDiiiまたは1iiA)。
表1 再発・難治性骨髄腫に対する新規薬剤を中心とした救援療法
| Pl-based BOR BOR/DEX BOR/CPA/DEX BOR/DEX/PAN CFZ 20-56/DEX CFZ 20-70 weekly/DEX |
IMiD-based LEN/DEX LEN/CPA/DEX LEN/DXR/DEX THAL THAL/DEX THAL/DEX/CPA POM/DEX |
| Pl/IMiD-based BOR/LEN/DEX BOR/THAL/DEX BOR/POM/DEX CFZ/LEN/DEX CFZ/POM/DEX* IXA/LEN/DEX |
mAb-alone/combination DARA/LEN/DEX DARA/POM/DEX DARA/BOR/DEX DARA/CFZ/DEX ELO/LEN/DEX ELO/POM/DEX ISA ISA/DEX ISA/POM/DEX ISA/CFZ/DEX |
| その他 | |
|
High-dose CPA DEX/CPA/ETP*/CDDP*(DCEP) DEX/THAL/CDDP*/DXR/CPA/ETP*(DT-PACE)± BOR(BDT-PACE) BEN* |
|
上記の救援療法の中で,わが国における推奨投与量や安全性・有効性の確立していないレジメンについては臨床試験の範疇で実施されることが望ましい。
*国内保険適用外
Pl : proteasome inhibitor,IMiD : immunomodulatory drug,mAb : monoclonal antibody
移植適応のある65歳未満の患者においては,救援療法が奏効した場合には2回目の自家造血幹細胞移植併用の大量MEL療法を行うという選択もあり,特に染色体標準リスクで初回移植後に18カ月以上の長期の奏効期間を示した患者で有効性が高い(再発・難治性骨髄腫:CQ1,エビデンスレベル1iiDiii)。同様に救援療法が奏効してHLA適合ドナーがいる場合には,同種造血幹細胞移植という選択肢もあるが,移植後早期の死亡率が高く再発・再燃も高頻度であることから,臨床試験の範疇で行われることが望ましい(再発・難治性骨髄腫:CQ1)。
その後の再発・再燃に対しても主に前治療薬に対する感受性の有無に基づきレジメンを選択するが,免疫調節薬,プロテアソーム阻害薬および抗CD38抗体を含む2レジメン以上の前治療歴を有する例では,B-cell maturation antigen(BCMA)に対するキメラ抗原受容体発現T細胞輸注療法(CAR-T細胞療法)も候補となる(再発・難治性骨髄腫:CQ7)。BCMAを標的としたその他の薬剤として,bispecific antibodyが承認された。エルラナタマブは骨髄腫細胞のB-cell maturation antigen(BCMA)とT細胞のCD3に結合する二重特異性抗体で,骨髄腫細胞の近傍にT細胞を引き寄せ細胞障害活性を高めることにより,骨髄腫細胞の細胞死を誘導する薬剤である。第Ⅰ相試験では再発・難治性多発性骨髄腫88例(90.9%が免疫調節薬,プロテアソーム阻害薬および抗CD38モノクローナル抗体薬の3クラスの薬剤それぞれ少なくとも1剤ずつに抵抗性)が登録され,55例がエルラナタマブの有効用量(≧215 µg/kg)で治療された(MagnetisMM-1)2)。用量制限毒性は観察されず,有害事象として血球減少やサイトカイン放出症候群が認められた。観察期間中央値12カ月の時点において,奏効率は63.6%(うち完全奏効以上38.2%)であった。第Ⅱ相試験では3クラス薬剤抵抗性の再発・難治性多発性骨髄腫患者が対象とされ,皮下注射で12mg,32mg,76mgの漸増投与法が用いられた。BCMAを標的とした治療歴のない患者はコホートA(123例),BCMAを標的とした治療歴のある患者はコホートB(64例)として評価された(MagnetisMM-3)3)。コホートAにおける奏効率は61.0%(うち完全奏効以上35.0%)であった。15カ月における無増悪生存率と全生存率は,それぞれ50.9%と56.7%であった。主な有害事象は,感染症 69.9%(Grade 3以上39.8%),貧血48.8%(Grade 3以上37.4%),好中球減少症48.8%(Grade 3以上 48.8%)であった。サイトカイン放出症候群は57.7%に発現したが, Grade 3以上は認めなかった。このコホートAにおける結果は,実臨床における米国の治療成績(COTAおよびFlatiron Healthデータベース)と比較検討された4)。MagnetisMM-3の対象患者と同様の3クラス薬剤抵抗例としてCOTAより239例,Flatiron Healthより152例が抽出され比較されたが,コホートAの結果は奏効率(RR,1.88-2.25),無増悪生存率(HR,0.37-0.57),全生存率(HR,0.46-0.66)において有意に優れていた。以上より,3クラスの薬剤を含む少なくとも3つの標準的な治療が無効または治療後に再発した多発性骨髄腫において,BCMAを標的とした治療歴のない患者に対するエルラナタマブ療法は,有効で忍容性の高い治療として推奨される(推奨グレード:カテゴリー2A)。
Antibody-drug conjugate(ADC)も開発中であるが,本邦未承認である。
参考文献
1)Durie BG, et al. Bortezomib with lenalidomide and dexamethasone versus lenalidomide and dexamethasone alone in patients with newly diagnosed myeloma without intent for immediate autologous stem-cell transplant (SWOG S0777): a randomized, open-label, phase 3 trial. Lancet. 2017; 389(10068): 519-27.(1iiDiii/1iiA)
2)Bahlis NJ, et al. Elranatamab in relapsed or refractory multiple myeloma: the MagnetisMM-1 phase 1 trial. Nat Med. 2023; 29 (10):2570-6.(3iiiDiv)
3)Lesokhin AM, et al. Elranatamab in relapsed or refractory multiple myeloma: phase 2 MagnetisMM-3 trial results. Nat Med. 2023; 29 (9):2259-67.(3iiiDiv)
4)Costa LJ, et al. Elranatamab efficacy in MagnetisMM-3 compared with real-world control arms in triple-class refractory multiple myeloma. Future Oncol. 2024; 20(17):1175-89.(3iiiDiv)

