第Ⅲ章 骨髄腫
Ⅲ 骨髄腫
1 多発性骨髄腫
(multiple myeloma:MM)
総論
多発性骨髄腫(multiple myeloma:MM)は,形質細胞の単クローン性(腫瘍性)増殖と,その産物である単クローン性免疫グロブリン(M蛋白)の血清・尿中増加により特徴づけられる疾患である1)。わが国では人口10万人あたり約5人の発症率で,本邦での死亡者数は年間4,000人前後である。全悪性腫瘍の約1%,全造血器腫瘍の約10%を占め,発症率,死亡率ともに年々増加傾向にある。国際骨髄腫作業部会(International Myeloma Working Group:IMWG)による診断規準が広く用いられている(表1)2, 3)。
この中で全身化学療法の対象となるのはCRABと称される臓器障害,すなわち高カルシウム血症,腎不全,貧血,骨病変(骨髄腫診断事象myeloma defining events:MDE)のうち1つ以上を有している(症候性)多発性骨髄腫(symptomatic)multiple myelomaであり,M蛋白量は治療開始の指標としては用いないことに注意が必要である。2015年に改訂されたIMWG規準において,myeloma-defining biomarker(SLiM:骨髄中形質細胞≧60%,involved/uninvolved血清遊離軽鎖比≧100,またはMRIで2カ所以上の5mmを超える巣状病変ありのいずれか1つ以上)を有する場合も(症候性)多発性骨髄腫の範疇に含められた3)。これらは,従来のくすぶり型(無症候性)骨髄腫の中で2年以内に80%以上の確率で症候性骨髄腫に移行する可能性の高い病態であるが,myeloma-defining biomarkerのみを有しMDE(CRAB症候)を示さない多発性骨髄腫の中には長期間進展しない患者も一部含まれており,日常診療においては直ちに治療開始すべきか注意深い経過観察を行うかは個別に判断することが望ましい。
多発性骨髄腫患者の診療において治療開始前のベースライン評価として勧められる検査項目を列挙する(表2)。
症候性骨髄腫に対して患者予後を推定するための病期分類として,血清β2ミクログロブリン値とアルブミン値のみを用いる国際病期分類(International Staging System:ISS)の使用が推奨される(表3)4)。プロテアソーム阻害薬や免疫調節薬が使用可能となり,患者予後が著明に改善した時代により即した病期分類として改訂国際病期分類(Revised - ISS:R-ISS)が提唱された5)。R-ISSは,従来のISSに間期核FISH(interphase fluorescence in situ hybridization:iFISH)法における高リスク染色体異常の有無と,増殖能を反映する血清LDH濃度を追加した病期分類であり,新規薬剤時代における予後因子としての意義が示されている(表4)5)。ただし,現時点ではISSやR-ISSに基づく治療の層別化は実施されていない。
治療効果判定には,国際骨髄腫作業部会による統一効果判定規準(uniform response criteria)が広く用いられている6, 7)。効果判定に必要な検査項目と判定規準を示す(表5~7)。臨床試験においては,EuroFlow-NGF(next generation flow)を用いたmultiparameter flow cytometry(MFC)や免疫グロブリン重鎖や軽鎖のVDJ領域の次世代シークエンス(next-generation sequencing:NGS)によるdeep sequencingを用いた微小残存腫瘍(minimal residual disease:MRD)の意義も検討され,患者予後の予測に有用であることが示唆されている8-10)。さらに骨髄中のMRDと,PET/CTを含む画像診断による残存病変を統合したIMWG MRD criteriaも提唱されているが,日常診療で普及しているわけではない8)。
表1 IMWGによる形質細胞腫瘍の診断規準
| Non-IgM MGUS 非IgM型意義不明の単クローン性ガンマグロブリン血症 |
①血清中非IgM型M蛋白<3 g/dL ②クローナルな骨髄中形質細胞<10% ③臓器障害(CRABまたはアミロイドーシス)を認めない ①~③のすべてを満たす |
|---|---|
| IgM MGUS IgM型意義不明の単クローン性ガンマグロブリン血症 |
①血清中IgM型M蛋白<3g /dL ②骨髄中リンパ形質細胞浸潤<10% ③次の症候を欠如(貧血,全身症状,過粘稠,リンパ節腫大,肝脾腫とそれ以外の臓器障害) ①~③のすべてを満たす |
| Light-chain MGUS 軽鎖型意義不明の単クローン性ガンマグロブリン血症 |
①血清遊離軽鎖比の異常(<0.26または>1.65) ②該当する血清遊離軽鎖の増加 ③免疫固定法にて重鎖発現を認めない ④臓器障害(CRABまたはアミロイドーシス)を認めない ⑤クローナルな骨髄中形質細胞<10% ⑥尿中M蛋白量<500 mg/24時間 ①~⑥のすべてを満たす |
| Solitary plasmacytoma of bone/of soft tissue 孤立性形質細胞腫(骨の/軟部組織の) |
①生検にてクローナルな形質細胞から成る骨あるいは軟部組織の形質細胞腫の存在 ②骨髄中にクローナルな形質細胞を認めない ③孤立性形質細胞腫病変以外には骨X線,椎体および骨盤MRI(またはCT)で異常を認めない ④臓器障害(CRAB)を認めない ①~④のすべてを満たす |
| Solitary plasmacytoma with minimal marrow involvement of bone/of soft tissue 微小骨髄浸潤を有する孤立性形質細胞腫(骨の/軟部組織の) |
①生検にてクローナルな形質細胞から成る骨あるいは軟部組織の形質細胞腫の存在 ②骨髄中のクローナルな形質細胞<10% ③孤立性形質細胞腫病変以外には骨X線,椎体および骨盤MRI(またはCT)で異常を認めない ④臓器障害(CRAB)を認めない ①~④のすべてを満たす |
| Smouldering(Asymptomatic)multiple myeloma くすぶり型(無症候性)多発性骨髄腫 |
①血清中M蛋白(IgGまたはIgA型)≧3 g/dLまたは尿中M蛋白≧500 mg/24時間 ②クローナルな骨髄中形質細胞が10%以上で60%未満 ③ myeloma defining events(MDE)*またはアミロイドーシスを認めない ①または②に加えて③を満たす |
| (Symptomatic)multiple myeloma secretary/non-secretary (症候性)多発性骨髄腫(分泌型/非分泌型) |
①クローナルな骨髄中形質細胞≧10%または生検にて診断された骨性または軟部組織の形質細胞腫を認める ② MDE*の1つ以上,またはbiomarker**の1つ以上を満たす ①と②の両者を満たす ①の骨髄中形質細胞が10%未満の場合は,2カ所以上の骨病変を認めることが必要 |
| Multiple solitary plasmacytoma 多発性形質細胞腫 |
①血清または尿中にM蛋白を検出しないか,検出しても微量である ②クローナルな形質細胞による2カ所以上の形質細胞腫または骨破壊を認める ③正常骨髄 ④形質細胞腫病変以外の骨所見に異常を認めない ⑤臓器障害(CRAB)を認めない ①~⑤のすべてを満たす |
| Plasma cell leukemia 形質細胞白血病 |
①末梢血中形質細胞>2,000/μL ②白血球分画中形質細胞比率≧20% ①と②の両者を満たす |
| POEMS syndrome POEMS症候群 | POEMS症候群の項参照 |
| Systemic AL amyloidosis 全身性ALアミロイドーシス |
全身性ALアミロイドーシスの項参照 |
| Myeloma-defining events(MDE)* | 形質細胞腫瘍に起因する下記の臓器障害(end organ damage) |
|---|---|
| 高カルシウム血症:血清Ca>11 mg/dLまたは正常上限値よりも1mg/dLを超えて増加 | |
| 腎不全:CrCl<40 mL/minまたは血清Cr>2.0 mg/dL | |
| 貧血:ヘモグロビン値<10g/dLまたは正常下限値よりも2 g/dLを超えて低下 | |
| 骨病変:1つ以上の病変を骨X線,CTまたはPET-CT検査で認める | |
| Myeloma-defining biomarkers** | 下記のバイオマーカー(biomarker)**の1つ以上を有する: ①骨髄中のクローナルな形質細胞≧60% ②involved/uninvolved FLC(血清遊離軽鎖)比≧100(involved FLC≧100 mg/Lであること) ③MRIで2カ所以上の5 mm以上の巣状骨病変あり |
表2 治療前検査一覧
| 一般検査 検尿,便ヘモグロビン,血算・血液像,凝固検査,生化学・免疫検査(総蛋白,アルブミン,総ビリルビン,AST,ALT,ALP,LDH,アミラーゼ,アンモニア,尿酸,血糖,BUN,クレアチニン,ナトリウム,カリウム,カルシウム,蛋白分画,β2ミクログロブリン,CRP),HBs抗原,HBc抗体,HBs抗体,HCV抗体,HIV抗体,胸部X線検査,心電図,動脈血酸素飽和度 |
|---|
| M蛋白の同定と定量 蛋白分画(血清,尿),24時間尿蛋白定量 免疫電気泳動法(血清,尿),または免疫固定法免疫グロブリン定量(IgG,IgA,IgD,IgM,IgE) 血清遊離軽鎖定量およびκ/λ比 |
| 骨髄形質細胞の増加,形質細胞腫の証明 骨髄穿刺・骨髄生検 フローサイトメトリーによる表面形質解析 染色体分析,FISH法 |
| 臓器障害の診断 全身骨X線検査(頭蓋骨:正・側,頸椎,胸椎,腰椎:正・側,肋骨:正面,骨盤骨:正面,左右の上腕骨:正面,左右の前腕骨:正面,左右の大腿骨:正面,左右の下腿骨:正面) 単純CT(頸部,胸部,腹部,骨盤部)脊椎,腸骨 MRI FDG-PET 骨代謝マーカー(尿中デオキシピリジノリン,血清NTx,尿CTx,骨型アルカリホスファターゼ,オステオカルシン)(保険適用に注意) クレアチニンクリアランス 心臓超音波検査 |
| その他の検査(必要に応じ追加) 生検(皮下組織,骨髄,口唇,胃,あるいは腎),血液・血漿・血清粘稠度,眼底検査,チミジンキナーゼ,クリオグロブリン |
表3 International Staging System(ISS)
| Stage | 基準 | 50%生存期間 |
|---|---|---|
| Ⅰ | 血清β2ミクログロブリン<3.5 mg/L 血清アルブミン≧3.5 g/dL |
62カ月 |
| Ⅱ | ⅠでもⅢでもないもの | 44カ月 |
| Ⅲ | 血清β2ミクログロブリン≧5.5 mg/L | 29カ月 |
注:Stage Ⅱには以下の2つが含まれる。
・血清β2ミクログロブリン<3.5 mg/Lで血清アルブミン<3.5 g/dlのもの
・血清アルブミン値にかかわらず血清β2ミクログロブリン≧3.5 mg/Lかつ<5.5 mg/Lのもの
・表3における50%生存期間は新規薬剤(プロテアソーム阻害薬,免疫調節薬)登場前のデータに由来する
Reprinted with permission. ©2005 American Society of Clinical Oncology. All rights reserved.
Greipp PR, et al: J Clin Oncol 23(15), 2005: 3412-3420.
表4 Revised-International Staging System(R-ISS)
| 予後因子 | 基準 |
|---|---|
| ISS stage | |
| Ⅰ | 血清β2ミクログロブリン<3.5 mg/L, 血清アルブミン ≧ 3.5 g/dL |
| Ⅱ | ISS stageⅠでもⅢでもないもの |
| Ⅲ | 血清β2ミクログロブリン≧5.5 mg/L |
CA by iFISH
high risk:del(17p)かつ/またはt(4;14)かつ/またはt(14;16)あり
standard risk:high risk染色体異常を認めない
| LDH | |
| Normal | 血清LDH≦正常上限 |
| High risk | 血清LDH>正常上限 |
A new model for risk
stratification for MM
R-ISS stage
I:ISS stageⅠかつ iFISHにてstandard-risk CA かつ血清LDH正常範囲
II:R-ISS stageのⅠでもⅢでもない
III:ISS stageⅢかつ iFISHでhigh-risk CA または血清LDH高値
CA, chromosomal abnormalities (染色体異常); iFISH, interphase fluorescence in situ hybridization(間期核FISH); ISS, International Staging System(国際病期分類); LDH, lactate dehydrogenase; MM, multiple myeloma; R-ISS, revised International Staging System
Reprinted with permission. ©2015 American Society of Clinical Oncology. All rights reserved.
Palumbo A, et al: J Clin Oncol 33 (26), 2015: 2863-2869.
表5 治療効果判定のために必要な検査
| M蛋白量測定のための検査 ・血清M蛋白量は,血清蛋白電気泳動(serum protein electrophoresis:SPEP)を行いdensitometryで定量する。ただしIgA型のようにM蛋白がβ分画にあるような場合には,SPEPの信頼性が低いため,免疫グロブリン(IgA)の絶対値(nephelometryまたはturbidometryにて測定)をM蛋白量として用いる。 ・尿中M蛋白量は,24時間尿の尿蛋白電気泳動(urine protein electrophoresis:UPEP)法で測定する。随時尿や24時間尿を用いたκ,λ軽鎖の定量検査は信頼に値せず,推奨できない。 |
|---|
| 測定可能病変(measurable disease)の定義 ・すべてのカテゴリーおよび,CRを除くサブカテゴリーの効果判定には,下記の測定可能病変のうち,最低1つを有する必要がある。 血清M蛋白≧1 g/dL 尿中M蛋白≧200 mg/24時間 血清遊離軽鎖(free light chain:FLC)のκ/λ比が異常であり,かつM蛋白に一致する(involved) FLC値≧10 mg/dL ・CRの効果判定を行う際は,上記の3つの測定可能病変のどれかを有することが必要であるが,stringent CRだけは上記3つのどれも有さない場合であっても判定可能である。 |
| PRもしくはSD規準の判断のためのフォローアップ ・新規治療開始後1年間は,月1回のフォローアップ,そして1年経過後は2カ月ごとのフォローアップが推奨される。 ・測定可能病変を有する患者は,SPEPとUPEP両者をフォローアップすることが必要である。 ・CR判定を除き,SPEPのみでしか測定可能病変を有さない患者はSPEPのみでのフォローアップを,そして同様にUPEPのみでしか測定可能病変を有さない患者ではUPEPのみでのフォローアップを行えばよい。 ・SPEPもしくはUPEP,あるいはその両者の測定可能病変を有する患者では,これら2種類のM蛋白測定に基づいて効果判定を行うべきであって,FLC測定に基づく効果判定は行わない。FLCを用いた効果判定は,あくまでSPEPやUPEPにおいてM蛋白量測定が行えない患者に用いる場合と,stringent CRのカテゴリーを満たすか否かの判断に対して用いられるものである。 ・CRの判定には,必ず血清と尿の両者の免疫固定法(immunofixation)が行われ,治療前のM蛋白量にかかわらず両者とも陰性であることを確認する必要がある。治療前にUPEPが陰性であった患者においてもCRの確認のためには再度UPEP検査を行うべきである(light chain/Bence-Jones escapeを除外するため)。 ・全身骨の画像検査は,臨床症状がない限りは効果判定目的に行う必要はない。しかし一般臨床では,年に1回は実施することが推奨される。骨髄検査は,CRカテゴリーの判断と非分泌型骨髄腫患者の効果判定に限って必要とされる。 |
表6 国際骨髄腫作業部会統一効果判定規準IMWG uniform response criteria
| Response subcategory | Response criteria |
|---|---|
| sCR(stringent CR) | CR規準を満たすとともに下記の条件を満たす。 FLC(free light chain)比(κ/λ)が正常(0.26~1.65)で,かつ 免疫組織化学,または2~4カラーのフローサイトメトリーにて骨髄中にclonal plasma cell(PC)を証明しない。 |
| CR(complete response) | 免疫固定法にて血清と尿中のM蛋白がともに陰性化,かつ 軟部形質細胞腫の消失,かつ 骨髄中PCが5%未満まで減少。 |
| VGPR(very good partial response) | 血清と尿中M蛋白が免疫固定法では検出されるが, 蛋白電気泳動では検出されないか,または 90%以上にM蛋白が減少し,かつ尿中M蛋白も100 mg/24時間未満まで減少。 |
| PR(partial response) | 血清M蛋白が50%以上減少し,かつ 24時間尿中M蛋白量が90%以上減少するか,200 mg/24時間未満まで減少。血清と尿中M蛋白が測定可能病変でない場合(血清M蛋白<1 g/ dL,尿中M蛋白<200 mg/24時間)には,M蛋白規準の代わりに血清FLC値のinvolved-uninvolved FLCの差が50%以上減少する必要がある。 血清と尿中M蛋白が測定可能病変ではなく,かつ血清FLC値も測定可能病変でない場合(FLC<10 mg/dL)に限って,M蛋白規準の代わりに骨髄中PCが50%以上減少していることを必要とする(ただし治療前の骨髄PC≧30%の場合のみ)。 上記の規準に加えて,治療前に軟部形質細胞腫が存在した場合には測定可能病変の最長径と直交する短径の積和が50%以上減少していることも必要条件とする。 |
| SD(stable disease) | CR,VGPR,PR,PDのいずれの規準をも満たさない場合。 |
| Relapse subcategory | Relapse criteria |
| PD(progressive disease) PFS/TTP評価目的の計算に用いる。効果判定としてのprogressive disease[進行]と,治療中または治療終了後のdisease progression[増悪]の両者の判定に用いる。またCR到達後の増悪に対しても同じ規準を使用する。 |
下記の項目の1つあるいはそれ以上を満たす場合。 ・最低値に比して下記の25%以上の増加 血清M蛋白値(ただし絶対値にして0.5 g/dL以上であること)(ベースライン値が5 g/dL≧であれば1 g/dLのM蛋白増加でよい),尿中M蛋白量(ただし絶対値にして200 mg/24時間以上),血清あるいは尿中M蛋白値が測定可能病変でない場合はinvolved-uninvolved FLCの差(ただしinvolved FLCの絶対値が10 mg/dL以上であること),骨髄中PC%(ただし絶対値で10%以上であること) ・明らかな新規の骨病変出現または軟部形質細胞腫の出現,または既存の骨病変や軟部形質細胞腫の明らかな増大 ・高カルシウム血症の出現(補正血清Ca値≧11.5 mg/dLで,純粋に骨髄腫に起因すると判断される場合) |
・すべてのresponseの判定には連続した2回の判定が必要である(判定間隔は問わない)。
・GPR以上の判定には,ベースライン評価で測定可能病変が存在したか否かに関わらず,血清M蛋白と尿のM蛋白の両者の検査を必要とする。
・sCR,CR判定の目的での骨髄検査は1回の判定のみでよい。
・Clonal PCの存在は,κ/λ比を下に判定する。最低100以上のPCをカウントしκ/λ比が>4:1または<1:2である時には異常な比率と判断する。
・これまでのnear CR判定,プラトーの定義は用いない。
・測定可能病変(measurable disease)の定義は,表5を参照のこと。
表7 表6以外にIMWGで用いられる効果判定規準
| Response subcategory | Response criteria |
|---|---|
| MR(minor response) EBMT*規準から採用し,再発・難治性骨髄腫患者の治療効果判定に用いる |
下記のすべての項目を満たす ・血清M蛋白の≧25%,<50%の減少,および24時間尿中M蛋白量の≧50%,<90%の減少 ・軟部形質細胞腫の≧25%,<50%の縮小 ・溶骨病変の増大や数の増加を認めない |
| iCR(immunophenotypic CR) | Stringent CRの規準を満たし,かつ 5カラー以上のフローサイトメトリーを用いた少なくとも100万個の骨髄細胞の解析で表面形質上の異常な形質細胞(clonal PC)を認めない |
| mCR(molecular CR) | CRの規準を満たし,かつ Allele-specific oligonucleotide polymerase chain reaction(ASO-PCR)法(感度10-5)にてclonal PCを検出できない |
*EBMT:European Group for Blood and Marrow Transplantation
参考文献
1) McKenna RW, et al. Plasma cell neoplasms. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, IARC ; 2017 : pp241-53. (テキストブック)
2) International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders : a report of the International Myeloma Working Group. Br J Haematol. 2003 ; 121 (5) : 749-57.
3) Rajkumar SV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 ; 15 (12) : e538-48.
4) Greipp PR, et al. International staging system for multiple myeloma. J Clin Oncol. 2005 ; 23 (15) : 3412-20.
5) Palumbo A, et al. Revised international staging system for multiple myeloma : a report form International Myeloma Working Group. J Clin Oncol. 2015 ; 33 (26) : 2863-9.
6) Durie BGM, et al. International uniform response criteria for multiple myeloma. Leukemia 2006 ; 20 (9) : 1467-73.
7) Rajkumar SV, et al. Consensus recommendations for the uniform reporting of clinical trials : report of the International Myeloma Working Consensus Panel 1. Blood. 2011 ; 117 (18) : 4691-5.
8) Kumar S, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. Lancet Oncol. 2016 ; 17 (8) : e328-46.
9) Munshi NC, et al. Association of minimal residual disease with superior survival outcomes in patients with multiple myeloma : a mata-analysis. JAMA Oncol. 2017 ; 3 (1) : 28-35.
10)Takamatsu H, et al. Prognostic value of sequencing-based minimal residual disease detection in patients with multiple myeloma who underwent autologous stem-cell transplantation. Ann Oncol. 2017 ; 28 (10) : 2503-10.
アルゴリズム
症候性骨髄腫の前癌病態であるMGUSやくすぶり型(無症候性)多発性骨髄腫は無治療経過観察(watchful waiting)が原則であり,多発性骨髄腫(症候性)に移行した時点で全身化学療法を開始する(くすぶり型多発性骨髄腫:CQ1,CQ2,エビデンスレベル1iiA)。MGUSは,年約1%の割合で多発性骨髄腫や全身性アミロイドーシスへ進行することが知られており,10年後で12%,20年後で25%,25年後で30%の患者で疾患の進行が認められる1)。疾患進行のリスク因子として,①血清M蛋白量1.5g/dL以上,②非IgG型,③血清遊離軽鎖(κ/λ)比異常の3因子が示されており,進行割合を予測するモデルが提唱されている(図1)2)。くすぶり型多発性骨髄腫から(症候性)多発性骨髄腫あるいは全身性アミロイドーシスへの進行は,診断後の5年間は年10%,次の5年間は年3%,10年を超えると年1%に認められる3)。進行のリスク因子として①骨髄中形質細胞比率10%以上,②血清M蛋白濃度3g/dL以上,③血清遊離軽鎖比の大きな異常(κ/λ比で0.125以下もしくは8.0以上)の3因子を用いた予測モデルが提唱されている(図2)4)。しかし,従来のくすぶり型多発性骨髄腫の中で,診断後2年以内に80%以上の確率で多発性骨髄腫へ移行する可能性を予測する因子としてmyeloma-defining biomarker(SLiM:骨髄中形質細胞≧60%,involved/uninvolved血清遊離軽鎖比≧100,またはMRIで2カ所以上の5mmを超える巣状病変あり)の3因子が抽出された。これらのバイオマーカーを1つでも有する場合には,2014年の新IMWG規準では多発性骨髄腫(症候性)の範疇に含められた5)。ただし,バイオマーカーを有する患者のすべてが2年以内にCRAB徴候を発症するわけではなく,バリデーションも未実施であるため,日常診療において直ちに治療開始すべきか否かは議論のあるところである。日常診療においては,個々の患者の病態を見極めた上で,直ちに治療を開始するか,あるいは注意深い経過観察を行いCRAB徴候が出始める兆候があった時点で治療を開始するのかを判断すること望ましい(くすぶり型多発性骨髄腫:CQ1)。
骨や軟部組織(髄外)の孤立性形質細胞腫に対しては,40~50Gy(20~25分割)の局所放射線照射を行った後に無治療経過観察し,多発性骨髄腫に移行した場合にはじめて全身化学療法を考慮する6)。アジュバント療法としての化学療法は推奨されない(孤立性形質細胞腫:CQ1,エビデンスレベル3iiA)。なお多発性孤立性形質細胞腫に対しては,多発性骨髄腫と同様の治療方針が選択される。
現時点では,多発性骨髄腫は治癒を期待できる疾患ではない。しかし,治療介入により長期の生存が可能となっている疾患である。すなわち,良好な生活の質(quality of life:QOL)を維持しながら長期生存を目指すことが治療目標となる。一般に自家造血幹細胞移植併用大量化学療法(high-dose chemotherapy with autologous hematopoietic stem cell transplantation:HDC/AHSCT)の適応となる65歳未満の移植適応患者と,65歳以上あるいは重要臓器の障害のために自家造血幹細胞移植の適応とならない移植非適応患者によって異なった治療戦略が選択される。65歳という年齢はあくまで目安であり,日常臨床においては生物学的年齢を考慮した上で治療方針を決定する。移植適応患者では,化学療法および新規薬剤を用いた導入療法後の大量メルファラン(MEL)療法による完全奏効(complete response:CR)の達成が長期の無増悪生存期間,ひいては長期生存の代替えマーカーとなることが示されている7, 8)。また移植非適応患者においても,新規薬剤を併用した化学療法によりCR達成割合の増加が示されており,これまでゴールドスタンダードであったMP療法を凌ぐ生存期間の延長が期待できるようになった9)。
支持療法としては,デノスマブやビスホスホネート製剤の併用によって骨痛や病的骨折などの骨関連事象発生の減少効果のみならず,生存期間の延長効果も期待できるようになった10, 11)(支持療法:CQ1,エビデンスレベル1iiA)。また,腎障害のためにビスホスホネート製剤を使用しづらい場合にもヒト型抗RANKL(receptor activator of nuclear factor-κB ligand)モノクローナル抗体であるデノスマブは使用可能である12)(支持療法:CQ1,エビデンスレベル1iDiii)。デノスマブは投与後に重篤な低カルシウム血症をきたすことがあるため,ビタミンDとカルシウムの補充を予防的に行う。また,これらの薬剤は顎骨壊死(antiresorptive agent-related osteonecrosis of the jaw:ARONJ)などの特徴的な有害事象を有しており,治療介入により患者QOLを損なうことのないように適切な配慮が必要である(支持療法:CQ2)。また,骨髄腫細胞は放射線感受性が比較的良好であるため,限局性の溶骨病変や病的骨折部の除痛を目的とした場合や,脊髄あるいは神経根の圧迫が懸念される椎体病変に対しては局所放射線照射が有効である。さらに,骨髄腫に高頻度にみられる合併症である腎障害,原疾患および治療薬の副作用として現れやすい感染症(支持療法:CQ3),末梢神経障害や血栓症(支持療法:CQ4)に対する予防や支持療法など,きめ細かい配慮が必要となる。

(Rajkumar S V et al. Blood 2005; 106; 812-817より引用)
図1 MGUS患者の進展リスク
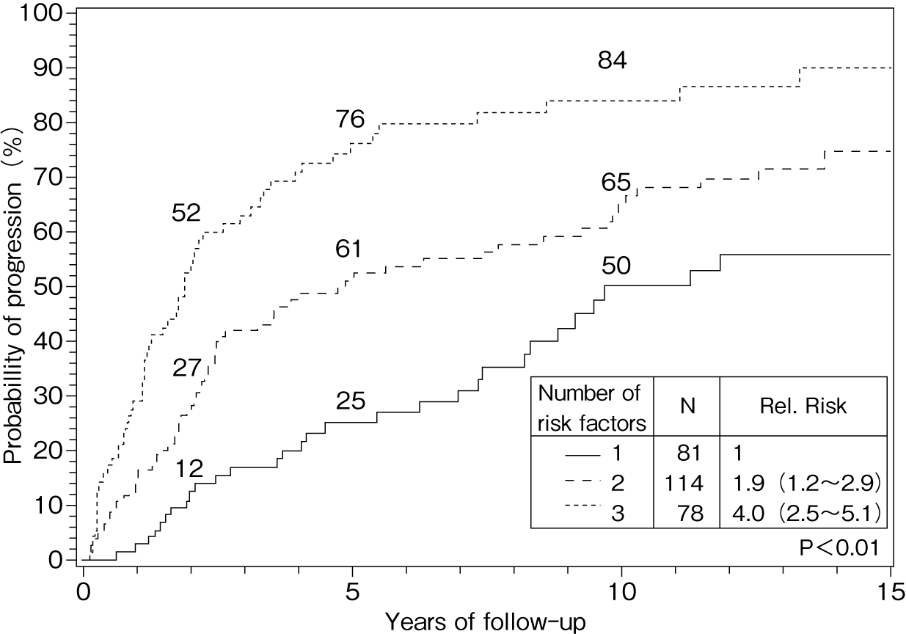
リスク因子:
骨髄中形質細胞割合≧10%,血清M蛋白濃度≧3g/dL,
血清遊離軽鎖比率の異常(κ/λ比:<0.125または>8.0)
(Dispenzieri A et al. Blood 2008 ; 111 : 785-789より引用)
図2 無症候性骨髄腫患者の進展リスク
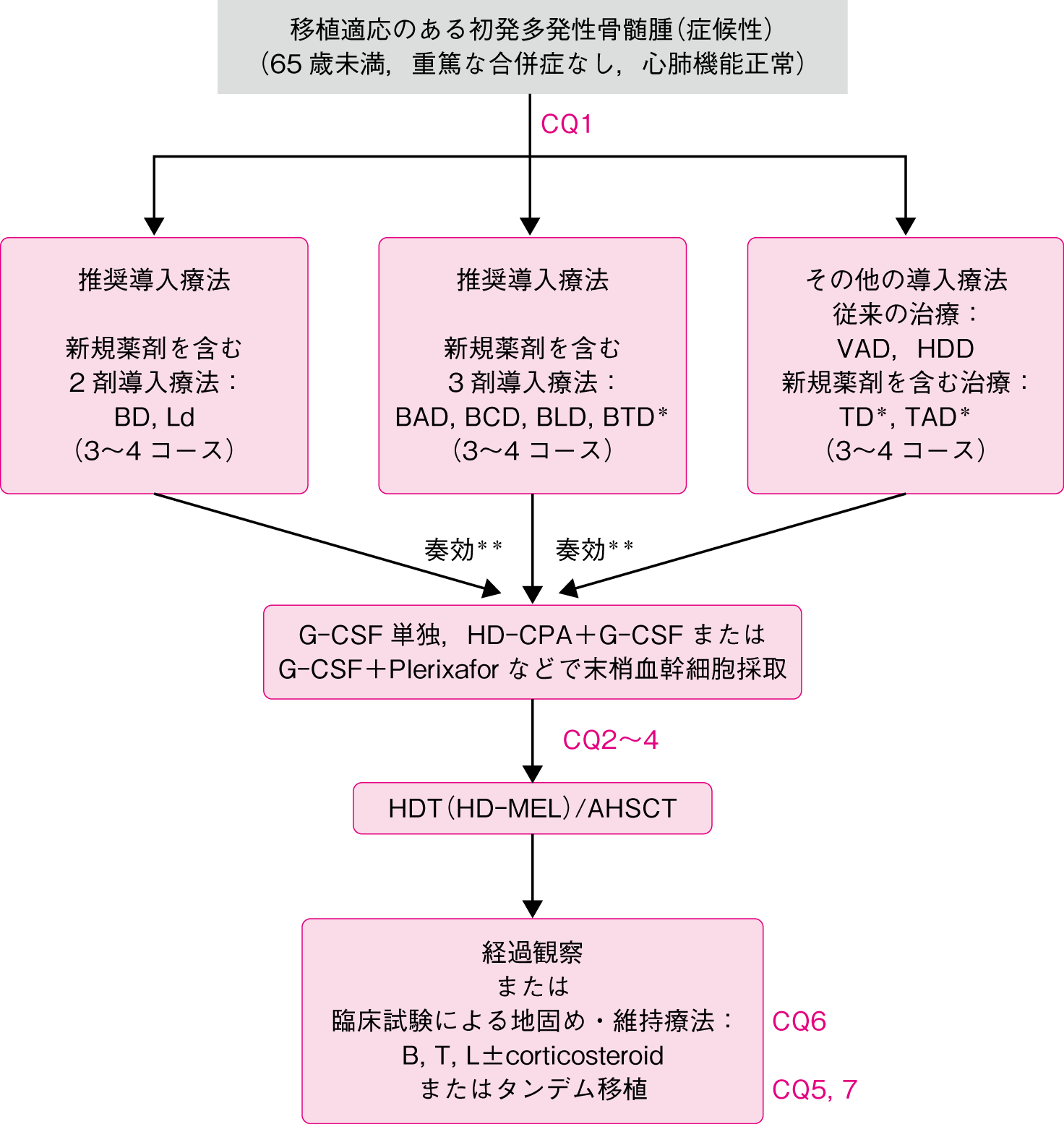
*国内保険適用外
**導入療法にて非奏効の場合は,導入療法の変更,あるいは再発・難治例に対する治療を選択
M(MEL): melphalan, P : prednisolone, B : bortezomib, T : thalidomide, L : lenalidomide,
C(CPA): cyclophosphamide, V : vincristine, A : doxorubicin, D : dexamethasone,
HDD : high-dose dexamethasone, d : low-dose dexamethasone, HDT : high-dose therapy,
AHSCT : autologous hematopoietic stem cell transplantation
1.移植適応のある初発多発性骨髄腫(症候性)患者
65歳未満で重要臓器機能の保持されている初発骨髄腫患者に対しては,効果が迅速で深い奏効を期待でき,かつ自家造血幹細胞採取効率に悪影響を与えない導入療法を施行(移植適応患者:CQ1,エビデンスレベル1iiDiv)後,自家造血幹細胞移植を併用した大量MEL療法を実施することが推奨される(移植適応患者:CQ2,CQ3,CQ4,エビデンスレベル1iiA)。移植適応患者に対する導入療法としてMELなどのアルキル化剤やレナリドミド(LEN)の長期投与を施行すると,造血幹細胞採取効率の低下につながることが知られており注意が必要である。推奨導入療法としては,高い奏効割合が期待できるボルテゾミブ(BOR)とデキサメタゾン(DEX)併用の導入療法(BD療法)があり,3~4コース施行後に自家末梢血幹細胞採取と保存を行う。より高い効果を期待できる導入療法として,新規薬剤を含む3剤併用療法であるBCD療法[BD+シクロホスファミド(CPA)],BAD療法[BD+ドキソルビシン(DXR)]やBLD療法[BD+レナリドミド(LEN)]があるが,同時に毒性も増強することに留意すべきである。腎障害を伴っていてもBORは使用しやすい薬剤である。しかし,肺の間質影や末梢神経障害が存在する場合などのBORによる毒性が懸念される場合には,Ld(LEN+少量DEX)療法,VAD療法(VCR,DXR,DEX)や大量DEX療法(high-dose dexamethason:HDD)なども選択肢となる。自家末梢血造血幹細胞は,G-CSF単独またはCPA大量療法にG-CSFを併用して採取し,CD34陽性細胞で2×106個/患者体重(kg)以上の造血幹細胞を得ることを目標とし凍結保存しておく。わが国においても,CX chemokine receptor 4(CXCR4)とstromal derived factor-1 alpha(SDF-1α)の相互作用を阻害するplerixafor(Mozobil)が承認され,G-CSFとの併用でより効率的に造血幹細胞採取が実施できるようになった。また再発時の救援療法としての2回目の自家造血幹細胞移植に備えて,2回分の造血幹細胞を凍結保存しておくことも選択肢となるが,使用期限を含めた凍結幹細胞の質的保証体制など施設の現状に合わせた運用が必要である。大量MEL療法は通常200mg/m2を2日間に分けて投与するが,腎障害がある場合には70%に減量する。2日目の大量MEL投与の翌々日に凍結しておいた自家末梢血造血幹細胞を輸注する。早期からの新規薬剤の使用により大量MEL療法を行うことなく同等の無増悪生存期間が得られるかどうかの臨床試験が複数行われているが,これまでに報告された試験結果からは大量MEL療法を組み込むことが65歳未満の患者に対する標準治療である(移植適応患者:CQ2,エビデンスレベル1iiDiii)。1回目の移植後の効果が最良部分奏効(VGPR)未満の患者においては,2回目の移植(タンデム移植)を実施することで無増悪生存期間(PFS)や全生存期間(OS)の延長効果が得られることが示されている(移植適応患者:CQ5,エビデンスレベル2A)。また新規薬剤時代の一部の臨床試験で,染色体高リスク患者に対するタンデム移植のPFS延長効果が示されている(移植適応患者:CQ5,エビデンスレベル2Diii)。しかし最近の欧米の臨床試験では,1回目の移植後の地固め療法や維持療法として新規薬剤が使用されておりPFSの延長効果,そして一部の臨床試験においてはOSの延長効果も示されている(移植適応患者:CQ6,エビデンスレベル1iiDiii)。しかし,いずれの薬剤を用いた場合も至適投与法(投与量,投与レジメンや投与期間など)は確立されておらず,一貫したOS延長効果が示されるには至っていない。したがって,地固め療法や維持療法は臨床試験での実施が望ましい。日常臨床においての地固め療法や維持療法は,薬剤耐性化や二次がんの発症を含めた有害事象のリスクと患者利益,そして医療経済的な側面をよく考えて,患者ごとに実施するかどうかを決定する必要がある。さらに治癒を目指して,自家造血幹細胞移植後に骨髄非破壊的同種造血幹細胞移植(ミニ移植)を実施する戦略も試みられているが,現段階では研究的治療の域を出ず,臨床試験としての実施が推奨される(移植適応患者:CQ7)。
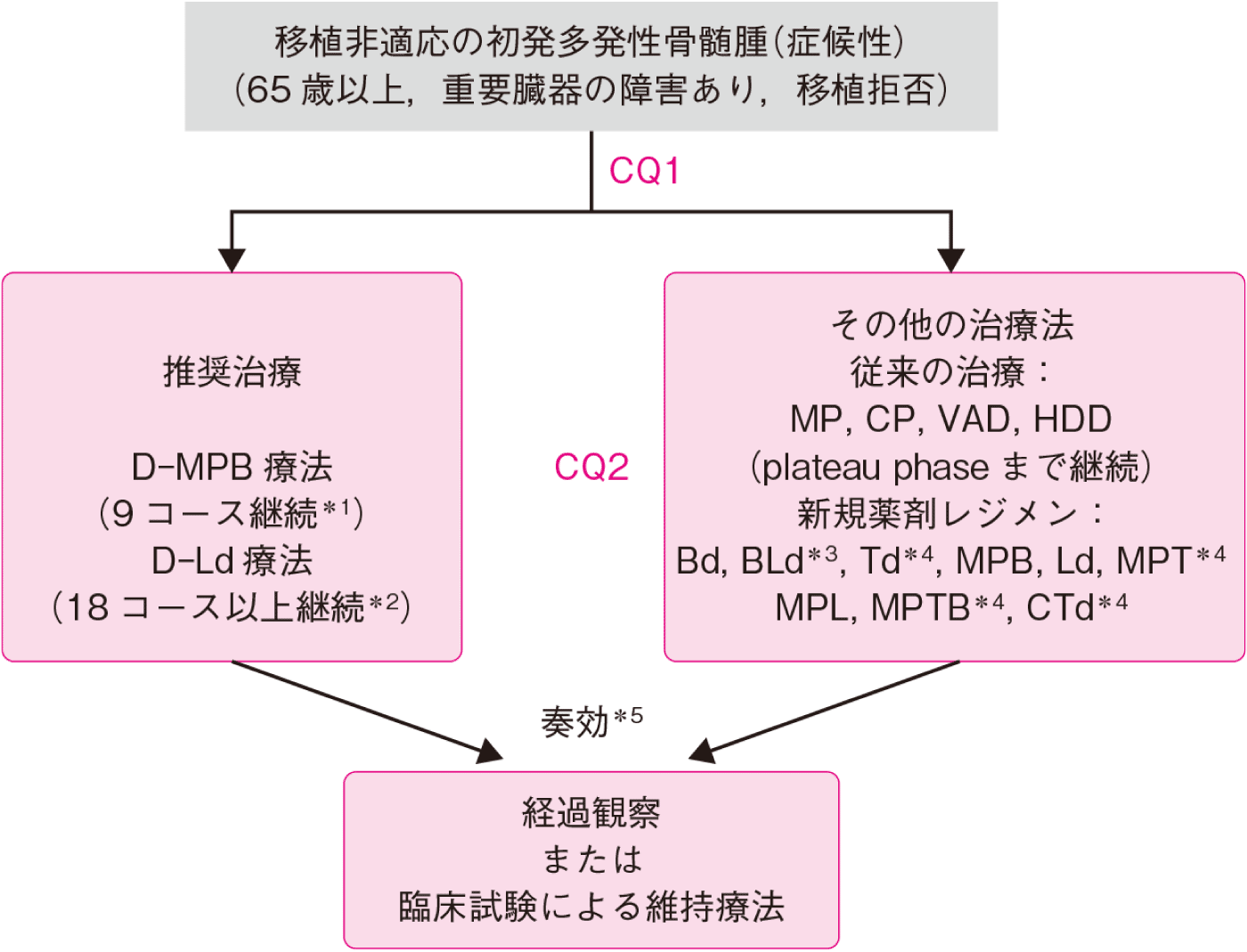
*1MPB療法は9コース継続する。ダラツムマブの投与期間に関するエビデンスはない。
*2Ld療法を18コースを超えて継続した場合,無増悪生存期間は延長するものの全生存期間を延長するというエビデンスはない。D-Ld療法の場合の投与期間に関するエビデンスはない。
*3移植非適応患者に対するBLd療法のエビデンスは十分ではない。毒性軽減を目的としてmodified BLd療法の開発がなされているが,ランダム化試験は実施されていない。
*4国内保険適用外
*5導入療法にて非奏効の場合は,導入療法の変更,あるいは再発・難治例に対する治療を選択
B:間質性肺炎,重篤な末梢神経障害を有する場合は不適
L:血栓症や進行性の腎障害を有する場合は不適
T:血栓症や重篤な末梢神経障害を有する場合は不適
2.移植非適応の初発症候性骨髄腫患者
移植非適応患者に対する標準治療は現在,D-MPB療法(DARA,MEL,PSL,BOR)またはD-Ld療法(DARA,LEN,少量DEX)である。MPB療法は,40年以上にわたって標準治療であったMP療法(MEL,PSL)に比してPFSの延長効果のみでなくOSの延長効果も示されている。Ld療法は,MP療法よりもOSを延長する効果を示したMPT療法(MEL,PSL,THAL)とのランダム化比較試験において,PFSおよびOSの延長効果を示した。D-MPB療法はMPB療法に比して,そしてD-Ld療法はLd療法に比して,PFSの延長効果を示した(移植非適応の未治療骨髄腫:CQ1,エビデンスレベル1iiA)。患者年齢や末梢神経障害,血栓症などのリスクや肺の間質影の合併の有無などを考慮して,従来のMP療法やMPB療法,Ld療法,そしてわが国では保険適用外であるがMPT療法などの化学療法の選択肢もある。MPB療法やMPT療法では,通常9コースまで継続することを目標とするが,治療継続期間を比較検討した臨床試験は存在しない。Ld療法の継続投与は,18コースで終了した場合に比較してPFSの延長が示されている。ただし,全生存期間の延長効果は明らかではなく,18コースを超えての継続投与に関しては染色体リスク,臨床効果,毒性や医療費負担などを考慮して個別に決定すべきである。また,米国ではBLd療法(BOR,LEN,DEX)が移植非適応患者における標準治療と位置づけられている13)。しかし,その根拠となるSWOG S0777試験における登録患者の57%が65歳未満の患者であること,そしてBLd療法を受けた患者のおよそ1/3でGrade 3の末梢神経障害を認めたことから,わが国における移植非適応患者の標準治療と位置づけることは困難である。
現在,ボルテゾミブを週1回の皮下注射で投与したさまざまなmodified BLd療法の開発が進んでおり,その結果を待って高齢者にも推奨できるか否か判断すべきであろう。MP療法で代表される従来の化学療法の場合は,プラトー[安定(SD)/不変(NC)以上の効果判定がなされた時点を規準にしてM蛋白量等の計測値の変化が±25%以内で3カ月以上継続した場合]に至るまで継続して治療を終了することが一般的であり,それ以上の治療継続は患者利益に結びつかないことが示されている(移植非適応の未治療骨髄腫:CQ1,エビデンスレベル1iiA)。また,LENやTHALなどの免疫調節薬は,DEXとの併用により相乗効果が期待できるが,高齢患者に対する大量DEXの投与は感染症,血栓症や白内障を誘発することが示されており,年齢に応じた減量が勧められる(移植非適応の未治療骨髄腫:CQ2,エビデンスレベル1iiA)。移植非適応患者に対する導入療法後の維持療法については,PFS延長効果を示す試験結果があるものの,OSの延長効果を示した大規模試験は限られており,実施する場合は臨床試験の範疇で行うことが勧められる。
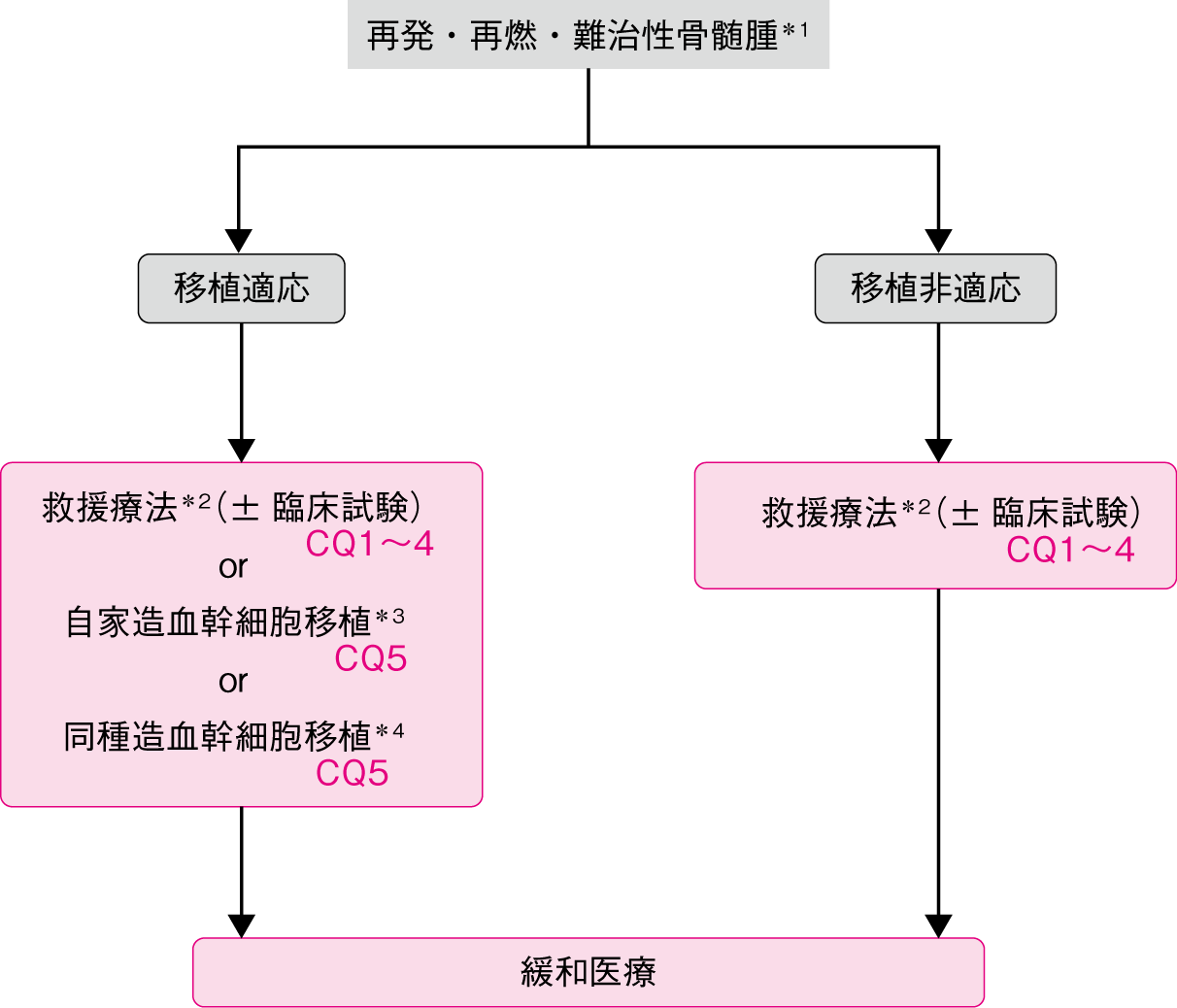
*1自家移植後も含む。M蛋白増加速度が早い,LDH上昇など劇症型再発や高リスク染色体病型は直ちに救援療法を導入することを推奨する。M蛋白増加速度が緩やかなbiochemical relapseは,4〜6週ごとに経過観察しつつ治療開始時期を判断する。
*2救援療法の選択:①初回治療終了時から9〜12カ月以上経過後の再発・再燃であれば,初回治療と同じキードラッグを用いた救援療法を試みてもよい。②初回治療終了時から9〜12カ月未満の再発・再燃に対しては,キードラッグとなる新規薬剤を変更した救援療法を選択する。
*3救援療法としての自家造血幹細胞移植は,18カ月以上の初回移植後奏効期間が得られた染色体標準リスク患者で有効性が高い。
*4同種造血幹細胞移植は,移植片対骨髄腫効果が期待できるが,治療関連死亡のリスクも高く,研究的治療との位置づけである。
3.再発・難治性骨髄腫患者
再発・難治例に対しては,初回治療の最終投与日から9~12カ月以上経過してからの再発・再燃であれば初回導入療法に対する感受性を有している場合も多く,初回導入療法で用いたキードラッグ(プロテアソーム阻害薬や免疫調節薬)を含む2~3剤併用の救援療法を試みてもよいし,初回に使用していないキードラッグを含む治療レジメンに変更してもよい(再発・難治性骨髄腫:CQ1,CQ2,CQ3,CQ4,エビデンスレベル1Diiiまたは1A)。初回治療終了後9〜12カ月未満の再発・再燃や治療中の進行や増悪の場合には,初回治療で使用していないキードラッグを含む救援療法の選択が推奨される(表1)。薬剤選択においては,既治療レジメン内容や患者の有する合併症や臓器機能障害の有無などを考慮する必要がある。一般にプロテアソーム阻害薬または免疫調節薬とDEXの2剤併用療法は,外来で実施しやすく患者の負担が少ない。また,3剤併用療法の方が一般的に臨床的効果は高いが毒性も増強することがあり,個々の患者の状態を把握した上で治療レジメンを決定する(再発・難治性骨髄腫:CQ2,CQ3,CQ4,エビデンスレベル1iiDiiiまたは1iiA)。移植適応のある60歳未満の患者においては,救援療法が奏効した場合には2回目の自家造血幹細胞移植併用の大量MEL療法を行うという選択もあり,特に染色体標準リスクで初回移植後に長期の奏効期間を示した患者で有効性が高い(再発・難治性骨髄腫:CQ5,エビデンスレベル1iiDiii)。同様に救援療法が奏効してHLA適合ドナーがいる場合には,同種造血幹細胞移植という選択肢もあるが,移植後早期の死亡率が高く再発・再燃も高頻度であることから,臨床試験の範疇で行われることが望ましい(再発・難治性骨髄腫:CQ5)。
表1 再発・難治性骨髄腫患者に対する新規薬剤を中心とした救援療法
| Pl-basedBOR BOR/DEX BOR/PLD* BOR/CPA/DEX BOR/DEX/PAN CFZ 20-27* CFZ 20-56/DEX CFZ 20-70 weekly/DEX |
IMiD-basedLEN/DEX LEN/CPA/DEX LEN/DXR/DEX THAL THAL/DEX THAL/DEX/PLD* THAL/DEX/CPA POM/DEX |
|---|---|
| Pl/IMiD-basedBOR/LEN/DEX BOR/THAL/DEX CFZ/LEN/DEX CFZ/POM/DEX IXA/LEN/DEX BOR/POM/DEX |
mAb-alone/combinationDARA* LEN/DEX/DARA BOR/DEX/DARA LEN/DEX/ELO POM/DEX/ELO |
| その他 | |
| High-dose CPA DEX/CPA/ETP*/CDDP*(DCEP) DEX/THAL/CDDP*/DXR/CPA/ETP*(DT-PACE)±BOR(BDT-PACE) Bendamustine* |
|
上記の救援療法の中で,わが国における推奨投与量や安全性・有効性の確立していないレジメンについては臨床試験の範疇で実施されることが望ましい。
* PLD, ETP, CDDP, Bendamustine, CFZ 20-27単剤,DARA単剤:国内保険適用外
Pl : proteasome inhibitor, IMiD : immunomodulatory drug, mAb : monoclonal antibody, BOR(B): bortezomib, LEN(L): lenalidomide, THAL(T): thalidomide, DEX : dexamethasone, PLD : pegylated liposomal doxorubicin, DXR(A): doxorubicin, CPA : cyclophosphamide, ETP : etoposide, CDDP : cisplatin, PAN : panobinostat, POM : pomalidomide, CFZ : carfilzomib, IXA : ixazomib, DARA : daratumumab, ELO : elotuzumab
参考文献
1)Kyle RA, et al. A long-term study of prognosis in monoclonal gammopathy of undetermined significance. N Engl J Med. 2002 ; 346 (8) : 564-9.
2)Rajkumar SV, et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood. 2005 ; 106 (3) : 812-7.
3)Kyle RA, et al. Clinical course and prognosis of smoldering (asymptomatic) multiple myeloma. N Engl J Med. 2007 ; 356 (25) : 2582-90.
4)Dispenzieri A, et al. Immunoglobulin free light chain ratio is an independent risk factor for progression of smoldering (asymptomatic) multiple myeloma. Blood. 2008 ; 111 (2) : 785-9.
5)Rajkumar SV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 ; 15 (12) : e538-48.
6)Weber DM. Solitary bone and extramedullary plasmacytoma. Hematology Am Soc Hematol Educ Program. 2005 ; 373-6.
7)Martinez-Lopez J, et al. Long-term prognostic significance of response in multiple myeloma after stem cell transplantation. Blood. 2011 ; 118 (3) : 529-34.
8)Harousseau JL, et al. Achievement of at least very good partial response is a simple and robust prognostic factor in patients with multiple myeloma treated with high-dose therapy : Long-term analysis of the IFM99-02 and 99-04 trials. J Clin Oncol. 2009 ; 27 (34) : 5720-6.
9)Gay F, et al. Complete response correlates with long-term progression-free and overall survival in elderly myeloma treated with novel agents : analysis of 1175 patients. Blood. 2011 ; 117 (11) : 3025-31.
10)Berenson JR, et al. Efficacy of pamidronate in reducing skeletal events in patients with advanced multiple myeloma. Myeloma Aredia Study Group. N Engl J Med. 1996 ; 334 (8) : 488-93. (1iDiii)
11)Morgan GJ, et al. First-line treatment with zoledronic acid as compared with clodronic acid in multiple myeloma (MRC Myeloma IX) : a randomized controlled trial. Lancet. 2010 ; 376 (9757) : 1989-99. (1iiA)
12)Raje N, et al. Comparison of denosumab with zoledronic acid for the treatment of bone disease in patients with newly diagnosed multiple myeloma ; An international, randomized, double blind trial. Lancet Oncol. 2018 ; 19 (3) : 370-81. (1iDiii)
13)Durie BG, et al. Bortezomib with lenalidomide and dexamethasone versus lenalidomide and dexamethasone alone in patients with newly diagnosed myeloma without intent for immediate autologous stem-cell transplant (SWOG S0777) : a randomized, open-label, phase 3 trial. Lancet. 2017 ; 389 (10068) : 519-27. (1iiDiii/1iiA)
【くすぶり型多発性骨髄腫】
CQ1 くすぶり型多発性骨髄腫患者に対して診断後直ちに化学療法を実施することは妥当か
- 推奨グレード
- カテゴリー3
くすぶり型多発性骨髄腫患者に対して診断後直ちに化学療法を実施することは,臓器障害発現時まで化学療法の開始を待つ戦略に比べて,生存期間の延長効果は認められず推奨されない。しかし,2014年に改訂されたIMWG診断規準で多発性骨髄腫(症候性)に組み入れられた高リスク群(骨髄形質細胞比率≧60%,遊離軽鎖比≧100,MRIで2つ以上のfocal lesionを持つ)1)では,比較的早期の経過で高率に症候性骨髄腫への進展を認める可能性が高いことから治療開始も選択肢となるが,経過観察が可能であれば慎重に経過観察を行い,増悪を認めた時点で直ちに治療を開始する。
解説
くすぶり型多発性骨髄腫(smoldering myeloma)の診断後,直ちに治療介入を行う場合(initial therapy:IT)と増悪まで待ってから化学療法を行う場合(deferred therapy:DT)のランダム化比較試験が行われている。
①通常化学療法:無症候性でDurie & Salmon(D&S)分類の病期Ⅰに相当する50例の骨髄腫患者をIT群とDT群にランダム化してMP療法(MEL,PSL)を行った試験では,両群間の奏効割合,生存期間には有意差を認めなかった2)。D&S病期Ⅰの骨髄腫145例(88%は無症候性)を2群にランダム化してMP療法を行った試験では,50%生存期間(MST)はIT群で64カ月,DT群で71カ月と有意差は認めなかった(p=0.64)3)。
②新規薬剤:THAL投与の第Ⅲ相試験が実施され,症候性多発性骨髄腫に至るまでの期間(PFS)は延長するがOS延長には寄与しなかった4)。高リスクの無症候性骨髄腫119例を対象としたLEN+DEX療法群と無治療経過観察群のランダム化比較試験が実施され,症候性骨髄腫に至るまでの期間(PFS)を延長し,OS延長にも寄与するとの報告がなされている5)。ただし,本試験における高リスクの定義には,フローサイトメトリーで同定された骨髄中の腫瘍性形質細胞比率やuninvolved免疫グロブリンの減少を含む独自の基準を用いていることに注意が必要である。
しかし,2014年の改訂IMWG診断規準において,旧規準のくすぶり型多発性骨髄腫に相当し, 2年以内に80%の確率で臓器障害を発現する可能性を予測するバイオマーカー(myeloma-defining biomarker:SLiM;骨髄形質細胞比率≧60%,遊離軽鎖比≧100,MRIで2つ以上のfocal lesionを持つ)を有していれば多発性骨髄腫(症候性)に分類されることとなった1)。
2014年の改定IMWG分類で規定される「くすぶり型多発性骨髄腫」に対する治療介入は臨床試験に限定すべきであり,日常診療での実施は推奨されない。
参考文献
1)Rajkumar SV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 ; 15 (12) : e538-48.
2)Hjorth M, et al. Initial versus deferred melphalan-prednisone therapy for asymptomatic multiple myeloma stage I A randomized study. Eur J Haematol. 1993 ; 50 (2) : 95-102. (2A)
3)Riccardi A, et al. Long-term survival of stage I multiple myeloma given chemotherapy just after diagnosis or at progression of the disease : a multicenter randomized study. Br J Cancer. 2000 ; 82 (7) : 1254-60. (1iiA)
4)Witzig TE, et al. A phase III randomized trial of thalidomide plus zoledronic acid versus zoledronic acid alone in patients with asymptomatic multiple myeloma. Leukemia 2013 ; 27 : 220-25. (1iiDiii)
5)Mateos MV, et al. Lenalidomide plus dexamethasone for high-risk smoldering multiple myeloma. New Engl J Med. 2013 ; 369 (5) : 438-47. (1iiDiii/1iiA)
CQ2 くすぶり型多発性骨髄腫患者に対するビスホスホネート製剤の投与は妥当か
- 推奨グレード
- カテゴリー4
くすぶり型多発性骨髄腫に対するビスホスホネート製剤の投与は,増悪時の骨関連事象の合併頻度を減少させるが,症候性多発性骨髄腫に至るまでの期間や生存期間を延長させる効果は認められず,積極的な投与は推奨されない。
解説
くすぶり型多発性骨髄腫患者を対象としたゾレドロン酸4mgの月1回で1年間の投与群と無治療群のランダム化第Ⅲ相比較試験(n=163)1)と,パミドロネート60~90mgの月1回で1年間の投与群と無治療群のランダム化第Ⅲ相比較試験(n=177)が実施されている2)。1年間のビスホスホネート製剤の投与は実施可能なレジメンであるが,いずれの試験でも主要評価項目である臓器障害の出現で定義される多発性骨髄腫(症候性)への進展までの期間(TTP)や全生存期間(OS)には有意差はなかった。多発性骨髄腫(症候性)へ移行時の貧血,腎障害や髄外腫瘤形成などの発現頻度には両群間での差は認められなかったが,骨関連事象(skeletal-related events:SRE)の発現率はビスホスホネート投与群で有意に減少することが示されている(ゾレドロン酸55.5% vs 78.8%:p=0.041,パミドロネート39.2% vs 72.7%:p=0.009)。
また,ゾレドロン酸と同様に多発性骨髄腫の骨病変に有効なヒト型抗RANKLモノクローナル抗体製剤デノスマブもくすぶり型骨髄腫に対する有用性は示されていない。
参考文献
1) Musto P, et al. A multicenter, randomized clinical trial comparing zoledronic acid versus observation in patients with asymptomatic myeloma. Cancer. 2008 ; 113 (7) : 1588-95. (1iiDiii)
2) D’Arena G, et al. Pamidronate versus observation in asymptomatic myeloma : fi nal results with long-term follow-up of a randomized study. Leuk & Lymphoma. 2011 ; 52 (5) : 771-5. (1iiDiii)
【移植適応のある初発多発性骨髄腫(症候性)】
CQ1 若年者症候性骨髄腫患者における移植を前提とした寛解導入療法では何が優れているか
- 推奨グレード
- カテゴリー1
移植を前提とした寛解導入療法としてボルテゾミブを含むレジメン,レナリドミドを含むレジメンが推奨される。
解説
自家造血幹細胞移植適応症例における初期治療として,ボルテゾミブ(BOR)やレナリドミド(LEN)などの新規薬剤を用いた寛解導入療法が推奨される。BD(BOR,DEX)やBAD(BOR,DXR,DEX)はVADとの比較で,BTD(BOR,THAL,DEX)はTD(THAL,DEX)との比較で寛解導入および自家移植後のVGPR以上の奏効割合が有意に優れていた1, 2)。BTDはTDに比べGrade 3以上の末梢神経障害(PN)が有意に多いが,BORとTHALの用量を減量したbtDはBDとの比較で移植後のVGPR以上の奏効割合は有意に高く,一方Grade 2以上のPNは有意に少なかった3)。BORを含む3剤どうしの比較も行われ,BCD(BOR,CPM,DEX)とBADとの比較では,寛解導入療法後のCR,VGPR以上,PR以上の奏効割合は両群間で有意差はないが,進行(PD)はBCDで有意に少なかった4)。また重篤な有害事象はBCDで少なく,BCDはBADより優れていた。BCDとBTDとの比較では,PRあるいはVGPR以上の奏効割合は有意にBTDが優れていた5)。初発時にup-front settingでの移植を希望しない対象患者での研究であるが,BLD(BOR,LEN,DEX)とLD(LEN,DEX)との比較では,CR率はBLDで高くPFS,OSともにBLDが優れていたが初期治療中の有害事象による中止率はBLDで高かった6)。一方,65歳以下を対象として,BLDによる寛解導入後に自家移植を行う群とBLD継続群を比較した試験では移植群のPFSは50カ月,CR以上の奏効割合は59%,OS(4年)は81%であった7)。LENについてはLD(LEN,DEX)がDEX大量より有意に優れ8),さらにLENと高用量DEX(LD)とLENと低用量DEX(Ld)の比較で,4コース後のPR以上の奏効割合はLDが有意に優れていたが,1年OSはLdが有意に優れていた9)。THALについては,TAD(THAL,DXR,DEX)とVADとの比較で自家移植後のVGPR以上の奏効割合はTADが優れていたが,CTD(CPM,THAL,DEX)とCVADの比較では自家移植後のVGPR以上の奏効割合に有意差はなかった10, 11)。以上より,BD,BAD,BCD,BT(bt)D,BLD,Ldが推奨される。なお,本邦における新規薬剤の未治療例に対する保険適用はBORとLENに限られる。
参考文献
1) Harousseau JL, et al. Bortezomib plus dexamethasone is superior to vincristine plus doxorubicin plus dexamethasone as induction treatment prior to autologous stem-cell transplantation in newly diagnosed multiple myeloma : Results of the IFM2005-01 trial. J Clin Oncol. 2010 ; 28 (30) : 4621-9. (1iiDiv)
2) Cavo M, et al. Bortezomib with thalidomide plus dexamethasone compared with thalidomide plus dexamethasone as induction therapy before, and consolidation therapy after, double autologous stem-cell transplantation in newly diagnosed multiple myeloma : a ransomized phase III study. Lancet Oncol. 2010 ; 376 (9758) : 2075-85. (1iiDiv)
3) Moreau P, et al. Bortezomib plus dexamethasone versus reduced-dose bortezomib, thalidomide plus dexamethasone as induction treatment prior to autologous stem cell transplantation in newly diagnosed multiple myeloma. Blood. 2011 ; 118 (22) : 5752-8. (1iiDiv)
4) Mai EK, et al. Phase III trial of bortezomib, cyclophosphamide and dexamethasone (VCD) versus bortezomib, doxorubicin and dexamethasone (PAd) in newly diagnosed myeloma. Leukemia. 2015 ; 29 (8): 1721-9. (1iiDiv)
5) Moreau P, et al. VTD is superior to VCD prior to intensive therapy in multiple myeloma : results of the prospective IFM2013-04 trial. Blood. 2016 ; 127 (21) : 2569-74. (1iiDiv)
6) Durie BG, et al. Bortezomib with lenalidomide and dexamethasone versus lenalidomide and dexamethasone alone in patients with newly diagnosed myeloma without intent for immediate autologous stem-cell transplant (SWOG S0777) : a randomised, open-label, phase 3 trial. Lancet. 2017 ; 389 (10068) : 519-27. (1iiDiii)
7) Attal M, et al. Lenalidomide, bortezomib, and dexamethasone with transplantation for myeloma. N Engl J Med. 2017 ; 376 (14) : 1311-20. (1iiDiii)
8) Zonder JA, et al. Lenalidomide and high-dose dexamethasone compared with dexamethasone as initial therapy for multiple myeloma : a randomized Southwest Oncology Group (S0232). Blood. 2010 ; 116 (26) : 5838-41. (1iiDiii)
9) Rajkumar SV, et al. Lenalidomide plus high-dose dexamethasone versus lenalidomide plus low-dose dexamethasone as initial therapy for newly diagnosed multiple myeloma : an open-label randomized controlled trial. Lancet Oncol. 2010 ; 11 (1) : 29-37. (1iiDiv)
10)Lokhorst HM, et al. A randomized phase 3 study on the effect of thalidomide combined with adriamycin, dexamethasone, and high-dose melphalan, followed by thalidomide maintenance in patients with multiple myeloma. Blood. 2010 ; 115 (6) : 1113-20. (1iiDi/1iiDiii)
11)Morgan GJ, et al. Cyclophosphamide, thalidomide, and dexamethasone as induction therapy for newly diagnosed multiple myeloma patients destined for autologous stem-cell transplantation : MRC Myeloma IX randomized trial results. Haematologica 2012 ; 97 (3) : 442-50. (1iiDiv)
CQ2 若年者症候性骨髄腫患者に対する自家造血幹細胞移植併用療法は薬物療法単独と比べて生存期間を延長させるか
- 推奨グレード
- カテゴリー1
若年者症候性骨髄腫に対して自家造血幹細胞移植併用療法は薬物療法単独と比べて無増悪生存期間を延長させることから推奨される。
解説
65歳未満の若年者骨髄腫を対象とした自家造血幹細胞移植併用大量化学療法(high-dose chemotherapy with autologous hematopoietic stem cell transplantation:HDC/AHSCT)と通常量化学療法との第Ⅲ相比較試験が多数報告されている。9つのランダム化比較試験による2,411例のメタアナリシスが報告されている。対象年齢を70歳までとした試験も含まれているが,HDC/AHSCTはOSで標準化学療法と差はなかったが,PFSで有意に優れていた1)。OSで差がみられなかったことは再発時のHDC/AHSCTによるサルベージ効果で説明されている。その後,新規薬剤が登場したことにより,現在でもupfrontにHDC/AHSCTが必要であるかが検討されている。レナリドミド+デキサメタゾン(Ld)4コースの寛解導入療法後に,HDC/AHSCT(タンデム移植)群とメルファラン+プレドニゾロン+レナリドミド(MPL)6コース群にランダム化した第Ⅲ相試験では,PFS中央値(43カ月 vs 22.4カ月,p<0.001),4年OS(81.6% vs 65.3%,p=0.02)ともに有意にHDC/AHSCT群が優れていた2)。HDC/AHSCTとレナリドミド+シクロホスファミド+デキサメタゾン(LCD)にランダム化した試験では,PFS中央値(43.3カ月 vs 28.6カ月,p<0.0001),4年OS(86% vs 73%,p=0.004)ともにHDC/AHSCT群が有意に優れていた3)。これらの2つの試験は,導入療法にボルテゾミブが使用されてなかったが,IFM2009試験では,ボルテゾミブ+Ld(BLd)療法3コースの導入療法後にHDC/AHSCTを行い,その後2コースのBLdとレナリドミド維持療法を行う群と,8コースのBLdとレナリドミド維持療法を行う群にランダム化している。この試験でもPFS中央値(50カ月 vs 36カ月)と有意にHDC/AHSCT群が優れていた4)。これらの結果より,65歳未満の若年者においてHDC/AHSCTは,薬物療法単独よりPFSを延長させると考えられ推奨できる。ただし,治療関連死亡(TRM)のリスクが上昇するので注意を要する。
参考文献
1)Koreth J, et al. High-dose therapy with single autologous transplantation versus chemotherapy for newly diagnosed multiple myeloma : A systematic review and meta-analysis of randomized controlled trials. Biol Blood Marrow Transplant. 2007 ; 13 (2) : 183-96. (1iiDiii)
2)Palumbo A, et al. Autologous transplantation and maintenance therapy in multiple myeloma. N Engl J Med. 2014 ; 371 (10) : 895-905. (1iiDiii/1iiA)
3)Gay F, et al. Chemotherapy plus lenalidomide versus autologous transplantation, followed by lenalidomide plus prednisone versus lenalidomide maintenance, in patients with multiple myeloma : a randomised, multicentre, phase 3 trial. Lancet Oncol. 2015 ; 16 (16) : 1617-29. (1iiDiii/1iiA)
4)Attal M, et al. IFM 2009 Study. Lenalidomide, Bortezomib, and Dexamethasone with Transplantation for Myeloma. N Engl J Med. 2017 ; 376 (14) : 1311-20. (1iiDiii)
CQ3 若年者症候性骨髄腫患者に対して寛解導入後早期に自家造血幹細胞移植を行うことは再発時に移植を行うよりも勧められるか
- 推奨グレード
- カテゴリー1
若年者症候性骨髄腫患者に対して寛解導入後早期に自家造血幹細胞移植を行うことは再発時に移植を行う場合と比べて無症状・無治療かつ副作用のない期間を延長させることから推奨される。
解説
自家移植を寛解導入療法後早期に実施すべきか,再発時に実施すべきかを無作為で比較検討した試験がフランスから報告されている1)。本試験ではOSには差はみられないが,早期に実施することで無イベント生存期間(EFS)(39カ月 vs 13カ月)およびTWiSTT(time without symptoms,treatment,and treatment toxicity:無治療かつ副作用なく無症状の期間)(27.8カ月 vs 22.3カ月)が延長することが示されている。一方,自家移植と通常量化学療法とのランダム化比較試験であるUS S9321試験において両群間でOSに差はみられなかったが,これは化学療法群でも再発時に多くが自家移植を受けたことによると考えられ,このことは再発時の移植も有用であることを示している2)。自家移植と通常量化学療法とのランダム化比較試験のメタアナリシスでも同様のことが指摘されている3)。しかし,早期に移植を受けない場合は長期間化学療法が継続されることになり,その結果,臓器障害や長期のアルキル化剤曝露による二次性骨髄異形成症候群のリスクを高めることになる。
一方,新規薬剤導入後の試験として,レナリドミド+デキサメタゾン(Ld)による寛解導入療法後に,自家移植(タンデム移植)群とメルファラン+プレドニゾロン+レナリドミド(MPL)6コース群にランダム化した第Ⅲ相試験,同様に寛解導入療法後に自家移植群とレナリドミド+シクロホスファミド+デキサメタゾン(LCD)群にランダム化した試験がある。いずれの試験においても非移植群で再発後に自家移植が行われたが,PFS,4年OSともに自家移植群が有意に優れていた4, 5)。一方,IFM2009試験では,ボルテゾミブ+Ld(BLd)療法3コースの導入療法後に自家移植を行い,その後2コースのBLdとレナリドミド維持療法を行う群と,8コースのBLdとレナリドミド維持療法を行う群にランダム化された。この試験ではPFSは中央値(50カ月 vs 36カ月)と有意に自家移植群が優れていたが,4年OSでは有意差はみられなかった(81% vs 82%)。再発時の移植の有用性を示した試験でもあるが,微小残存腫瘍(MRD)陽性例は自家移植群で少なかった6)。以上より,現時点では寛解導入後早期の自家移植は推奨できる。
参考文献
1)Fermand JP, et al. High-dose therapy and autologous blood stem cell transplantation in multiple myeloma : Up-front or rescue treatment? Results of a multicenter sequential randomized clinical trial. Blood. 1998 ; 92 (9) : 3131-6. (1iiA)
2)Barlogie B, et al. Standard chemotherapy compared with high-dose chemoradiotherapy for multiple myeloma : Final results of phase Ⅲ US intergroup trial S9321. J Clin Oncol. 2006 ; 24 (6) : 929-36. (1iiA)
3)Koreth J, et al. High-dose therapy with single autologous transplantation versus chemotherapy for newly diagnosed multiple myeloma : A systematic review and meta-analysis of randomized controlled trials. Biol Blood Marrow Transplant. 2007 ; 13 (2) : 183-96. (1iiDiii)
4)Palumbo A, et al. Autologous transplantation and maintenance therapy in multiple myeloma. N Engl J Med. 2014 ; 371 (10) : 895-905. (1iiDiii)
5)Gay F, et al. Chemotherapy plus lenalidomide versus autologous transplantation, followed by lenalidomide plus prednisone versus lenalidomide maintenance, in patients with multiple myeloma : a randomised, multicentre, phase 3 trial. Lancet Oncol. 2015 ; 16 (16) : 1617-29. (1iiDiii)
6)Attal M, et al. IFM 2009 Study. Lenalidomide, Bortezomib, and Dexamethasone with Transplantation forvMyeloma. N Engl J Med. 2017 ; 376 (14) : 1311-20. (1iiDiii)
CQ4 自家造血幹細胞移植における前処置として大量メルファラン療法は全身放射線照射を含む前処置と比べて優れているか
- 推奨グレード
- カテゴリー1
自家造血幹細胞移植における前処置として大量メルファラン療法が推奨される。
解説
65歳未満の初発例を対象としたフランスのランダム化試験では,VAD療法(VCR,DXR,DEX)による寛解導入後メルファラン(MEL)200mg/m2(MEL200)群とMEL 140mg/m2+全身照射(8Gy)群に割り付けられている1)。結果として,完全奏効(CR)割合は両群で有意差はみられなかった(35% vs 29%)がCR+最良部分奏効(VGPR)割合はMEL200群で良好な結果であった(55% vs 43%,p=0.06)。各群21.0カ月と20.5カ月の観察期間で,45カ月後の全生存割合(OS)は65.8%と45.5%でMEL200群が有意に優れていた(p=0.05)。一方,無イベント生存期間(EFS)はそれぞれ20.5カ月と20カ月で有意差はみられなかった。好中球減少,血小板減少,入院期間,静脈内抗生剤投与期間はいずれもMEL200群で短く(p<0.001),血小板および赤血球輸血はいずれもMEL200群で少なかった(p<0.001)。口内炎(Grade 3~4)もMEL200群で有意に少なかった(30% vs 51%,p<0.001)。以上より,MEL 200mg/m2が移植前処置として推奨される。
MEL200をより強化したレジメン[MEL200+イダルビシン(IDR)42mg/m2+シクロフォスファミド(CPA)120mg/kg]とMEL200との比較試験でも強化レジメンで有害事象が多くMEL200に勝るものではなかった2)。
スペインからはPETHEMA/GEM2000試験の中でブスルファン(BU)12mg/kg+MEL 140mg/m2(BU/MEL)を受けた最初の225例をその後のMEL 200mg/m2を受けた542例と比較しているが,BU/MELで肝中心静脈閉塞症による治療関連死亡(TRM)が有意に高い(8.4% vs 3.5%,p=0.002)こと,奏効割合は同等でPFS中央値は有意に長い(41カ月 vs 31カ月,p=0.009)がOSに差はないとしている3)。
最近,ボルテゾミブ(BOR)とMEL200との組み合わせも検討されているが,現時点ではMEL200が推奨される。
参考文献
1)Moreau P, et al. Comparison of 200mg/m2 melphalan and 8 Gy total body irradiation plus 140mg/m2 melphalan as conditioning regimens for peripheral blood stem cell transplantation in patients with newly di-agnosed multiple myeloma : Final analysis of the Intergroup Francophone du myelome 9502 randomized trial. Blood. 2002 ; 99 (3) : 731-5. (1iiDiv)
2)Fenk R, et al. High-dose idarubicin, cyclophosphamide and melphalan as conditioning for autologous stem cell transplantation increases treatment-related mortality in patients with multiple myeloma : Results of a randomized study. Br J Haematol. 2005 ; 130 (4) : 588-94. (1iiDiv)
3)Lahuerta JJ, et al. Busulfan 12mg/kg plus melphalan 140 mg/m2 versus melphalan 200mg/m2 as conditioning regimens for autologous transplantation in newly diagnosed multiple myeloma patients included in PETHEMA/GEM2000 study. Haematologica. 2010 ; 95 (11) : 1913-20. (3iiiA)
CQ5 若年者症候性骨髄腫患者に対して2回連続自家造血幹細胞移植(タンデム自家移植)を行うことは1回(シングル)移植と比べて生存期間を延長させるか
- 推奨グレード
- カテゴリー3(染色体高リスク症例では,カテゴリー2B)
導入療法に新規薬剤を使用しないタンデム自家移植は,初回移植で最良部分奏効に到達しない症例において無イベント生存でシングル移植より優れるが,治療関連死亡は増加する。新規薬剤が登場した現在時点でのタンデム自家移植の有用性は明らかではない。
解説
導入療法に新規薬剤を使用しない時代のシングル移植とタンデム移植を比較した5つの臨床試験が報告されているが,全生存期間(OS)でタンデム移植が優れていたのはIFM94試験のみである1-5)。一方,無イベント生存期間(EFS)は4つの試験でタンデム移植が優れていた。特に,初回移植で最良部分奏効(VGPR)(M蛋白の減少90%以下)(IFM94試験)1)あるいはnear CRに到達しなかった症例(Bologna96試験)2)でタンデム移植の有用性が明らかにされた。新規薬剤時代におけるタンデム移植の意義に関しては,BCDを用いた導入療法後にシングル移植とタンデム移植を比較する第Ⅲ相試験(EMN02/HO95)の中間解析が報告された6)。36カ月のPFSは64% vs 72.5%(HR:0.71,p=0.040)であり,ハイリスク染色体異常を有する患者では36カ月のPFSは69.2% vs 44.2%(HR:0.42,p=0.014)と有意にタンデム移植群で良好であった。一方,導入療法の薬剤(BLd:52~58%,BCD:13~16%)と治療回数が異なるStaMINA試験の中間報告では,シングル移植とタンデム移植との比較でPFS,OSとも有意差を認めなかった7)。
参考文献
1) Attal M, et al. Single versus double autologous stem-cell transplantation for multiple myeloma. N Engl J Med. 2003 ; 349 (26) : 2495-502. (1iiA)
2) Cavo M, et al. Prospective randomized study of single compared with double autologous stem-cell transplantation for multiple myeloma : Bologna 96 clinical study. J Clin Oncol. 2007 ; 25 (17) : 2434-41. (1iiDiv/1iiDi)
3) Segeren CM, et al. Overall and event-free survival are not improved by the use of myeloablative therapy following intensifi ed chemotherapy in previously untreated patients with multiple myeloma : A prospective randomized phase 3 study. Blood. 2003 ; 101 (6) : 2144-51. (1iiDi)
4) Goldschmidt H, et al. Single versus double high-dose therapy in multiple myeloma : second analysis of the GMMG-HD2 study. Hematology J. 2005 ; 90 : 38 PL8. 02. (1iiDiii)
5) Fermand JP, et al. Single versus double high dose therapy supported with autologous blood stem cell transplantation using unselected or CD34 enriched ABSC. Results of a two by two designed randomized trial in 230 young patients with multiple myeloma. Hematology J. 2003 ; 4 : S59. (1iiDiii)
6) Cavo M, et al. Double Autologous Stem Cell Transplantation Significantly Prolongs Progression-Free Survival and Overall Survival in Comparison with Single Autotransplantation in Newly Diagnosed Multiple Myeloma : An Analysis of Phase 3 EMN02/HO95 Study. Blood. 2017 ; 130 Abstract 401. (1iiDiii)
7) Stadtmauer EA, et al. Comparison of autologous hematopoietic cell transplant (autoHCT), bortezomib, lenalidomide (Len) and dexamethasone (RVD) consolidation with len maintenance (ACM), tandem autoHCT with len maintenance (TAM) and autoHCT with len maintenance (AM) for up-front treatment of patients with multiple myeloma (MM) : primary results from the randomized phase III trial of the Blood and Marrow Transplant Clinical Trials Network (BMT CTN 0702 - StaMINA Trial). Blood. 2016 ; 128 Abstract LBA-1. (1iiDiii)
CQ6 自家造血幹細胞移植における移植後の地固め・維持療法は生存期間を延長させるか
- 地固め療法 推奨グレード
- カテゴリー2B
- 維持療法 推奨グレード
- カテゴリー2A(レナリドミド)
カテゴリー2B(サリドマイド,ボルテゾミブ)
移植後骨髄腫に対する維持療法はサリドマイドによる無増悪生存期間,全生存期間の延長が期待できるが,長期投与による末梢神経障害の懸念がある。レナリドミドも無増悪生存期間,全生存期間を延長するが二次発がんの可能性が示唆されている。
移植後の地固め療法の生存期間の延長効果については,コンセンサスが得られていない。
解説
移植適応患者で,自家移植後に新規薬剤による地固め療法,維持療法を行うことで,完全奏効(CR)の獲得や,無増悪生存期間(PFS)の延長が期待できる。新規薬剤を併用する地固め療法に関して相反する2つのデータが2016年のASHで報告された。EMN02/HO95試験では,ASCT後に地固め療法としてBLd療法後にレナリドミドの維持療法を行った群と,ASCT後に地固め療法をしないでレナリドミドの維持療法を行った群を比較した結果,地固め療法を行った群でPFSの有意な延長とCR率の増加を認めた1)。導入療法の薬剤(BLd:52~58%,BCD:13~16%)と治療回数が異なるStaMINA試験の中間報告では,ASCT+地固め+維持療法群と,ASCT+維持療法群でPFS,OSとも有意差を認めなかった2)。
ASCT後のサリドマイド(THAL)による維持療法の第Ⅲ相試験が6つ報告されている3-8)。6つのすべての試験でPFSの延長が認められたが,OSの延長が認められたのは2つの試験のみであった。いずれの試験でもTHALの長期投与による副作用として末梢神経障害が中止理由の一つとなっており,必ずしも広く受け入れられる状況ではない。
一方,レナリドミド(LEN)維持療法については,IFM2005-02試験9),CALGB100104試験10),RV-MM-PI-209試験11)で検討され,すべての試験でPFSの延長が認められたが,OSの延長を認めたのはCALGB100104試験のみであった。一方で二次発がんが上昇するとの報告がある9, 10)。これらの3つの試験をメタ解析した結果,PFS,OSともLEN維持療法群で有意に延長したが,国際病期(ISS)Ⅲや染色体高リスク群ではOSの延長は得られていない12)。
ボルテゾミブについてはTHALとの比較が行われているが,各群で寛解導入療法が異なり維持療法としての評価は困難である13)。
参考文献
1)Sonneveld P, et al. Consolidation Followed By Maintenance Therapy Versus Maintenance Alone in Newly Diagnosed, Transplant Eligible Patients with Multiple Myeloma (MM) : A Randomized Phase 3 Study of the European Myeloma Network (EMN02/HO95 MM Trial). Blood. 2016 ; 128 (22) : 242. (1iiDiii)
2)Stadtmauer EA, et al. Comparison of autologous hematopoietic cell transplant (autoHCT), bortezomib, lenalidomide (Len) and dexamethasone (RVD) consolidation with len maintenance (ACM), tandem autoHCT with len maintenance (TAM) and autoHCT with len maintenance (AM) for up-front treatment of patients with multiple myeloma (MM) : primary results from the randomized phase III trial of the Blood and Marrow Transplant Clinical Trials Network (BMT CTN 0702 - StaMINA Trial). Blood. 2016 ; 128 Abstract LBA-1. (1iiDiii)
3)Attal M, et al. Maintenance therapy with thalidomide improves survival in patients with multiple myeloma. Blood. 2006 ; 108 (10) : 3289-94. (1iiDi/1iiA)
4)Morgan GJ, et al. The role of maintenance thalidomide therapy in multiple myeloma : MRC Myeloma IX results and meta-analysis. Blood. 2012 ; 119 (1) : 7-15. (1iiDiii)
5)Spencer A, et al. Consolidation therapy with low-dose thalidomide and prednisolone prolongs the survival of multiple myeloma patients undergoing a single autologous stem-cell transplantation procedure. J Clin Oncol. 2009 ; 27 (11) : 1788-93. (1iiA)
6)Barlogie B, et al. Thalidomide arm of Total Therapy 2 improves complete remission duration and survival in myeloma patients with metaphase cytogenetic abnormalities. Blood. 2008 ; 112 (8) : 3115-21. (1iiDi)
7)Lokhorst HM, et al. A randomized phase 3 study on the effect of thalidomide combined with adriamycin, dexamethasone, and high-dose melphalan, followed by thalidomide maintenance in patients with multiple myeloma. Blood. 2010 ; 115 (6) : 1113-20. (1iiDi/1iiDiii)
8)Stewart AK, et al. A randomized phase 3 trial of thalidomide and prednisone as maintenance therapy after ASCT in patients with MM with a quality-of-life assessment : the National Cancer Institute of Canada Clinicals Trials Group Myeloma 10 Trial. Blood. 2013 ; 121 (9) : 1517-23. (1iiA)
9)Attal M, et al. Lenalidomide maintenance after stem-cell transplantation for multiple myeloma. N Engl J Med. 2012 ; 366 (19) : 1782-91. (1iiDiii)
10)McCarthy PL, et al. Lenalidomide after stem-cell transplantation for multiple myeloma. N Engl J Med. 2012 ; 366 (19) : 1770-81. (1iiDiii/1iiA)
11)Palumbo A, et al. Autologous transplantation and maintenance therapy in multiple myeloma. N Engl J Med. 2014 ; 371 (10) : 895-905. (1iiDiii)
12)McCarthy PL, et al. Lenalidomide Maintenance After Autologous Stem-Cell Transplantation in Newly Diagnosed Multiple Myeloma : A Meta-Analysis. J Clin Oncol. 2017 ; 35 (29) : 3279-89. (1iiA)
13)Sonneveld P, et al. Bortezomib induction and maintenance treatment in patients with newly diagnosed multiple myeloma : Results of the randomized phase III HOVON-65/GMMG-HD4 trial. J Clin Oncol. 2012 ; 30 (24) : 2946-55. (1iiDiii/1iiA)
CQ7 若年者症候性骨髄腫患者に対するタンデム自家/同種(ミニ)移植はタンデム自家/自家移植と比べて生存期間を延長させるか
- 推奨グレード
- カテゴリー3
若年者症候性骨髄腫患者において,タンデム自家/同種(ミニ)移植はタンデム自家/自家移植と比べて優れているとの十分な根拠はなく研究的治療である。
解説
若年者骨髄腫において,タンデム自家/同種(ミニ)移植とタンデム自家/自家移植を比較した試験が5つ行われている1-6)。このうち,イタリアの試験2)とEuropean Group for Blood and Marrow Transplantation(EMBT)の試験4)でタンデム自家/同種(ミニ)移植の有用性が報告されているが,IFMの試験1)およびもっとも大規模な米国からの報告5, 6)では両群間で有意差がみられていない。対象や同種移植における前処置が試験により異なるが,タンデム自家/同種(ミニ)移植が無イベント生存期間(EFS),全生存期間(OS)ともに優れていたとするイタリアからの報告では同種移植前処置がTBI 2Gyとなっている2, 6)。しかし,同様の前処置で行われた米国からの大規模試験の報告では標準リスク,高リスク群いずれにおいてもタンデム自家/自家移植と同等の成績であった5)。EBMTからの報告では移植前処置はフルダラビン(FLU)+TBI 2Gyであり,自家移植群はシングルあるいはタンデムであったが,PFS,OSともにタンデム自家/同種(ミニ)移植が優れていた4)。一方,PTHEMA試験では自家移植後near CRに到達しなかった症例をHLA一致同胞の有無でランダム化しているが,同種移植群で高いCR率とPFSの延長がみられたもののOSには有意差がなかった3)。以上より,タンデム自家/同種(ミニ)移植がタンデム自家/自家移植よりOSにおいて優れているとは言えない。
参考文献
1) Garban F, et al. Prospective comparison of autologous stem cell transplantation followed by dose-reduced allograft (IFM99-03 trial) with tandem autologous stem cell transplantation (IFM99-04) in high-risk de novo multiple myeloma. Blood. 2006 ; 107 (9) : 3474-80. (2Div)
2) Bruno B, et al. A comparison of allografting with autografting for newly diagnosed myeloma. N Engl J Med. 2007 ; 356 (11) : 1110-20. (2A)
3) Rosiñol L, et al. A prospective PETHEMA study of tandem autologous transplantation versus autograft following by reduced-intensity conditioning allogeneic transplantation in newly diagnosed multiple myeloma. Blood. 2008 ; 112 (9) : 3591-3. (2Div)
4) Björkstrand B, et al. Tandem autologous/reduced-intensity conditioning allogeneic stem-cell transplantation versus autologous transplantation in myeloma : Long-term follow-up. J Clin Oncol. 2011 ; 29 (22) : 3016-22. (2Diii/2A)
5) Krishnan A, et al. Autologous haemopoietic stem-cell transplantation followed by allogeneic or autologous haemopietic stem-cell transplantation in patients with multiple myeloma (BMT CTN 0102) : a phase 3 biological assignment trial. Lancet Oncol. 2011 ; 12 (13) : 1195-203. (2A)
6) Giaccone L, et al. Long-term follow-up of a comparison of nonmyeloablative allografting with autografting for newly diagnosed myeloma. Blood. 2011 ; 117 (24) : 6721-7. (2A)
【移植非適応の初発多発性骨髄腫(症候性)】
CQ1 移植非適応の多発性骨髄腫(症候性)に対する推奨治療レジメンは何か
- 推奨グレード
- カテゴリー1
新規薬剤を用いたD-MPB療法(ダラツムマブ,メルファラン,プレドニゾロン,ボルテゾミブ)もしくは,D-Ld療法(ダラツムマブ,レナリドミド,少量デキサメタゾン)が推奨される。患者の状態に応じてMPB療法,MPT療法(メルファラン,プレドニゾロン,サリドマイド),Ld療法,BLd lite療法(ボルテゾミブ,レナリドミド,少量デキサメタゾン),Bd療法や従来のMP療法を選択してもよい。
解説
移植非適応の初発症候性骨髄腫患者に対する寛解導入療法は,従来MP療法(MEL,PSL)が標準療法であった。しかし,サリドマイド(THAL),ボルテゾミブ(BOR),レナリドミド(LEN),ダラツムマブ(DARA)などの新規薬剤が開発され,MP療法やデキサメタゾン(DEX)に併用する臨床研究が行われた。
BORに関しては,VISTA試験において,MPB療法(MP+BOR)がMP療法に比し,全奏効割合,PFS,およびOSが有意に良い成績であった1)。updateされた結果では,3年生存割合が68.5%と高く,また年齢,腎障害の有無に影響されず,高リスク群染色体[t(4;14),t(14;16),del(17p)]による予後を一部改善することが示された。
THALに関しては,6つのMPT療法(MP+THAL)とMP療法のランダム化比較試験が行われた(GIMEMA,IFM-Ⅰ試験,IFM-Ⅱ試験,NMSG,HOVON,TMSG)2-7)。MPT療法は,すべての試験で全奏効割合と無増悪生存期間(PFS)の優位性が示されたが,全生存期間(OS)の優位性が示された試験はIFMの2試験のみであった。しかし,メタアナリシスによるとOSにおける優位性が示された8)。ただし,わが国ではTHALの初発例に対する使用は保険適用外である。
LENに関しては,FIRST試験においてLd療法(LEN+少量DEX)とMPT療法の比較試験が行われ,Ld継続療法のMPT療法に対するPFSおよびOSにおける優位性が示された9)。しかし,CrCl<30mL/min,染色体高リスク,血清LDH高値のいずれかを有する患者におけるLd継続療法のMPT療法に対する優位性は示されなかった。
以上より,MPB療法とMPT療法は,MP療法に比しPFS,OSを有意に延長し推奨される。Ld療法は,MPT療法に比しOSを有意に延長し推奨される。ただしLd療法に関しては,18コース以上の継続投与はPFS延長に寄与するがOS延長に繋がるとのエビデンスは無く,無治療期間と継続による増悪遅延のどちらを優先するのか,そして毒性と費用を含む患者利益と不利益を考慮して継続期間を決定する。
BLd療法(BOR,LEN,DEX)をLd療法と比較したSWOG S0777試験では,BLd療法においてPFSおよびOSが有意に勝っていたが,Grade 3以上の有害事象(特に末梢神経障害や神経性疼痛)や治療中止例が多く高齢者への適応には注意を要する10)。そこで,減量した治療法BLd liteの試験が進められている。O’Donnellらは53例を対象とした第Ⅱ相試験で全奏効割合91.4%,PFS中央値35.1月,50%生存期間未達であり,有害事象も少なく高齢者には有用と報告しており11),今後選択肢の一つとなると考えられる。
さらにMPB療法とD-MPB療法(MPB+DARA)のランダム化第Ⅲ相試験が実施され, 18カ月PFS割合で71.6% vs 50.2%(HR=0.50,p<0.001)とDARA併用群のPFS延長効果が示された。CR割合も42.6% vs 24.4%(p<0.001)と優れていた。DARA併用群では輸注反応が27.7%に認められ,Grade 3以上の感染症の増加が示されている。観察期間が短くOS延長効果の有無は不明であるが,今後期待される治療法である12)。2019年8月に本邦でも保険適用となったため,移植非適応初発未治療患者に対する標準寛解導入療法の一つになった。
同様に,Ld療法とD-Ld療法(Ld+DARA)のランダム化第Ⅲ相試験が実施され,30カ月PFS割合で70.6% vs 55.6%(HR=0.56,p<0.001)とDARA併用群のPFS延長効果が示された13)。CR割合も47.6% vs 24.9%(p<0.001)と優れていた。Grade 3以上の有害事象としては,好中球減少が50.0% vs 35.3%とD-Ld群で高頻度に認められ,肺炎も13.7% vs 7.9%とD-Ld群で高頻度に認められた。
参考文献
1) San Miguel JF, et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. N Engl J Med. 2008 ; 359 (9) : 906-17. (1iiDiii/1iiA)
2) Palumbo A, et al. Oral melphalan and prednisone chemotherapy plus thalidomide compared with melphalan and prednisone alone in elderly patients with multiple myeloma : randomised controlled trial. Lancet. 2006 ; 367 (9513) : 825-31. (1iiDiii)
3) Facon T, et al. Melphalan and prednisone plus thalidomide versus melphalan and prednisone alone or reduced- intensity autologous stem cell transplantation in elderly patients with multiple myeloma (IFM 99- 06) : a randomized trial. Lancet. 2007 ; 370 (9594) : 1209-18. (1iiA)
4) Hulin C, et al. Efficacy of melphalan and prednisone plus thalidomide in patients older than 75 years with newly diagnosed multiple myeloma : IFM 01/01 trial. J Clin Oncol. 2009 ; 27 (22) : 3664-70. (1iA)
5) Waage A, et al. Melphalan and prednisone plus thalidomide or placebo in elderly patients with multiple myeloma. Blood. 2010 ; 116 (9) : 1405-12. (1iDiv)
6) Wijermans P, et al. Phase Ⅲ study of the value of thalidomide added to melphalan plus prednisone in elderly patients with newly diagnosed multiple myeloma : The HOVON 49 study. J Clin Oncol. 2010 ; 28 (19) : 3160-6. (1iiDiii)
7) Beksac M, et al. Addition of thalidomide to oral melphalan/prednisone in patients with multiple myeloma not eligible for transplantation : results of a randomized trial from the Turkish Myeloma Study Group. Eur J Haematol. 2011 ; 86 (1) : 16-22. (1iiDiv)
8) Fayers PM, et al. Thalidomide for previously untreated elderly patients with multiple myeloma : meta-analysis of 1685 individual patient data from 6 randomized clinical trials. Blood. 2011 ; 118 (5) : 1239-47.
9) Benboubker L, et al. Lenalidomide and dexamethasone in transplant-ineligible patients with myeloma. N Engl J Med. 2014 ; 371 (10) : 906-17. (1iiDiii)
10)Durie BG, et al. Bortezomib with lenalidomide and dexamethasone versus lenalidomide and dexamethasone alone in patients with newly diagnosed myeloma without intent for immediate autologous stem-cell transplant (SWOG S0777) : a randomised, open-label, phase 3 trial. Lancet. 2017 ; 389 (10068) : 519-27. (1iiDiii)
11)O’Donnell EK, et al. A phase 2 study of modified lenalidomide, bortezomib and dexamethasone in transplant-ineligible multiple myeloma. Br J Haematol. 2018 ; 182 (2) : 222-30. (3iiiDiv)
12)Mateos MV, et al. Daratumumab plus bortezomib, melphalan, and prednisone for untreated myeloma. N Engl J Med. 2018 ; 378 (6) : 518-28. (1iiDiii)
13)Facon T, et al. Daratumumab plus lenalidomide and dexamethasone for untreated myeloma. N Engl J Med. 2019 ; 380(22) : 2104-15. (1iiDiii)
CQ2 高齢骨髄腫患者にデキサメタゾンを投与する場合は少量投与法が推奨されるか
- 推奨グレード
- カテゴリー1
少量デキサメタゾン療法は,大量デキサメタゾン療法に比べて副作用が少なく,生存期間も延長させるので推奨される。
解説
初発症候性骨髄腫患者に対するデキサメタゾン(DEX)投与量の比較は,レナリドミド(LEN)に大量DEX療法と少量療法を併用したECOG E4A03試験で行われた。LENは25mgを21日間経口投与し,1週間休薬した。大量DEX療法では,従来通り40mgを第1~4日,第9~12日,第17~20日に投与し,少量療法では,40mgを第1,8,15,22日に投与した。そこで,1カ月のDEX総投与量は1/3となる。1年の中間解析時点で,少量療法の生存割合は96%で,大量療法群の87%に比して有意に良好であった。特に,65歳以上の高齢者では,少量療法の94%は,大量療法の83%に比し有意に良好であった。これは,大量療法群では感染症を中心とした有害事象による死亡が多かったことによる1)。また,移植非適応例に対するMP療法(MEL,PSL)とTD療法(THAL,DEX)のランダム化比較試験の結果が報告されている。MP療法では,MEL 0.25mg/kg,PSL 2mg/kgの4日間投与を28~42日サイクルで投与した。TD療法では,THAL 200mg連日,DEX 40mgの第1~4日,15~18日投与を28日サイクルで投与した。TD療法の全奏効割合は,MP療法に比し有意に高かったが(68% vs 50%),無増悪生存期間(PFS)は同等で,全生存期間(OS)は有意に短かった(41.5カ月 vs 49.4カ月)。これは有害事象がTD群で有意に多く,特に75歳以上の高齢者で発現頻度が高かったためである2)。以上より,高齢多発性骨髄腫患者には少量DEX療法が推奨される。
Palumboらは年齢による各種抗骨髄腫治療薬の減量規準を提案しており3),この中にデキサメタゾンの減量案も提示されている。しかし,これはエビデンスに基づいた規準ではなく,経験的なものであり慎重に用いるべきである。
参考文献
1) Rajkumar SV, et al. Lenalidomide plus high-dose dexamethasone versus lenalidomide plus low-dose dexamethasone as initial therapy for newly diagnosed multiple myeloma : an open-label randomized controlled trial. Lancet Oncol. 2010 ; 11 (1) : 29-37. (1iiDiv/1iiA)
2) Ludwig H, et al. Thalidomide-dexamethasone compared with melphalan-prednisolone in elderly patients with multiple myeloma. Blood. 2009 ; 113 (15) : 3435-42. (1iiDiii/1iiA)
3) Palumbo A, et al. Multiple myeloma. N Engl J Med. 2011 ; 364 (11) : 1046-60.
【再発・難治性骨髄腫】
CQ1 再発・難治性骨髄腫患者に対する新規薬剤療法は大量デキサメタゾン療法に比べて生存期間を延長させるか
- 推奨グレード
- カテゴリー1
再発・難治性骨髄腫患者に対する新規薬剤療法は,大量デキサメタゾン療法と比較し,無増悪生存期間や生存期間を延長させるので推奨される。
解説
再発・難治性多発性骨髄腫の治療においては,プロテアソーム阻害薬や免疫調節薬などの新規薬剤が導入され,治療成績の向上が報告されている。これまでに大量デキサメタゾン(DEX)療法との第Ⅲ相比較試験としては,ボルテゾミブ(BOR)単剤療法,レナリドミド(LEN)+大量DEX併用療法,ポマリドミド(POM)+ 少量DEX併用療法が行われており,それぞれの有用性が示された。
BOR療法と大量DEX療法とを比較したAPEX試験では,部分奏効(PR)以上の全奏効割合(38% vs 18%,p<0.001),無増悪生存期間(PFS)の中央値(6.22カ月 vs 3.49カ月,p<0.001),1年生存割合(80% vs 66%,p=0.003)においてBOR群が有意に優れていた1)。その後の追跡調査においては,BOR群の全奏効割合が43%に上昇していることが明らかにされ,生存期間の中央値(29.8カ月 vs 23.7カ月,p=0.027),1年生存割合(80% vs 67%,p=0.001)において大量DEX群よりも有意に優れていることが確認された2)。
LENについてはLEN+大量DEX併用療法とプラセボ+大量DEX療法との比較がなされた(MM-009試験,MM-010試験)。2つの試験の成績はほぼ同等で,全奏効割合やPFS,全生存期間(OS)においてLEN+大量DEX併用療法が有意に優れていた3, 4)。その後の追跡調査の結果においても,LEN群は全奏効割合(60.6% vs 21.9%,p<0.001),完全奏効割合(15.0% vs 2.0%,p<0.001),PFS(中央値13.4カ月 vs 4.6カ月,p<0.001),奏効期間(中央値15.8カ月 vs 7.0カ月,p<0.001),OS(中央値38.0カ月 vs 31.6カ月,p=0.045)において有意に優れていた5)。
POMについてはBORやLENを含む2レジメン以上の治療歴を有する治療抵抗性骨髄腫を対象とし,POM+ 少量DEX併用療法と大量DEX療法との比較試験が行われた(MM-003試験)6)。POM+ 少量DEX併用療法は,PR以上の全奏効割合(31% vs 10%,p<0.0001),PFS(中央値4.0カ月 vs 1.9カ月,p<0.0001),OS(中央値12.7カ月 vs 8.1カ月,p=0.0285)において大量DEX療法よりも有意に優れていた。
以上より,再発・難治性骨髄腫に対するBOR(+DEX)療法,LEN+DEX療法,POM+DEX療法は推奨される。
参考文献
1) Richardson PG, et al. Bortezomib or high-dose dexamethasone for relapsed multiple myeloma. N Engl J Med. 2005 ; 352 (24) : 2487-98. (1iiA)
2) Richardson PG, et al. Extended follow-up of a phase 3 trial in relapsed multiple myeloma : final time-to-event results of the APEX trial. Blood. 2007 ; 110 (10) : 3557-60. (1iiA)
3) Weber DM, et al. Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America. N Engl J Med. 2007 ; 357 (21) : 2133-42. (1iA)
4) Dimopoulos M, et al. Lenalidomide plus dexamethasone for relapsed or refractory multiple myeloma. N Engl J Med. 2007 ; 357 (21) : 2123-32. (1iA)
5) Dimopoulos MA, et al. Long-term follow-up on overall survival from the MM-009 and MM-010 phase III trials of lenalidomide plus dexamethasone in patients with relapsed or refractory multiple myeloma. Leukemia. 2009 ; 23 (11) : 2147-52. (1iA)
6) San Miguel J, et al. Pomalidomide plus low-dose dexamethasone versus high-dose dexamethasone alone for patients with relapsed and refractory multiple myeloma (MM-003) : a randomised, open-label, phase 3 trial. Lancet Oncol. 2013 ; 14 (11) : 1055-66. (1iiA)
CQ2 再発・難治性骨髄腫患者に対する新規薬剤を含む併用療法は新規薬剤の単剤療法に比べて高い効果が期待できるか(プロテアソーム阻害薬と免疫調節薬の併用および抗体療法を除く)
- 推奨グレード
- カテゴリー2A
再発・難治例に対する新規薬剤を含む併用療法は,新規薬剤の単剤療法と比較し,より高い奏効割合をもたらすが,毒性の増強が認められることなどに留意すべきであろう。生存期間の延長効果については今後の検討を待つ必要がある。
解説
再発・難治例に対する新規薬剤として,ボルテゾミブ(BOR)やレナリドミド(LEN)が多く使用されている。これらの薬剤は単剤療法としてではなく,主にデキサメタゾン(DEX)との併用療法として用いられてきたが,欧米ではシクロホスファミド(CPA)やpegylated liposomal doxorubicin(PLD),ヒストン脱アセチル化酵素阻害薬であるパノビノスタット(PAN)などとの併用療法も試みられており,より高い奏効割合が報告されている。
BORにおいてはBOR+PLD併用療法とBOR単剤との第Ⅲ相比較試験が行われ,BOR+PLD群における無増悪期間(TTP)の有意な延長(中央値で9.3カ月 vs 6.5カ月,p=0.000004)と全生存期間(OS)の延長(15カ月の生存割合で76% vs 65%,p=0.03)が認められたが,同時にGrade 3以上の有害事象の増加(80% vs 64%)も示された1)。なお,本邦では骨髄腫に対するPLDの保険適用はない。BOR+CPA+DEX併用療法では,CPA 50mg/day(連日)の併用における全奏効割合(CR+PR+MR)は90%で,OSの中央値は22カ月と良好な成績であった2)。CPA 500mg/day(days 1,8,15)の併用療法の後方視的解析では,全奏効割合(CR+PR)は75%に達し,BOR単剤の27%,BOR+DEXの47%に対し優れていた3)。BOR+DEX療法とPANとの併用効果の検討では,BOR+DEX+PAN療法とBOR+DEX+ プラセボ療法との第Ⅲ相比較試験が行われた(PANORAMA 1)4)。CRおよびnear CRの奏効割合はPAN群の方が有意に優れていたが(27.6% vs 15.7%,p=0.00006),PR以上の全奏効割合では有意差はなかった(60.7% vs 54.6%,p=0.09)。無増悪生存期間(PFS)はPAN群において有意な延長を認めたが(中央値11.99カ月 vs 8.08カ月,p<0.0001),OSは有意差を認めず(中央値33.64カ月 vs 30.39カ月,p=0.26),追跡調査の最終報告でもOSにおける有意差はなかった(中央値40.3カ月 vs 35.8カ月,p=0.54)5)。Grade 3以上の有害事象はPAN群に多い傾向であった(血小板減少67% vs 31%,下痢26% vs 8%)。
LENについてはLEN+ドキソルビシン(DXR)+DEX療法の第Ⅰ/Ⅱ相試験が行われ,全奏効割合は73%と優れていた6)。また,LEN+CPA(600mgをday 1,8に投与)+DEXの併用療法の第Ⅰ/Ⅱ相試験が行われ,全奏効割合は81%で30カ月の全生存割合は80%であった7)。
以上より,再発・難治性骨髄腫に対するBOR+CPM+DEX療法やBOR+PAN+DEX療法は選択肢となるが,併用による毒性の増強を認める一方でOSにおける延長効果は未確定であることから,現時点ではリスクとベネフィットを考慮し選択すべきである。
参考文献
1) Orlowski RZ, et al. Randomized phase III study of pegylated liposomal doxorubicin plus bortezomib compared with bortezomib alone in relapsed or refractory multiple myeloma : combination therapy improves time to progression. J Clin Oncol. 2007 ; 25 (25) : 3892-901. (1iiA)
2) Kropff M, et al. Bortezomib in combination with intermediate-dose dexamethasone and continuous low-dose oral cyclophosphamide for relapsed multiple myeloma. Br J Haematol. 2007 ; 138 (3) : 330-7. (3iiiDiii)
3) Davies FE, et al. The combination of cyclophosphamide, velcade and dexamethasone induces high response rates with comparable toxicity to velcade alone and velcade plus dexamethasone. Haematologica. 2007 ; 92 (8) : 1149-50. (3iiiDiv)
4) San Miguel JF, et al. Panobinostat plus bortezomib and dexamethasone versus placebo plus bortezomib and dexamethasone in patients with relapsed or relapsed and refractory multiple myeloma : a multicentre, randomised, double-blind phase 3 trial. Lancet Oncol. 2014 ; 15 (11) : 1195-206. (1iDiii)
5) San Miguel JF, et al. Overall survival of patients with relapsed multiple myeloma treated with panobinostat or placebo plus bortezomib and dexamethasone (the PANORAMA 1 trial) : a randomized, placebo-controlled, phase 3 trial. Lancet Haematol. 2016 ; 3 (11) : e506-15. (1iDiii)
6) Knop S, et al. Lenalidomide, adriamycin, and dexamethasone (RAD) in patients with relapsed and refractory multiple myeloma : a report from the German Myeloma Study Group DSMM (Deutsche Studiengruppe Multiples Myelom). Blood. 2009 ; 113 (18) : 4137-43. (3iiiDiv)
7) Schey SA, et al. The addition of cyclophosphamide to lenalidomide and dexamethasone in multiply relapsed/refractory myeloma patients ; a phase I/II study. Br J Haematol. 2010 ; 150 (3) : 326-33. (3iiiDiv)
CQ3 再発・難治性骨髄腫患者に対する新規薬剤併用療法の推奨レジメンは何か
- 推奨グレード
- カテゴリー1
再発・難治性骨髄腫患者に対しては,新規プロテアソーム阻害薬とデキサメタゾンの併用療法,または,それに免疫調節薬(IMiDs)を加えた3剤療法が推奨される。
解説
再発難治例に対するプロテアソーム阻害薬としてカルフィルゾミブ(CFZ)[デキサメタゾン(DEX)またはレナリドミド(LEN)およびDEXとの併用]とイキサゾミブ(IXA)[LENおよびDEXとの併用],免疫調節薬としてサリドマイド(THAL)とポマリドミド(POM)が保険適用されている(抗体薬については別項参照)。プロテアソーム阻害薬,免疫調節薬,DEXの3剤を併用する治療はtripletと呼ばれ,前2者のうち1者を省く治療はdoubletと呼ばれる。
1)Doubletについて
再発難治例を対象としBOR+DEX療法とCFZ(20/56)+DEX療法を直接比較したENDEAVOR試験では,無増悪生存期間(PFS)中央値においてCFZ+DEX群は18.7カ月,BOR+DEX群は9.4カ月であり,CFZ+DEX群が有意に上回った(p<0.0001)1)。その後の追跡調査では,CFZ+DEX群の全生存期間(OS)における優位性も示された(中央値47.6カ月 vs 40.0カ月,p=0.010)2)。BOR投与歴を有する症例は両群ともに54%であり,サブ解析ではBOR投与歴の有無に関わらず,CFZ+DEX群のOS延長効果における優位性が示された。血液学的毒性を除くGrade 3以上の有害事象として,CFZ+DEX群では血圧上昇(15%)と呼吸困難(6%)が多く,BOR+DEX群では下痢(9%)と末梢神経障害(6%)が多い傾向であった。サブ解析において高リスク染色体異常を有する例の全奏効割合(ORR)は,CFZ+DEX群は72.2%,BOR+DEX群は58.4%,PFS中央値はそれぞれ8.8カ月と6.0カ月であり,高リスク群においてもCFZ+DEX群の優位性が示された。以上より,BOR投与後の再発例や高リスクの再発例に対し,CFZ+DEX療法は推奨される。その後,前治療歴が2~3回で直近の治療に難治性であった再発難治患者を対象に,週2回投与のCFZ(20/27)+DEX療法と週1回で高用量投与のCFZ(20/70)weekly+DEX療法を比較したARROW試験が実施された3)。46.3%がBOR抵抗性,77.5%がLEN抵抗性の患者に対してCFZ(20/70)weekly+DEX療法は,PFS中央値において11.2カ月と,同様の患者群を対象としたCFZ(20/27)+DEX療法によるPFS中央値7.6カ月に比して有意に延長効果を示した(p<0.0029)。
2)Tripletについて
再発難治症例を対象としCFZ+LEN+DEXの3剤療法とLEN+DEX併用療法を比較した第Ⅲ相試験(ASPIRE試験)では,PFS中央値は26.3カ月 vs 17.6カ月とCFZ+LEN+DEX療法が有意に上回った(p=0.0001)4)。24カ月時点での全生存割合も73.3%と65.0%であり,tripletであるCFZ+LEN+DEX療法の優位性が示された(p=0.004)。Grade 3以上の有害事象の割合は同等であったが(83.7% vs 80.7%),CFZ群において高血圧(4.3% vs 1.8%)と心不全(3.8% vs 1.8%)が多い傾向であった。以上より,再発難治例に対するCFZ+LEN+DEX療法は推奨される。
TOURMALINE-MM1と呼ばれる第Ⅲ相二重盲検比較試験においてIXA+LEN+DEXの併用療法がプラセボ +LEN+DEXと比較された。PFS中央値は20.6カ月 vs 14.7カ月(p=0.01),VGPR以上の奏効割合は48% vs 39%(p=0.01)とIXA群における優位性が認められた5)。前治療に関するサブ解析では,前治療の内容にかかわらず,IXA群においてPFSの延長が認められた6)。本解析ではBOR不応性の有無は解析されていないことやLENとの併用療法であることからIXAとBORの直接比較はできないが,BOR投与がIXAの感受性に影響する可能性が示唆された。Grade 3以上の有害事象として血小板減少(19% vs 9%),下痢(6% vs 3%),皮疹(5% vs 2%)はIXA群に多い傾向であったが,末梢神経障害は2% vs 2%と同等であった5)。以上より,再発難治例に対するIXA+LEN+DEX療法は推奨される。
再発難治性の移植非適応の65歳以上を対象としたTHAL+DEX療法とBOR+THAL+DEX療法との第Ⅲ相比較試験(MMVAR/IFM 2005-04)では,time to progressionの中央値はBOR+THAL+DEX群は19.5カ月,THAL+DEX群は13.8カ月であった(p=0.01)7)。奏効期間も17.9カ月 vs 13.4カ月とBOR+THAL+DEX群が優っていたが(p=0.04),OSに有意差はなかった(p=0.093)。一方,Grade 3以上の末梢神経障害はBOR+THAL+DEX群に有意に多かった(29% vs 12%,p=0.001)。
上記の3つの臨床試験(ASPIRE4),TOURMALINE-MM15)),MMVAR/IFM7))のメタアナリシスによるdoubletとtripletの比較では,ORR,PFSはすべての試験でtripletが優っていた8)。しかしながら,Grade 3以上の感染症,血小板減少はtripletにおいて有意に多いことが示された。Tripletはdoubletに比べ優れた奏効割合とPFS延長効果を有することが明らかであるが,OS延長効果が証明された報告はまだ少なく,一方,有害事象はdoubletに比べて確実に増加することから,特に前治療歴が多い再発難治例においてtripletは慎重に選択する必要がある。
LEN治療歴を有する再発難治性骨髄腫を対象としたPOM+BOR+DEX療法とBOR+DEX療法との第Ⅲ相比較試験(OPTIMISMM)では,VGPR以上の奏効割合は52.7% vs 18.3%(p<0.0001),PFS中央値は11.2カ月 vs 7.1カ月(p<0.0001)と,POM+BOR+DEX群が優れていた9)。Grade 3以上の好中球減少は42% vs 9%とPOM+BOR+DEX群に多い傾向であったが,重篤な有害事象は57% vs 42%とほぼ同程度であり,LEN治療歴を有する再発難治例に対するPOM+BOR+DEX療法は推奨される。
参考文献
1) Dimopoulos MA, et al. Carfilzomib and dexamethasone versus bortezomib and dexamethasone for patients with relapsed or refractory multiple myeloma (ENDEAVOR) : a randomised, phase 3, open-label, multicentre study. Lancet Oncol. 2016 ; 17 (1) : 27-38. (1iiDiii)
2) Dimopoulos MA, et al. Carfilzomib or bortezomib in relapsed or refractory multiple myeloma (ENDEAVOR) : an interim overall survival analysis of an open-label, randomised, phase 3 trial. Lancet Oncol. 2017 ; 18 (10) : 1327-37. (1iiDiii)
3) Moreau P, et al. Once weekly versus twice weekly carfilzomib dosing in patients with relapsed and refractory multiple myeloma (A.R.R.O.W.) : interim analysis results of a randomised, phase 3 study. Lancet Oncol. 2018 ; 19 (7) : 953-64. (1iiDiii)
4) Stewart AK, et al. Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med. 2015 ; 372 (2) : 142-52. (1iiDiii)
5) Moreau P, et al. Oral Ixazomib, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med. 2016 ; 374 (17) : 1621-34. (1iDiii)
6) Mateos MV, et al. Impact of prior therapy on the efficacy and safety of oral ixazomib-lenalidomide-dexamethasone vs. placebo-lenalidomide-dexamethasone in patients with relapsed/refractory multiple myeloma in TOURMALINE-MM1. Haematologica. 2017 ; 102 (10) : 1767-75. (1iDiii)
7) Garderet L, et al. Superiority of the triple combination of bortezomib-thalidomide-dexamethasone over the dual combination of thalidomide-dexamethasone in patients with multiple myeloma progressing or relapsing after autologous transplantation : the MMVAR/IFM 2005-04 Randomized Phase III Trial from the Chronic Leukemia Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol. 2012 ; 30 (20) : 2475-82. (1iiDiii)
8) Sun Z, et al. Triplet versus doublet combination regimens for the treatment of relapsed or refractory multiple myeloma : A meta-analysis of phase III randomized controlled trials. Crit Rev Oncol Hematol. 2017 ; 113 : 249-55.
9) Richardson PG, et al. Pomalidomide, bortezomib, and dexamethasone for patients with relapsed or refractory multiple myeloma previously treated with lenalidomide (OPTIMISMM) : a randomised, open-label, phase 3 trial. Lancet Oncol. 2019 ; 20 (6) : 781-94. (1iiDiii)
CQ4 再発・難治性骨髄腫の治療に抗体療法は勧められるか
- 推奨グレード
- カテゴリー1
再発・難治性骨髄腫に対するエロツズマブ+レナリドミド+デキサメタゾン併用療法,ダラツムマブ+レナリドミド+デキサメタゾン併用療法,ダラツムマブ+ボルテゾミブ+デキサメタゾン療法,エロツズマブ+ポマリドミド+デキサメタゾン併用療法は,それぞれ2剤療法と比較し無増悪生存期間を延長させるので推奨される。
解説
多発性骨髄腫に対する抗体医薬としては,骨髄腫細胞に高発現しているsignaling lymphocytic activation molecule family member 7(SLAMF7)[別名CD2 subset 1(CS-1)]を認識するエロツズマブ(ELO)やCD38を認識するダラツムマブ(DARA)がある。
ELOの第Ⅰ相試験では20mg/kgまでの漸増試験が行われ,重篤な有害事象は認めなかったものの,有効性としては26.5%に不変(SD)が認められたのみであり,単剤での抗腫瘍効果は乏しいと考えられた1)。ELO(10mg/kg)+レナリドミド(LEN)+デキサメタゾン(DEX)療法とLEN+DEX療法との第Ⅲ相比較試験(ELOQUENT-2)では,PR以上の全奏効割合は79%対66%(p<0.001),無増悪生存期間(PFS)の中央値は19.4カ月 vs 14.9カ月(p<0.001)とELO群における優位性が認められた2)。Grade 3以上の主な有害事象はリンパ球減少,貧血,血小板減少,好中球減少であった。ELOによるinfusion reactionは10%に認められたが,大部分はGrade 1,2であった。その後の追跡調査では,全生存期間(OS)の中央値は43.7カ月 vs 39.6カ月とELO群における有意な延長効果が示された(p=0.0257)3)。また,ELO(10mg/kg)+ ボルテゾミブ(BOR)+DEX療法とBOR+DEX療法との第Ⅱ相比較試験では,PR以上の奏効割合はコントロール群63%に対しELO群66%であった4)。PFSの中央値はコントロール群6.9カ月に対しELO群9.7カ月と延長を認めたが有意差はなかった(p=0.09)。ELOの併用による有害事象の有意な増加はなく,infusion reactionの頻度は5%と低値であった。以上より,再発難治性に対するELO+LEN+DEX療法は推奨される。
DARAの第Ⅰ/Ⅱ相試験では単独療法の漸増試験が行われ,8mg/kgと16mg/kgにおけるPR以上の奏効割合はそれぞれ10%と36%[完全奏効(CR)5%,非常によい部分奏効(VGPR)5%を含む]であった5)。16mg/kg群におけるPFSの中央値は5.6カ月であり,奏効例の65%は1年の時点で進行を認めなかった。Grade 3以上の主な有害事象は肺炎と血小板減少であった。Infusion reactionはそれぞれ67%と71%と高頻度であったが,大部分はGrade 1,2で初回投与時に認められた。DARAの第Ⅲ相試験では16mg/kgが用いられ,LEN+DEX療法やBOR+DEX療法との併用療法が検討された。DARA+LEN+DEX療法とLEN+DEX療法との比較試験(POLLUX)では,1年後のPFSはコントロール群60.1%に対しDARA群83.2%と有意に優れていた(p<0.001)6)。PR以上の奏効割合は76.4% vs 92.9%,CR以上の奏効割合は19.2% vs 43.2%とDARA群における深い奏効が認められた(いずれもp<0.001)。Grade 3以上の主な有害事象は好中球減少37.0% vs 51.9%,血小板減少13.5% vs 12.7%,貧血19.6% vs 12.4%であった。DARAによるinfusion reactionは47.7%に認められたが,大部分はGrade 1,2であった。DARA+BOR+DEX療法とBOR+DEX療法との比較試験(CASTOR)では,1年後のPFSはコントロール群26.9%に対しDARA群60.7%と有意な効果を示した(p<0.001)7)。PR以上の奏効割合は63.2% vs 82.9%(p<0.001),CR以上の奏効割合は9.0% vs 19.2%(p=0.001)とDARA群における優位性が示された。Grade 3以上の主な有害事象は血小板減少32.9% vs 45.3%,貧血16.0% vs 14.4%,好中球減少4.2% vs 12.8%であった。DARAによるinfusion reactionは45.3%にみられたが,Grade 3は8.6%であった。以上より,再発難治例に対するDARA+LEN+DEX療法とDARA+BOR+DEX療法は推奨される。
また,レナリドミドおよびプロテアソーム阻害薬による前治療歴を有する再発または難治性の多発性骨髄腫117例に対するELO+POM+DEX療法とPOM+DEX療法を比較するランダム化第Ⅱ相試験が実施され,PFSの中央値は10.3カ月 vs 4.7カ月(p=0.008)とELO併用群における優位性が認められた8)。全奏効率も53%と26%で,同様にELO併用群で高かった。ELO併用群での主なGrade 3以上の有害事象としては,好中球減少13%,貧血0%,高血糖8%などが認められたが,POM+DEX群と比較して高頻度ではなかった。しかし,両群で65%の患者に感染症合併を認め,ELO併用群の5%でinfusion reactionを認めた。
参考文献
1) Zonder JA, et al. A phase 1, multicenter, open-label, dose escalation study of elotuzumab in patients with advanced multiple myeloma. Blood. 2012 ; 120 (3) : 552-9. (3iiiDiv)
2) Lonial S, et al. Elotuzumab therapy for relapsed or refractory multiple myeloma. N Engl J Med. 2015 ; 373 (7) : 621-31. (1iiDiii)
3) Dimoloulos MA, et al. Elotuzumab plus lenalidomide/dexamethasone for relapsed or refractory multiple myeloma : ELOQUENT-2 follow-up and post-hoc analysis on progression-free survival and tumor growth. Be J Haematol. 2017 ; 178 (6) : 896-905. (1iiDiii)
4) Jakubowiak A, et al. Randomized phase 2 study of elotuzumab plus bortezomib/dexamethasone (Bd) versus Bd for relapsed/refractory multiple myeloma. Blood. 2016 ; 127 (23) : 2833-40. (1iiDiii)
5) Lokhorst HM, et al. Targeting CD38 with daratumumab monotherapy in multiple myeloma. N Engl J Med. 2015 ; 373 (13) : 1207-19. (3iiiDiv)
6) Dimopoulos MA, et al. Daratumumab, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med. 2016 ; 375 (14) : 1319-31. (1iiDiii)
7) Palumbo A, et al. Daratumumab, bortezomib, and dexamethasone for multiple myeloma. N Engl J Med. 2016 ; 375 (8) : 754-66. (1iiDiii)
8) Dimopoulos MA, et al. Elotuzumab plus pomalidomide and dexamethasone for multiple myeloma. N Engl J Med. 2018 ; 379 (19) : 1811-22. (1iiDiii, ただしランダム化第Ⅱ相)
CQ5 再発・難治性骨髄腫患者に対する自家造血幹細胞移植や同種造血幹細胞移植は生存期間を延長させるか
- 推奨グレード
- カテゴリー2B
再発・難治性骨髄腫患者に対する自家造血幹細胞移植は適切な患者選択を行うことで生存期間の延長が期待できる。
- 推奨グレード
- カテゴリー3
同種造血幹細胞移植においては無増悪生存期間の延長が認められるが,生存期間の延長は明らかでない。
解説
難治例に対する自家造血幹細胞移植については,初回化学療法に感受性を有する例と化学療法抵抗例との成績が比較検討されたが,1年無増悪生存割合(PFS)は化学療法感受性群が83%,治療抵抗群が70%と有意差を認めなかった(p=0.65)1)。また,全生存期間(OS)においても有意差を認めなかったことから,化学療法抵抗例に対する自家移植は有効な治療法として推奨される。また,初回自家移植後再発例に対する2回目の自家移植は,再発後化学療法のみの群との比較において,4年生存割合は32% vs 22%と自家移植群が有意に優れていた(p<0.0001)2)。さらに,この検討では年齢55歳未満,初診時β2ミクログロブリン2.5mg/L未満,初回移植後の奏効期間が9カ月以上,初回移植後の深い奏効例において,2回目の自家移植による無増悪期間(TTP)やOSの延長効果が認められた。また,自家移植後再発例を対象とし,ボルテゾミブ+ドキソルビシン+デキサメタゾン(PAD)による再寛解導入療法後に自家移植と経口シクロホスファミド療法(CPA)との第Ⅲ相比較試験では,TTPの中央値は19カ月 vs 11カ月と自家移植群が有意に優れていたが(p<0.0001),OSにおける有意差はなかった3)。ただし,染色体高リスク群を有する患者においては自家移植の優越性は示されなかった。以上より,自家移植後再発例のうち染色体標準リスク群における2回目の自家移植は推奨される。
一方,同種移植においては治療関連死亡(TRM)が問題であったが,近年,移植前処置を骨髄非破壊的にすることでTRMは減少してきている。自家移植後の再発169例において移植ドナーの有無によりその後の経過を比較した報告では,ドナーを有した75例中68例が骨髄非破壊的同種移植を施行し,2年PFSではドナーを有した群が42%,ドナーを有さなかった群が18%で,同種移植群が有意に優れていた(p<0.0001)4)。しかしながら,2年生存割合ではドナーを有した群が54%に対し,ドナーを有さなかった群が53%と有意差はなかった(p=0.329)。自家移植後再発例における骨髄非破壊的同種移植のHLA適合度による比較では,1年後の非再発死亡率はHLA適合群では10%であったが,HLA非適合群では53%にも達した(p=0.001)5)。このように,同種移植についてはTTPの延長効果が示されたものの長期的な生存期間の延長効果は明らかでないことから,一般的には推奨されず,臨床試験として実施すべきである。
参考文献
1) Kumar S, et al. High-dose therapy and autologous stem cell transplantation for multiple myeloma poorly responsive to initial therapy. Bone Marrow Transplant. 2004 ; 34 (2) : 161-7. (3iiiDiii)
2) Cook G, et al. Factors influencing the outcome of a second autologous stem cell transplant (ASCT) in relapsed multiple myeloma : a study from the British Society of Blood and Marrow Transplantation Registry. Biol Blood Marrow Transplant. 2011 ; 17 (11) : 1638-45. (3iiiA)
3) Cook G, et al. High-dose chemotherapy plus autologous stem-cell transplantation as consolidation therapy in patients with relapsed multiple myeloma after previous autologous stem-cell transplantation (NCRI Myeloma X Relapse[Intensive trial]) : a randomised, open-label, phase 3 trial. Lancet Oncol. 2014 ; 15 (8) : 874-85. (1iiA)
4) Patriarca F, et al. Allogeneic stem cell transplantation in multiple myeloma relapsed after autograft : a multicenter retrospective study based on donor availability. Biol Blood Marrow Transplant. 2012 ; 18 (4) : 617-26. (3iiiDiii)
5) Kröger N, et al. Unrelated stem cell transplantation after reduced intensity conditioning for patients with multiple myeloma relapsing after autologous transplantation. Br J Haematol. 2010 ; 148 (2) : 323-31. (3iiiDiii)
【骨髄腫の合併症と治療関連毒性に対する支持療法】
CQ1 骨病変を有する患者に対して骨関連事象を減少させるための推奨治療は何か
- 推奨グレード
- カテゴリー1
骨病変を有する初発骨髄腫患者に対し治療開始時からのデノスマブあるいはゾレドロン酸の投与が推奨される。全生存割合への影響には両者の間で差はないが,デノスマブはゾレドロン酸に比べ無進行生存期間を延長させた。デノスマブは腎毒性が低いため,腎障害例ではデノスマブの投与がより推奨される。
解説
D/S第Ⅲ臨床病期で骨融解病変を有する患者に対する大規模臨床試験により,骨病変を有する進行期骨髄腫患者に対し,化学療法に加え,3~4週ごとのゾレドロン酸4mgの15分間点滴静注の2年以内の反復投与の有用性が示された1, 2)。次いで,新規発症骨髄腫1,960例を自家移植群と非移植群に分け,さらにそれぞれの群を骨病変の有無にかかわらず初期治療時よりゾレドロン酸4mgの3~4週ごとの投与またはクロドロネートの連日経口1,600mg群に割り付けたMRC Myeloma Ⅸ試験が行われた3)。中央値3.7年の観察で,ゾレドロン酸投与群(n=981)ではクロドロネート投与群(n=979)より有意に骨関連事象の発生が少なく,全生存期間が5.5カ月延長した。さらに2年を超え長期間試験が継続された症例(582例)を抽出し検討したところ,ゾレドロン酸群はクロドロネート群に対して有意に全生存期間が上回り(HR 0.60,p=0.0201),骨関連事象の発生も有意に抑制し(p=0.0102),初回増悪からの生存期間も延長していた(34 vs 27カ月,HR 0.58,p=0.0291)4)。顎骨壊死(ONJ)の発生は,ゾレドロン酸群290例中12例(4.1%)にみられた。
デノスマブは破骨細胞分化因子(receptor activator of nuclear factor-κB ligand:RANKL)に対する完全ヒト化モノクローナル抗体である。デノスマブの120mg皮下注とゾレドロン酸の4mg点滴静注の4週ごと投与の,ビスホスホネート製剤の治療歴のない溶骨性病変を有する骨髄腫患者に対する骨関連事象の発現抑制効果は同等であった5)。この試験では骨髄腫患者数が少ないだけでなく,前治療の内容にも偏りがあったため,この2剤の治療効果や予後に及ぼす影響を正当に検証するために,骨病変を有する初発骨髄腫患者に対し新規薬や自家移植などの治療内容を均等化した国際共同大規模第Ⅲ相臨床試験が施行された(デノスマブ群,ゾレドロン酸群それぞれ859例)6)。中央値17.4カ月の観察で,デノスマブはゾレドロン酸と骨関連事象の発現抑制効果は同等であった。両群ともに治療開始初期に骨関連事象の発生が多かったが,15カ月以降の骨関連事象の発現はデノスマブ群で有意に少なかった。死亡数はデノスマブ群,ゾレドロン酸群でそれぞれ121,129例であり,全生存割合への影響に差はなかったが,無進行生存期間はデノスマブ群で有意に延長していた(中央値46.09 vs 35.38カ月)。デノスマブはゾレドロン酸と異なり腎障害例でも減量の必要はないが,腎障害の発生・増悪はゾレドロン酸群に比べデノスマブ群で有意に少なかった。低カルシウム血症は大部分がG1-2の軽度のものであったが,低カルシウム血症の発生はデノスマブ群で有意に多かった(16.9 vs 12.4%)。顎骨壊死の発生には両群間で差はなかった。このように今回の大規模試験で,骨病変を有する初発例に対するデノスマブとゾレドロン酸の治療効果がより明瞭になった。
治療効果の優れた新規抗骨髄腫薬が次々と臨床応用されているため,これらとの併用下での,ゾレドロン酸やデノスマブの有用性や至適な投与法・投与期間さらには生存へのメリットを今後さらに明らかにする必要がある。
参考文献
1) Rosen LS, et al. Zoledronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma : a phase III, double-blind, comparative trial. Cancer J. 2001 ; 7 (5) : 377-87. (1iC)
2) Rosen LS, et al. Long-term efficacy and safety of zoledronic acid compared with pamidronate disodium in the treatment of skeletal complications in patients with advanced multiple myeloma or breast carcinoma : a randomized, double-blind, multicenter, comparative trial. Cancer. 2003 ; 98 (8) : 1735-44. (1iC)
3) Morgan GJ, et al. First-line treatment with zoledronic acid as compared with clodronic acid in multiple myeloma (MRC Myeloma IX) : a randomised controlled trial. Lancet. 2010 ; 376 (9757) : 1989-99. (1iiA)
4) Morgan GJ, et al. Effects of induction and maintenance plus long-term bisphosphonates on bone disease in patients with multiple myeloma : the Medical Research Council Myeloma IX Trial. Blood. 2012 ; 119 (23) : 5374-83. (1iiA)
5) Henry DH, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastasis in patients with advanced cancer (excluding breast and prostate cance) or multiple myeloma. J Clin Oncol. 2011 ; 29 (9) : 1125-32. (1iC)
6) Raje N, et al. Comparison of denosumab with zoledronic acid for the treatment of bone disease in patients with newly diagnosed multiple myeloma ; An international, randomized, double blind trial. Lancet Oncol. 2018 ; 19 (3) : 370-81. (1iC/1iDiii)
CQ2 骨吸収抑制薬を投与する患者に対する口腔内予防処置は顎骨壊死の発生を抑制するか
- 推奨グレード
- カテゴリー2A
静脈注射用ビスホスホネートやデノスマブなどの骨吸収抑制薬の投与前に歯科医師による口腔内のチェックを受け必要な歯科処置をまず行い,投与開始後は口腔内ケアを行うとともに侵襲的歯科処置を避け,担当医の許可なく歯科治療を受けないようにすることにより,骨吸収抑制薬関連顎骨壊死(ARONJ)発生が抑制される。
解説
顎骨壊死の発症の頻度,特徴,危険因子を明らかにする目的で,1997年以降ビスホスホネートを投与されている骨髄腫と骨転移を有する患者252例を2003年より追跡調査した報告では,全体で17例(6.7%),うち骨髄腫患者では111例中11例(9.9%)に顎骨壊死が発症していた1)。顎骨壊死を発症した患者のビスホスホネートの投与回数は平均35回であり,13回の投与まででは発症者はいなかった。ゾレドロン酸の継続投与群ではパミドロネート群に比べ有意に発症者が多かった。また,骨吸収抑制薬関連顎骨壊死(ARONJ)は,静脈注射用ビスホスホネートの投与を受けた癌患者がほとんどである。ARONJの多くが抜歯等の歯科処置や局所感染に関連して発現しており,ビスホスホネートの投与回数,総投与量が多くなると発症頻度は増加している。骨病変を有する初発骨髄腫患者に対し,デノスマブとゾレドロン酸の治療効果を比較検討した国際共同大規模第Ⅲ相臨床試験ではARONJの発生には両群間で差はなかった2)。
口腔内予防処置として,①ゾレドロン酸の投与前に歯科医師による口腔内のチェックを受け,必要な歯科処置を行う,②侵襲的歯科処置の場合は処置後6〜8週後に創傷の治癒が確認された場合にゾレドロン酸の投与を開始する,③ゾレドロン酸の投与開始後は口腔内ケアを十分に行い,担当医の許可なく歯科を受診し治療を受けないようにすることを行うと,ゾレドロン酸を長期に使用(6回以上)している骨髄腫患者でARONJの発症は1/3以下に減少し,重症例(stage 3)はなかったと報告されている3)。ARONJは治癒が非常に困難な疾患と考えられていたが,ARONJが治癒しなかった症例は24%で,12%が改善後再燃,62%が改善・治癒しているとの報告がある4)。また,治癒した12例にビスホスホネートが再開され,6例にARONJが再び発症している。
新規発症骨髄腫患者に対するゾレドロン酸とクロドロネートの長期投与の効果を比較する大規模臨床試験(MRC Myeloma Ⅸ trial)が英国で実施された5)。本試験では口腔内予防措置が行われたが,口腔内予防措置を行っても年間約4%の患者にARONJが発生しているため,予防措置に加えARONJの早期発見のための注意深い観察と対応が必要である。
参考文献
1) Bamias A, et al. Osteonecrosis of the jaw in cancer after treatment with bisphosphonates : incidence and risk factors. J Clin Oncol. 2005 ; 23 (34) : 8580-7. (3iiiC)
2) Raje N, et al. Comparison of denosumab with zoledronic acid for the treatment of bone disease in patients with newly diagnosed multiple myeloma ; An international, randomized, double blind trial. Lancet Oncol. 2018 ; 19 (3) : 370-81. (1iA)
3) Dimopoulos MA, et al. Reduction of osteonecrosis of the jaw (ONJ) after implementation of preventive measures in patients with multiple myeloma treated with zoledronic acid. Ann Oncol. 2009 ; 20 (1) : 117-20. (3iiiC)
4) Badros A, et al. Natural history of osteonecrosis of the jaw in patients with multiple myeloma. J Clin Oncol. 2008 ; 26 (36) : 5904-9. (3iiiC)
5) Morgan GJ, et al. First-line treatment with zoledronic acid as compared with clodronic acid in multiple myeloma (MRC Myeloma Ⅸ) : a randomised controlled trial. Lancet. 2010 ; 376 (9757) : 1989-99. (1iiA)
CQ3 プロテアソーム阻害薬投与中の患者に対するアシクロビル内服は帯状疱疹の発生率を減少させるか
- 推奨グレード
- カテゴリー2A
プロテアソーム阻害薬投与中の患者に対するアシクロビルの予防内服は帯状疱疹の発生率を減少させるため推奨される。
解説
ボルテゾミブ(BOR)投与中の患者では,帯状疱疹の発症が比較的早期に出現することが指摘されている。特に,デキサメタゾン(DEX)を併用する場合は注意が必要である。BOR投与により神経障害性疼痛を合併している場合,帯状疱疹の発症は神経障害性疼痛症状を増悪させ,患者の生活の質をさらに低下させる。APEX試験では,BOR単剤およびDEXの併用群で331例中42例(13%)に帯状疱疹が発現し,DEX単独群(5%)よりBOR投与群で帯状疱疹の発症が有意に多かった1)。BORとMP療法(MEL,PSL)を併用したVISTA試験では,MP療法群に比べBOR併用群で帯状疱疹の発症が高頻度であった(13% vs 4%)2)。また,アシクロビル(ACV)の予防内服をしなかった250例では43例(17.2%)に帯状疱疹が発現したのに対し,予防内服をした90例では帯状疱疹発現が3例(3.3%)のみに減少しており,ACVの予防内服により帯状疱疹の発生を減少させることが示された2)。ACV 200mg/日の低用量の予防内服により帯状疱疹の発生を減少させることが示されている3)。Carfilzomibやixazomibの大規模試験でもACVが予防投与されている。しかし,長期間にわたる抗ウイルス薬投与による腎障害や神経障害にも注意が必要である。
参考文献
1) Chanan-Khan A, et al. Analysis of herpes zoster events among bertezomib-treated patients in the phaseⅢ APEX study. J Clin Oncol. 2008 ; 26 (29) : 4784-90. (1iiA)
2) San Miguel JF, et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. N Engl J Med. 2008 ; 359 (9) : 906-17. (1iiDiii/1iiA)
3) Aoki T, et al. Efficacy of continuous, daily, oral, ultra-low-dose 200 mg acyclovir to prevent herpes zoster events among bortezomib-treated patients : a report from retrospective study. Jpn J Clin Oncol. 2011 ; 41 (7) : 876-81. (3iiiC)
CQ4 免疫調節薬投与患者に対するアスピリンの内服は深部静脈血栓症の発生を抑制するか
- 推奨グレード
- カテゴリー2A
サリドマイド,レナリドミドやポマリドミドを含む併用療法では,低用量アスピリン(81~100mg/日)の予防内服が深部静脈血栓症(DVT)発症の予防に推奨される。既存のDVT発症の危険因子を有する患者ではより厳格な管理が必要である。
解説
骨髄腫患者では深部静脈血栓症(deep vein thrombosis:DVT)の発症が多い傾向がある。DVTをきたしやすい骨髄腫患者の危険因子として,高齢,先行する凝固異常やDVTの既往,エリスロポエチンの使用,高用量デキサメタゾン(DEX)の使用,ドキソルビシン(DXR)を含む併用化学療法,長期臥床,中心静脈カテーテルの使用,腫瘍量が多いこと,および感染や炎症の存在などが指摘されており,このような危険因子があれば,DVT発症に対する予防策をとることがもともと推奨されていた1)。
サリドマイド(THAL)やレナリドミド(LEN)を含む併用療法では静脈血栓塞栓症(venous thromboembolism:VTE)発症が増加する。未治療例に対するTHALとDEXの併用とDEX単独投与を比較したランダム化比較試験において,DEX単独投与ではDVTの発症は3%であったが,THALの併用で17%に増加した2)。再発難治性骨髄腫に対するLENとDEXの併用とDEX単独療法を比較したMM009,MM010試験では,DVTの発症率は,LENとDEXの併用群のほうがDEX群より高率であった(それぞれ14.7% vs 3.4%,11.4% vs 4.6%)3, 4)。新規発症例の方が再発例よりDVTの危険が高く,DVT発症はTHALやLENを含む治療開始後5カ月以内に多い。THALやLENを含む併用療法ではVTEの発症予防に,DVTの発症リスクが低い患者に対しては低用量アスピリン(81~100mg/日)の予防内服が,またリスクが高い患者に対しては低分子へパリンの予防投与を治療開始から最低4~6カ月間行うことが推奨されている。THALを含む寛解導入療法(MPBT,BTDあるいはTD)(n=220)の前方視的検討において,低用量アスピリン(100mg/日)の予防内服がDVTの発症を最初の6カ月間で6.4%に抑制した5)。なお,MM009,MM010両試験におけるサブグループ解析では,LEN+DEX群において血栓症の発症の有無および血栓症予防のための抗血栓療法の有無とOS,TTPなどとの相関は認められなかったことが報告されている6)。したがって,上記の血栓症予防対策はLENによる抗腫瘍効果に負の影響は及ぼさないと考えられる。再発難治性骨髄腫に対するポマリドミド(POM)と少量DEXの併用とDEX単独療法を比較したMM-003試験では,血栓リスクのない場合にはPOM投与期間中低用量アスピリンの予防内服を,また血栓リスクのある場合には低分子へパリンの予防投与を行い,DVTおよび肺梗塞がほとんど発生していない(全Gradeの合計がPOM群で2%,DEX単独群で1%)。DVTのリスクには人種差があるため,本邦での大規模試験におけるエビデンスが望まれる。
参考文献
1) Palumbo A, et al. Prevention of thalidomide- and lenalidomide-associated thrombosis in myeloma. Leukemia. 2008 ; 22 (2) : 414-23. (レビュー)
2) Rajkumar SV, et al. Eastern Cooperative Oncology Group. Phase Ⅲ clinical trial of thalidomide plus dexamethasone compared with dexamethasone alone in newly diagnosed multiple myeloma : a clinical trial coordinated by the Eastern Cooperative Oncology Group. J Clin Oncol. 2006 ; 24 (3) : 431-6. (1iiA)
3) Weber DM, et al. Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America. N Engl J Med. 2007 ; 357 (21) : 2133-42. (1iA)
4) Dimopoulos M, et al. Lenalidomide plus dexamethasone for relapsed or refractory multiple myeloma. N Engl J Med. 2007 ; 357 (21) : 2123-32. (1iA)
5) Palumbo A, et al. Aspirin, warfarin, or enoxaparin thromboprophylaxis in patients with multiple myeloma treated with thalidomide : a phase Ⅲ, open-label, randomized trial. J Clin Oncol. 2011 ; 29 (8) : 986-93. (1iiA)
6) Zangari M, et al. Survival Effect of Venous Thromboembolism in Patients With Multiple Myeloma Treated With Lenalidomide and High-Dose Dexamethasone. J Clin Oncol. 2010 ; 28 (1) : 132-5. (1iA)
7) San Miguel J, et al. Pomalidomide plus low-dose dexamethasone versus high-dose dexamethasone alone for patients with relapsed and refractory multiple myeloma (MM-003) : a randomised, open-label, phase 3 trial. Lancet Oncol. 2013 ; 14 (11) : 1055-66. (1iiA)

