第Ⅲ章 骨髄腫
Ⅲ 骨髄腫
2 多発性骨髄腫の類縁疾患
【孤立性形質細胞腫】
総論
国際骨髄腫作業部会(International Myeloma Working Group:IMWG)の分類では,骨または軟部組織の孤立性形質細胞腫は,①生検にてクローナルな形質細胞から成る骨あるいは軟部組織の形質細胞腫の存在,②骨髄中にクローナルな形質細胞を認めない,③孤立性形質細胞腫病変以外には骨X線,椎体および骨盤MRI(またはCT)で異常を認めない,④臓器障害(CRAB)を認めない,の4項目すべてを満たす疾患と定義されている1)。また骨または軟部組織の微小骨髄浸潤を有する孤立性形質細胞腫は,①生検にてクローナルな形質細胞から成る骨あるいは軟部組織の形質細胞腫の存在,②骨髄中のクローナルな形質細胞<10%,③孤立性形質細胞腫病変以外には骨X線,椎体および骨盤MRI(またはCT)で異常を認めない,の4項目すべてを満たす疾患である1)。
軟部組織の孤立性形質細胞腫は鼻腔,副鼻腔,消化管,肺,甲状腺,眼窩,リンパ節などに発生する。80%以上が上部気道や上部消化管に分布し,上部気道では副鼻腔が多い。初発症状や臨床像は腫瘍の発生部位で異なる。軟部組織の孤立性形質細胞腫の経過は一般に緩慢で,多発性骨髄腫への進展は稀であるが,骨の孤立性形質細胞腫は多発性骨髄腫に進展しやすい。比較的最近の報告では,骨の孤立性形質細胞腫診断後5年の全生存割合(OS),無病生存割合(DFS)はそれぞれ70%と46%であり,5年で約半数が多発性骨髄腫へ移行していた2)。多発性骨髄腫へ移行した時期は診断から平均21カ月であったとされている。いったん多発性骨髄腫へ進展するとその予後は,多発性骨髄腫の予後と同等に悪くなる。一般に多発性骨髄腫への進展が予後を決めると考えられる。また,米国で1998~2004年の間に診断された孤立性形質細胞腫患者1,472例の予後を解析した報告では,若年群ほどOS,疾患特異的生存割合ともに高く,骨の孤立性形質細胞腫と軟部組織の孤立性形質細胞腫の予後を比較するとOS,疾患特異的生存割合ともに骨の孤立性形質細胞腫のほうが予後不良である3)。疾患特異的生存割合は,骨の孤立性形質細胞腫が50%,軟部組織の孤立性形質細胞腫が80%でプラトーになっており,両病型の間で治癒率に大きな差があることが示されている。
局所療法として放射線療法と外科的切除が主に行われる。また,病変の部位や治療経過により化学療法も検討される。一般に放射線感受性が高い腫瘍と考えられているが,症例が少ないこともあり放射線療法の至適照射量などの十分な検討が少なく,標準治療は確立されていない。予後良好因子として,若年者および腫瘍径5cm未満であること4)が,また多発性骨髄腫への進展を示唆する因子として,診断時の腫瘍の大きさや蛋白分画でのM蛋白の存在等が挙げられている5)。
参考文献
1)Rajkumar SV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 ; 15 (12) : e538-48.
2)Knobel D, et al. Prognostic factors in solitary plasmacytoma of the bone : a multicenter Rare Cancer Network study. BMC Cancer. 2006 ; 6 : 118. (3iiiA)
3)Dores GM, et al. Plasmacytoma of bone, extramedullary plasmacytoma, and multiple myeloma : incidence and survival in the United States, 1992-2004. Br J Haematol. 2009 ; 144 (1) : 86-94. (3iA)
4)Nanni C, et al. 18F-FDG PET/CT in myeloma with presumed solitary plasmocytoma of bone. In Vivo. 2008 ; 22 (4) : 513-7. (3iiDiv)
5)Holland J, et al. Plasmacytoma. Treatment results and conversion to myeloma. Cancer. 1992 ; 69 (6) : 1513-7. (3iiiDiv)
CQ1 孤立性形質細胞腫において放射線療法による初期治療後の補助化学療法は多発性骨髄腫への進展を遅らせるか
- 推奨グレード
- カテゴリー2B
孤立性形質細胞腫に対し局所放射線療法に加え,多剤併用化学療法の追加による多発性骨髄腫への進展抑制効果は示されていない。逆に二次性白血病などのリスクが高まることが懸念され,放射線療法による初期治療後の多剤併用化学療法による補助化学療法は推奨されない。
解説
孤立性形質細胞腫から多発性骨髄腫への進展をきたすと予後が不良になる。孤立性形質細胞腫258例(骨の孤立性形質細胞腫206例,軟部組織の孤立性形質細胞腫52例)のうち214例が放射線療法のみ,34例が放射線療法と化学療法[22例がMP療法(MEL,PSL),7例がVAD療法(VCR,DXR,DEX),5例がその他の多剤併用療法]を中央値で6コース併用した観察で,平均観察期間が56カ月で多発性骨髄腫への進行までの期間の中央値は21カ月であった1)。10年後の多発性骨髄腫への進展率は放射線療法単独群で64%,化学療法併用群で74%と化学療法を追加する有用性が認められていない。また,腫瘍径が4cm未満の場合が4cm以上に比べ予後良好であった。このように,孤立性形質細胞腫に対し局所放射線療法にMP療法などの多剤併用化学療法を追加する有用性は示されていない。逆に二次性白血病などのリスクが高まることが懸念される。国際骨髄腫作業部会(International Myeloma Working Group:IMWG)の診断規準が出される以前の報告では,椎骨と腸骨のMRIの評価が行われていないため,現在試行可能なMRIやPET/CTで詳細な評価を行えば一部の症例が多発性骨髄腫と診断される可能性がある。また,これまでの報告では新規薬剤を用いた検討もない。今後,PET/CTやMRIなどの画像診断にて孤立性かどうかのより厳密な診断を行った多数例で,診断時の孤立性腫瘍の大きさ,M蛋白の存在や腸骨の骨髄穿刺での多発性骨髄腫の診断規準を満たさない単クローン性の形質細胞の存在等が多発性骨髄腫への進展へのリスク因子になるのかどうか,またこのようなリスク因子がある場合の新規薬剤を用いた補助化学療法が多発性骨髄腫への進展の抑制効果があるのかどうかなどの検討が望まれる。
参考文献
1)Ozsahin M, et al. Outcomes and patterns of failure in solitary plasmacytoma : a multicenter Rare Cancer Network study of 258 patients. Int J Radiat Oncol Biol Phys. 2006 ; 64 (1) : 210-7. (3iiA)
【ALアミロイドーシス】
総論
ALアミロイドーシスは,異常形質細胞より産生されるモノクローナル免疫グロブリン(M蛋白)の軽鎖(L鎖)に由来するアミロイド蛋白が全身諸臓器に沈着し,臓器障害をきたす疾患である1, 2)。免疫グロブリン重鎖(H鎖)に由来するものはAHアミロイドーシスと呼ばれるが極めて稀で,両者をあわせて免疫グロブリン性アミロイドーシスとも呼ぶ。多発性骨髄腫や原発性マクログロブリン血症など基礎疾患を伴わない場合を原発性,基礎疾患に伴う場合を二次性ALアミロイドーシスと呼ぶ。しかし,実際には両者の鑑別困難な症例もみられ,WHO分類(2017)では両者をまとめて原発性アミロイドーシスとしている3)。また,病変が複数の臓器にわたる場合を全身性,一臓器に限局する場合を限局性と呼ぶ。本疾患は稀な病気であり,2014年に実施された全国疫学調査では,2012~2014年のALアミロイドーシス推定患者数は3,200例であった4)。アミロイド蛋白の沈着は心臓,腎臓,肝臓,消化管,末梢神経など多臓器にわたり,多彩な臨床症状を呈する。診断確定は病理学的所見に基づき,Congo red染色で橙赤色に染まり,偏光顕微鏡下で緑色の複屈折を示すことが必須である。さらに抗免疫グロブリン軽鎖抗体を用いた免疫染色でアミロイドの病型を確定する。病型診断が困難な場合は,アミロイド沈着部位をレーザーマイクロダイセクションで採取し,質量解析を行う。M蛋白の検出には血清・尿の蛋白電気泳動,免疫電気泳動が行われるが,遊離軽鎖(free light chain:FLC)の測定は感度が高く有用である。本症の予後は不良であり,無治療例での診断からの50%生存期間はおよそ13カ月,特に心病変を有する症例は予後不良である。治療目標はアミロイド蛋白の原因となっているモノクローナルなFLCの産生を速やかに抑制し,臓器機能を温存することにある。自家末梢血幹細胞移植は臓器障害のため治療関連死亡が高いので適応を慎重に検討し,リスクに応じた前処置の減量を考慮し実施することが重要である5-7)。自家末梢血幹細胞移植の適応のない症例ではメルファラン/デキサメタゾン療法あるいは減量DEX(LD-DEX)が推奨されるが,最近ではボルテゾミブなどの多発性骨髄腫に用いられる新規薬剤の有用性が報告されている8-11)。
参考文献
1)Falk RH, et al. The systemic amyloidosis. N Engl J Med. 1997 ; 337 (13) : 898-909.
2)Merlini G, et al. Dangerous small B-cell clones. Blood. 2006 ; 108 (8) : 2520-30.
3)Mckenna RW, et al. Plasma cell neoplasms. Swerdlow SH, et al, eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, IARC ; 2017 : pp254-5. (テキストブック)
4)安東由喜雄.アミロイドーシスに関する調査研究 厚生労働科学研究補助金 難治性疾患政策研究事業 アミロイドーシスに関する調査研究 平成27年度総括研究報告書.pp1-23, 2016.
5)Jaccard A, et al. High-dose melphalan versus melphalan plus dexamethasone for AL amyloidosis. N Engl J Med. 2007 ; 357 (11) : 1083-93. (1iiA)
6)Comenzo R, et al. Autologous stem cell transplantation for primary systemic amyloidosis. Blood. 2002 ; 99 (12) : 4276-82.
7)Skinner M, et al. High-dose melphalan and autologous stem cell transplantation in the patients with AL amyloidosis : An 8-year study. Ann Intern Med. 2004 ; 140 (2) : 85-93. (3iiiA)
8)Palladini G, et al. Association of melphalan and high-dose dexamethasone is effective and well tolerated in patients with in AL (primary) amyloidosis who are ineligible for stem cell transplantation. Blood. 2004 ; 103 (8) : 2936-38. (3iiiDiv)
9)Palladini G, et al. A European collaborative study of cyclophosphamide, bortezomib, and dexamethasone in upfront treatment of systemic AL amyloidosis. Blood. 2015 ; 126 (5) : 612-5. (3iiiA)
10)Shimazaki C, et al. Phase 1 study of bortezomib in combination with melphalan and dexamethasone in Japanese patients with relapsed AL amyloidosis. Int J Hematol. 2016 ; 103 (1) : 79-85. (3iiiDiv)
11)Shimazaki C, et al. Nationwide survey of 741 patients with systemic amyloid light-chain amyloidosis in Japan. Intern Med. 2017 ; 57 (2) : 181-7.
アルゴリズム
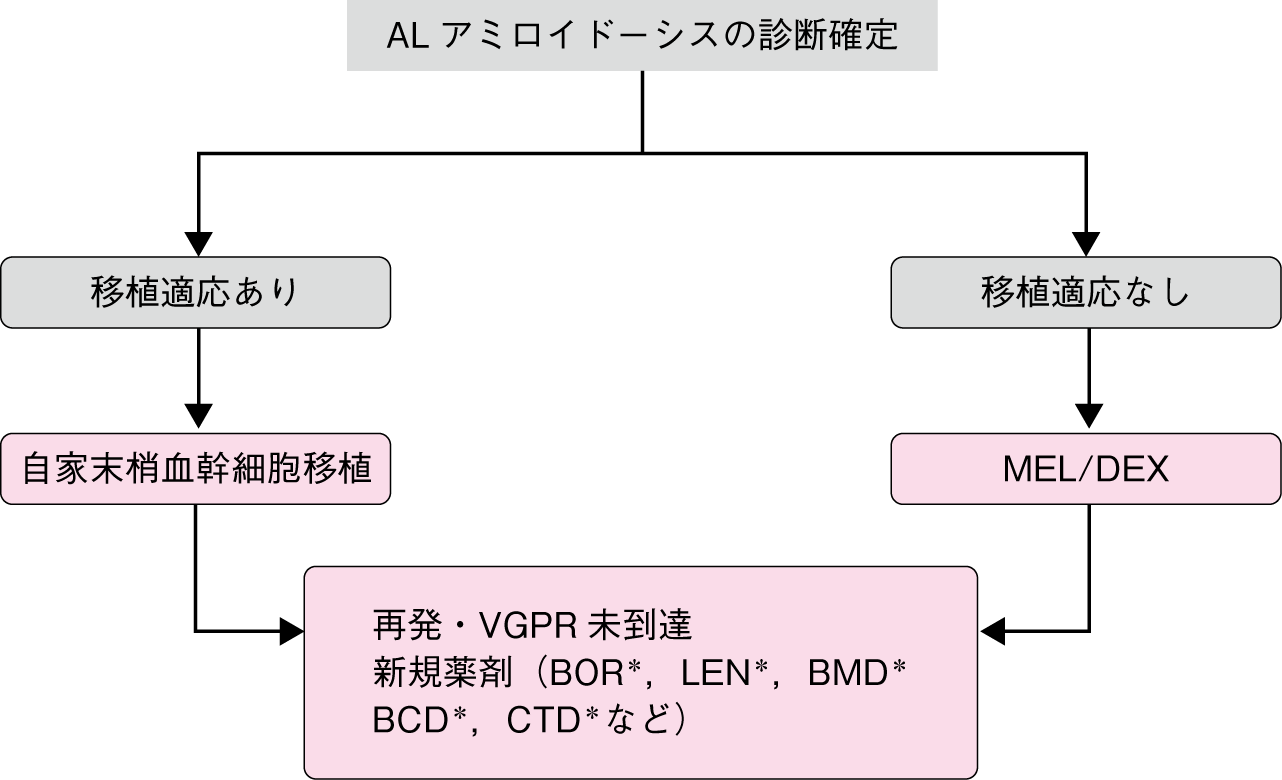
MEL/DEX : melphalan/dexamethasone, LD-DEX : low-dose dexamethasone, BOR : bortezomib, LEN : lenalidomide, BMD : bortezomib/melphalan/dexamethasone, BCD : bortezomib/cyclophosphamide/dexamethasone, CTD : cyclophosphamide/thalidomide/dexamethasone
*国内保険適用外
まず,自家移植の適応があるか否かを慎重に検討する(AL:CQ1,エビデンスレベル2A)。自家移植の適応があればリスクに応じてメルファランの減量も考慮して実施する。CRが得られれば経過観察する。移植の適応がない場合は,標準療法としてMEL/DEX,LD-DEX,が推奨される(AL:CQ2,エビデンスレベル1iiA)。VGPR未到達あるいは再発時はボルテゾミブ,レナリドミドなどの新規薬剤を検討する。
CQ1 全身性アミロイドーシスに対し自家造血幹細胞移植併用大量メルファラン療法を行うことは行わない場合と比べて予後を改善させるか
- 推奨グレード
- カテゴリー2B
自家造血幹細胞移植は,適応を慎重に考慮するとともにリスクに応じてメルファランを減量することにより,予後を改善させる可能性がある。
解説
ALアミロイドーシスに対する自家末梢血幹細胞移植の後方視的解析では,平均OSは4.6年,1年以上生存かつCR例のOSは10年を超えている1)。血液学的CRは40%にみられ,それらの症例の66%に1臓器以上の改善が得られている。本治療の有用性については,症例対照研究で標準化学療法より優れていると報告された2)。しかし,唯一のランダム化試験であるIFMの試験では自家移植とMEL(メルファラン)/DEX(デキサメタゾン)との比較が行われ,OSでは移植群22.2カ月,化学療法群56.9カ月と化学療法群が有意に優れていた(p=0.04)3)。高リスク群ではOSに有意差はなく,低リスク群では3年OSがそれぞれ58%,80%であった。ただし,本試験では移植の適応基準がゆるく移植群に重症例が含まれたこと,その結果移植群におけるTRMが24%と高いこと,移植群における移植実施数が少ないこと,観察期間が短いことなど試験上の問題点も指摘されており,自家移植を否定する根拠になっていない。移植適応基準を遵守し,リスクに応じた前処置MELの減量を行うことによりTRMは5%程度に減少しており,経験豊富な施設において実施を検討すべきである1, 4-6)。
参考文献
1) Skinner M, et al. High-dose melphalan and autologous stem cell transplantation in the patients with AL amyloidosis : An 8-year study. Ann Intern Med. 2004 ; 140 (2) : 85-93 (3iiiA)
2) Dispenzieri A, et al. Superior survival in primary systemic amyloidosis patients undergoing peripheral blood stem cell transplantation : A case-control study. Blood. 2004 ; 103 (10) : 3960-3. (2A)
3) Jaccard A, et al. High-dose melphalan versus melphalan plus dexamethasone for AL amyloidosis. N Engl J Med. 2007 ; 357 (11) : 1083-93. (1iiA)
4) Comenzo R, et al. Autologous stem cell transplantation for primary systemic amyloidosis. Blood. 2002 ; 99 (12) : 4276-82.
5) Wechalekar AD, et al. Perspectives in treatment of AL amyloidosis. Br J Haematol. 2007 ; 140 (4) : 365-77.
6) D’Souza A, et al. Improved outcomes after autologous hematopoietic cell transplantation for light chain amyloidosis : a center for International Blood and Marrow Transplant Research Study. J Clin Oncol. 2015 ; 33 (32) : 3741-9. (3iiiA)
CQ2 移植適応のない全身性アミロイドーシス患者にはどのような治療が推奨されるか
- 推奨グレード
- カテゴリー2B
MD療法(メルファラン,デキサメタゾン)が推奨される。
解説
移植適応のないALアミロイドーシスに対する標準治療は確立されていない。MPとコルヒチンとのランダム化試験でMPの優位性が明らかにされたが,平均生存期間は18カ月であり推奨できるものではない1)。その後,VADや大量DEXが行われてきたがVCRによる神経毒性,DXRによる心毒性,大量DEXによる毒性の問題があり推奨されていない,現在もっとも頻用されているのがMD療法(MEL,低用量DEX)である。96例を対象とした試験で67%にPR以上の血液学的奏効がみられ,効果発現は4.5カ月以内と早く,臓器効果も48%にみられている2)。本療法は忍容性が高く,その後の長期観察結果では平均生存期間5.1年,無増悪生存期間3.8年であった3)。MD療法と自家移植とのランダム化比較試験でも,生存期間の中央値は56.9カ月とその有用性が確認されている4)。しかし,重篤な心障害を有する症例に対する効果は限られている。最近では,ボルテゾミブなどの新規薬剤の有用性が報告され,汎用されつつあるが安全性も含めた十分なデータがない現状にある5-7)。
参考文献
1) Kyle RA, et al. A trial of three regimens for primary amyloidosis : Colchicine alone, melphalan and prednisone, and melphalan, prednisone and colchicines. N Engl J Med. 1997 ; 336 (17) : 1202-7. (1iA)
2) Palladini G, et al. Association of melphalan and high-dose dexamethasone is effective and well tolerated in patients with in AL (primary) amyloidosis who are ineligible for stem cell transplantation. Blood. 2004 ; 103 (8) : 2936-8. (3iiiDiv)
3) Palladini G, et al. Treatment with oral melphalan plus dexamethasone produces long-term remission in AL amyloidosis. Blood. 2007 ; 110 (2) : 787-8. (3iiiDiv)
4) Jaccard A, et al. High-dose melphalan versus melphalan plus dexamethasone for AL amyloidosis. N Engl J Med. 2007 ; 357 (11) : 1083-93. (1iiA)
5) Palladini G, et al. A European collaborative study of cyclophosphamide, bortezomib, and dexamethasone in upfront treatment of systemic AL amyloidosis. Blood. 2015 ; 126 (5) : 612-5. (3iiiA)
6) Shimazaki C, et al. Phase 1 study of bortezomib in combination with melphalan and dexamethasone in Japanese patients with relapsed AL amyloidosis. Int J Hematol. 2016 ; 103 (1) : 79-85. (3iiiDiv)
7) Shimazaki C, et al. Nationwide survey of 741 patients with systemic amyloid light-chain amyloidosis in Japan. Intern Med. 2017 ; 57 (2) : 181-7.
【POEMS症候群】
総論
POEMS症候群(Crow-Fukase症候群,高月病)はplasma cell dyscrasiaを基盤に,多発神経炎による末梢神経障害,臓器腫大(肝脾腫),浮腫・胸腹水,皮膚症状(剛毛,色素沈着,血管腫),骨硬化性病変,M蛋白血症などを呈する全身性疾患であり,稀ではあるが,本邦での発症率は欧米よりも高い。多彩な症状の中で,特に末梢神経障害が患者のADLを著しく障害し,末期には四肢麻痺,多臓器不全に至る予後不良な疾患である。POEMS症候群の病態は十分に解明されていないが,血清中の血管内皮増殖因子(VEGF)が異常高値であり,多彩な症状を惹起していることが推定されている1)。また,本症候群におけるM蛋白量は微量であるが,ほぼ全例でλ型である。このλ型再構成軽鎖はVλ1 subfamilyに属し,しかもわずか2種類の特定の胚細胞遺伝子から由来することが判明している2)。
本症候群の診断規準を表1に示す3)。末梢神経炎とモノクローナル形質細胞増加(λ型)が必須であり,さらにVEGF増加等が必要である(VEGF測定は国内未承認)。治療効果判定規準としては,血液学的奏効に加え,VEGF奏効や臨床症状の改善などを加味した治療効果判定規準が提唱されている4)。
本疾患の頻度は低いため,多数例における前方視的ランダム化比較試験は行われていない。近年,多発性骨髄腫に準じた形質細胞を治療標的とする自家造血幹細胞移植やサリドマイドなどの新規薬剤の有効性が報告され,治療成績や予後が著しく改善されてきた。形質細胞腫が存在する場合は外科的摘出または放射線照射の有効性が報告されている。本症候群患者は末梢神経障害によりperformance status(PS)不良であるが,末梢神経障害は可逆的であり,治療が奏効すると末梢神経障害は改善し,PSも改善する。したがって,治療方針決定の際にはその点も考慮する必要がある。
表1 POEMS症候群の診断規準3)
| 必須大規準 | 1.多発神経炎(脱髄性障害が典型的) 2.モノクローナル形質細胞増殖疾患(ほぼ常にλ型) |
|---|---|
| 他の大規準 (1つ以上を満たす) |
3.キャッスルマン病a 4.硬化性骨病変 5.VEGF上昇 |
| 小規準 | 6.臓器腫大(脾腫,肝腫,リンパ節腫脹) 7.血管外体液漏出(浮腫,胸水,腹水) 8.内分泌異常(副腎,甲状腺b,下垂体,性腺,副甲状腺,膵臓b) 9.皮膚異常(色素沈着,多毛,糸球体様血管腫,多汗症,先端チアノーゼ,紅潮,白状爪) 10.乳頭浮腫 11.血小板増加/多血症c |
| 他の症状と徴候 | ばち指,体重減少,多汗,肺高血圧症/拘束性肺障害,血栓性素因,下痢,ビタミンB12低値 |
注)POEMS症候群の診断には,必須大規準の両者を満たし,他の大規準の1つ以上,かつ小規準1つ以上を満たすことが必要である。
a モノクローナル形質細胞増殖が明らかではないキャッスルマン病バリアントが存在する。
b 糖尿病と甲状腺機能異常は頻度が極めて高いため,これら単独では小規準を満たさない。
c キャッスルマン病の合併がなければ,貧血や血小板減少症は極めて稀である。
参考文献
1)Watanabe O, et al. Greatly raised vascular endothelial growth factor (VEGF) in POEMS syndrome. Lancet. 1996 ; 347 (9002) : 702.
2)Abe D, et al. Restrictive usage of monoclonal immunoglobulin lambda light chain germline in POEMS syndrome. Blood. 2008 ; 112 (3) : 836-9.
3)Dispenzieri A. POEMS syndrome : 2017 Update on diagnosis, risk stratification, and management. Am J Hematol. 2017 ; 92 (8) : 814-29. (レビュー)
4)D’Souza A, et al. Long-term outcomes after autologous stem cell transplantation for patients with POEMS syndrome (osteosclerotic myeloma): a single-center experience. Blood. 2012 ; 120 (1) : 56-62. (3iiA)
CQ1 移植非適応患者や再発・難治患者にはどのような治療が推奨されるか
- 推奨グレード
- カテゴリー2B
メルファラン+デキサメタゾン療法や,サリドマイド,レナリドミド,ボルテゾミブ等の新規薬剤とデキサメサゾン併用療法が試みられる。
解説
POEMS症候群において,65歳以上または臓器不全を有する移植非適応患者や再発・難治例に対する標準治療は確立していない。多発性骨髄腫に準じて化学療法や新規薬剤が試みられている。
2011年にLiらは,メルファラン+デキサメタゾン(MDex)療法が初発POEMS症候群患者に有効であると報告した1)。31例中25例(80.6%)に血液学的奏効を認め,うちM蛋白の消失した完全奏効は12例(38.7%)に認められた。全例で神経学的改善と血清VEGF値の低下を認めた。
新規薬剤については,わが国を中心にサリドマイドの有効性が検証され,その後レナリドミド,ボルテゾミブの有効性も報告されている。ただし,わが国おいてはいずれも保険適用外である。
サリドマイドは強力なVEGF産生抑制作用を有し,本症候群の治療に理論的に適している薬剤である。Kuwabaraらは移植非適応患者に対し,サリドマイド+デキサメタゾン(Td)療法を行い,血清VEGF値の低下,末梢神経障害(PN)の改善など,良好な成績を得た2)。その後わが国において,多施設共同プラセボ比較ランダム化比較試験(J-POST試験)が行われた3)。本試験はサリドマイドの適応拡大を目指した医師主導型自主臨床試験である。患者は24週間のTd療法群またはプラセボ+デキサメタゾン群に割り付けられ,途中増悪例はTd療法に移行した。主要評価項目である24週後の血清VEGF減少率は有意にTd療法群が良好であった4)。Td療法の有害事象としては,徐脈や静脈血栓症の頻度が高く,注意を要する。
レナリドミドはサリドマイドよりもPNの程度が低く,有効性が報告されている。Royerらはレナリドミド+デキサメサゾン(Ld)療法を受けた初発例4例を含む20例について後方視的に解析した5)。19例で奏効が得られ,VGPR以上の奏効は68%の患者に認められた。評価可能17例全例において,血清VEGFの有意な減少が認められた。また,NozzaらはLd療法単群の前方視的臨床試験を行い,18例中13例(72%)に神経学的または臨床的改善が認められ,3年でのPFSは59%であったと報告した6)。
ボルテゾミブはPNの頻度が高く,POEMS症候群におけるPNを増悪させることが懸念されるが,有効性も報告されている7)。しかしいずれも症例報告に留まる。ボルテゾミブ誘発性PNは皮下投与で軽減されることから,皮下投与が推奨される。
参考文献
1) Li J, et al. Combination of melphalan and dexamethasone for patients with newly diagnosed POEMS syndrome. Blood. 2011 ; 117 (24) : 6445-9. (3iiA)
2) Kuwabara S, et al. Thalidomide reduces serum VEGF levels and improves peripheral neuropathy in POEMS syndrome. J Neurol Neurosurg Psychiatry. 2008 ; 79 (11) : 1255-7. (3iiDiv)
3) Katayama K, et al. Japanese POEMS syndrome with Thalidomide (J-POST) Trial : study protocol for a phase II/III multicentre, randomised, double-blind, placebo-controlled trial. BMJ Open. 2015 ; 5 (1) : e007330. (1iDiv)
4) Misawa S, et al. Safety and efficacy of thalidomide in patients with POEMS syndrome : a multicentre, randomised, double-blind, placebo-controlled trial. Lancet Neurol. 2016 ; 15 (11) : 1129-37. (1iDiv)
5) Royer B, et al. Efficacy of lenalidomide in POEMS syndrome : a retrospective study of 20 patients. Am J Hematol. 2013 ; 88 (3) : 207-12. (3iiA)
6) Nozza A, et al. Lenalidomide and dexamethasone in patients with POEMS syndrome : results of a prospective, open-label trial. Br J Haematol. 2017 ; 179 (5) : 748-55. (2Diii)
7) Tang X, et al. Successful bortezomib-based treatment in POEMS syndrome. Eur J Haematol. 2009 ; 83 (6) : 609-10. (3iiiDiv)
CQ2 POEMS症候群に対する自家造血幹細胞移植を併用した大量メルファラン療法は予後を改善するか
- 推奨グレード
- カテゴリー2B
自家造血幹細胞移植を併用した大量メルファラン療法は予後を改善させ,末梢神経障害によるADL低下も改善させる。移植適応例では,CQ3に示すように,新規薬剤等による寛解導入療法を行い,全身状態の改善・血清VEGF値の減少を待って移植を行うことが望ましい。
解説
POEMS症候群の治療として,副腎皮質ステロイド療法が主に行われていた1980年代までは平均生存期間は33カ月と不良であった。その後MP療法が行われた1990年代には平均生存期間は5~10年と改善がみられたが,治療効果は不十分であり,部分奏効が得られたとしても早期に再燃がみられた1)。また,長期使用による二次性骨髄異形成症候群の発症頻度も高かった。
2000年頃より65歳未満の症例において,自家造血幹細胞移植併用大量メルファラン療法の有用性が報告されるようになり,2004年にMayo clinicより16例の報告がされた2)。評価可能14例全例に神経学的改善が認められ,移植前に車椅子を必要とした9例全例が自力歩行可能となった。さらに2012年にMayo clinicより59例の長期成績が報告された3)。観察期間中央値45カ月において,1年と5年の無増悪生存割合(PFS)は98%と75%であり,5年全生存割合(OS)は94%であった。EBMTからの後方視的解析では,1997~2010年の間に127例が自家移植を受け,年齢中央値は50歳(26~69歳)で,診断から移植までの期間中央値は7.5カ月であった。生着症候群は23%に認められた。血液学的CRは48.5%に得られ,3年のPFSとOSは84%と94%であった4)。
わが国においても,単一施設における初期の4例において自家移植の有効性が報告され5),その後36例の成績として,5年OS 90%,5年PFS 63%と報告されている6)。日本造血細胞移植学会データベースを用いた後方視的解析では7),2000~2011年の間に95例が自家移植を受けた。年齢中央値は53歳(28~72歳)であり,生着症候群は11例(15.7%)に認められ,Mayo ClinicやEBMTからの報告と比し低い傾向にあった。3年のPFS,OSは78.3%。88.8%であり,神経学的所見等の改善により移植後患者のPSは有意に改善した。
本症候群患者はPS不良で血管透過性亢進による体液貯留傾向があり,多発性骨髄腫に比べて移植関連毒性に注意を要する。前述の2004年のMayo clinicによる報告では,16例中6例が移植後集中治療室での治療を要し,うち5例が人工呼吸器管理となり1例が死亡した。さらに,生着症候群の頻度が高いと報告されている8)。したがって,移植適応例ではCQ3に示すように新規薬剤等による寛解導入療法を行い,全身状態の改善・血清VEGF値の減少を待って移植を行うことが望ましい。
参考文献
1) Kuwabara S, et al. Long term melphalan-prednisolone chemotherapy for POEMS syndrome. J Neurol Neurosurg Psychiatry. 1997 ; 63 (3) : 385-7. (3iiA)
2) Dispenzieri A, et al. Peripheral blood stem cell transplantation in 16 patients with POEMS syndrome, and a review of the literature. Blood. 2004 ; 104 (10) : 3400-7. (3iiA)
3) D’Souza A, et al. Long-term outcomes after autologous stem cell transplantation for patients with POEMS syndrome (osteosclerotic myeloma) : a single-center experience. Blood. 2012 ; 120 (1) : 56-62. (3iiA)
4) Cook G, et al. High-dose therapy and autologous stem cell transplantation in patients with POEMS syndrome : a retrospective study of the Plasma Cell Disorder sub-committee of the Chronic Malignancy Working Party of the European Society for Blood & Marrow Transplantation. Haematologica. 2017 ; 102 (1) : 160-7. (3iiA)
5) Kuwabara S, et al. Autologous peripheral blood stem cell transplantation for POEMS syndrome. Neurology. 2006 ; 66 (1) : 105-7. (3iiDiv)
6) Ohwada C, et al. Long-term evaluation of physical improvement and survival of autologous stem cell transplantation in POEMS syndrome. Blood. 2018 ; 131 (19) : 2173-6.(3iiA)
7) Kawajiri-Manako C, et al. The Efficacy and Long-Term Outcomes of Autologous Stem Cell Transplantation in POEMS Syndrome : A Nation-wide Survey in Japan. Biol Blood Marrow Transplant. 2018 ; 24 (6) : 1180-6. (3iiA)
8) Dispenzieri A, et al. Peripheral blood stem cell transplant for POEMS syndrome is associated with high rates of engraftment syndrome. Eur J Haematol. 2008 ; 80 (5) : 397-406. (3iiDiv)
CQ3 移植適応患者に対して推奨される初回寛解導入レジメンは何か
- 推奨グレード
- カテゴリー2B
サリドマイド+デキサメサゾン療法が推奨される。サリドマイド不応例については,短期間のレナリドミド+デキサメサゾン療法やボルテゾミブによる治療を考慮する。
解説
POEMS症候群では末梢神経障害によるPS不良,全身体液貯留傾向があり,無治療で自家移植を行うと,生着症候群を含む移植関連毒性が増加する1)。また,血清VEGF値は治療効果に対するバイオマーカーであり,移植後のVEGF値は再発に対する強力な予後予測因子となる2)。したがって,多発性骨髄腫と同様,適切な寛解導入療法を行い,血清VEGFの低下とともに全身状態を改善させた上で,より安全に移植を行うことが望ましい。これまで移植非適応・再発難治例において,サリドマイド等の新規薬剤の有効性が報告されており3),移植適応例においても寛解導入療法としてサリドマイド+デキサメサゾン療法の有効性が報告されている4)。サリドマイドは100 mg/日から開始し,効果・副作用により投与量を調節する。サリドマイド不応例については,デキサメサゾン併用レナリドミド,ボルテゾミブによる治療を考慮する。レナリドミドについては,幹細胞採取効率を低下させないように,3~4コースの短期間の治療にとどめなければならない。現時点では,これらの新規薬剤はPOEMS症候群に対し国内保険適用外である。
参考文献
1) Dispenzieri A, et al. Peripheral blood stem cell transplant for POEMS syndrome is associated with high rates of engraftment syndrome. Eur J Haematol. 2008 ; 80 (5) : 397-406. (3iiDiv)
2) Misawa S, et al. Vascular endothelial growth factor as a predictive marker for POEMS syndrome treatment response : retrospective cohort study. BMJ Open. 2015 ; 5 (11) : e009157. (3iiDiv)
3) Kuwabara S, et al. Thalidomide reduces serum VEGF levels and improves peripheral neuropathy in POEMS syndrome. J Neurol Neurosurg Psychiatry. 2008 ; 79 (11) : 1255-7. (3iiDiv)
4) Nakaseko C. Autologous stem cell transplantation for POEMS syndrome. Clin Lymphoma Myeloma Leuk. 2014 ; 14 (1) : 21-3. (3iiA)

