第Ⅲ章 骨髄腫
2 多発性骨髄腫の類縁疾患
(2)ALアミロイドーシス
総論
ALアミロイドーシスは,異常形質細胞より産生されるモノクローナルな免疫グロブリン(M蛋白)の軽鎖(L鎖)に由来するアミロイド蛋白が全身諸臓器に沈着し,臓器障害をきたす疾患である。免疫グロブリン重鎖(H鎖)に由来するものはAHアミロイドーシスと呼ばれ,両者をあわせて免疫グロブリン性アミロイドーシスと呼ぶ。多発性骨髄腫や原発性マクログロブリン血症など基礎疾患を伴わない場合を原発性,基礎疾患に伴う場合を二次性ALアミロイドーシスと呼ぶ。しかし,実際には両者の鑑別困難な症例がみられ,WHO分類(2017)では両者をまとめて原発性アミロイドーシスとしている1)。また,病変の広がりによって全身性と限局性とに大別される。本疾患は稀な疾患であり,2014年に実施された全国疫学調査では,2012~2014年のALアミロイドーシス推定患者数は3,200例であった2)。アミロイド蛋白の沈着は心臓,腎臓,肝臓,消化管,末梢神経など多臓器にわたり,多彩な臨床症状を呈する。確定診断は病理学的所見に基づき,Congo red染色で橙赤色に染まり,偏光顕微鏡下で緑色の複屈折を示すことが必須である。さらに抗免疫グロブリン軽鎖抗体を用いた免疫染色でアミロイドの病型を確定する。病型診断が困難な場合は,アミロイド沈着部位をレーザーマイクロダイセクションで採取し,質量解析を行う。M蛋白の検出には血清・尿の蛋白電気泳動,免疫電気泳動のほか,遊離軽鎖(free light chain:FLC)の測定は感度が高く有用である。本症の予後は不良であり,無治療例での診断からの50%生存期間はおよそ13カ月,特に心病変を有する症例は予後不良である。治療目標はアミロイド蛋白の原因となっているモノクローナルなFLCの産生を速やかに抑制し,臓器機能を温存することにある。自家末梢血幹細胞移植は臓器障害のため治療関連死亡が高いので適応を慎重に検討し,リスクに応じた前処置の減量を考慮し実施することが重要である3-5)。
参考文献
1) Mckenna RW, et al. Plasma cell neoplasms. Swerdlow SH, et al, eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, IARC; 2017: pp254-5.(テキストブック)
2) 安東由喜雄.アミロイドーシスに関する調査研究 厚生労働科学研究補助金 難治性疾患政策研究事業 アミロイドーシスに関する調査研究 平成27 年度総括研究報告書.pp1-23, 2016.
3) Jaccard A, et al. High-dose melphalan versus melphalan plus dexamethasone for AL amyloidosis. N Engl J Med. 2007; 357(11): 1083-93.(1iiA)
4) Comenzo R, et al. Autologous stem cell transplantation for primary systemic amyloidosis. Blood. 2002; 99(12): 4276-82.
5) Skinner M, et al. High-dose melphalan and autologous stem cell transplantation in the patients with AL amyloidosis: An 8-year study. Ann Intern Med. 2004; 140(2): 85-93.(3iiiA)
アルゴリズム
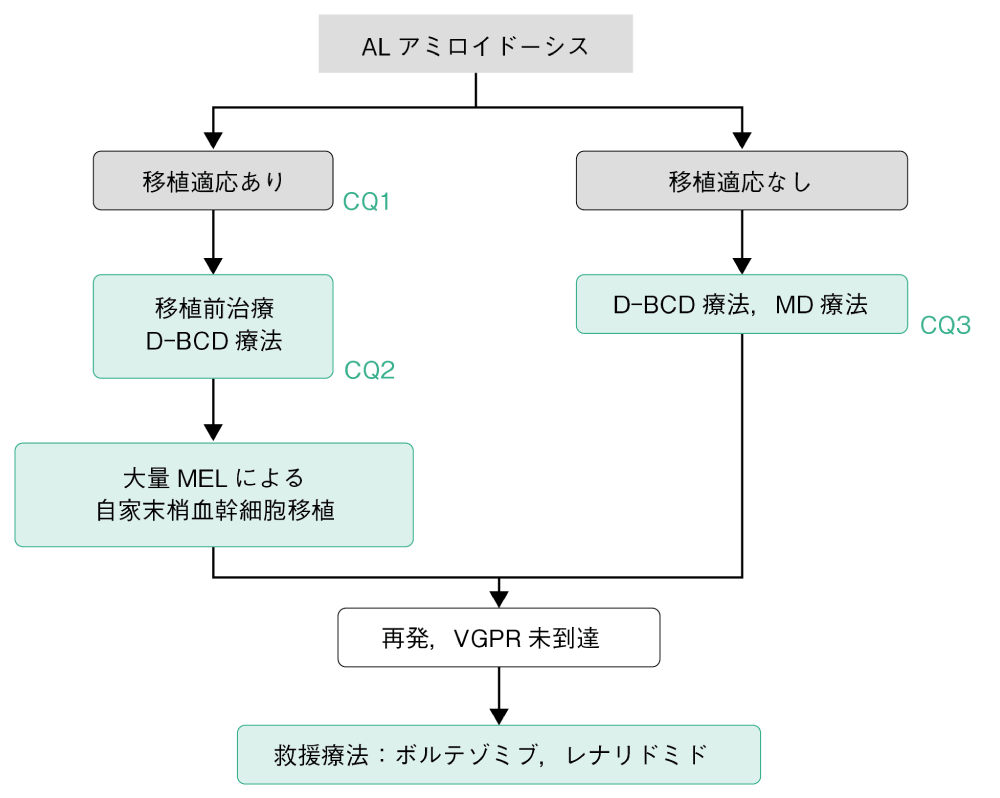
まず,自家移植の適応があるか否かを慎重に検討する(AL:CQ1,エビデンスレベル2B)。自家移植の適応があればリスクに応じてメルファラン(MEL)の減量も考慮して実施する。自家移植前にはD-BCD療法(DARA,BOR,CPA,DEX)による寛解導入療法を実施する(AL:CQ2,エビデンスレベル2B)。移植適応のない場合は,標準治療としてD-BCD療法が推奨される(AL:CQ3,エビデンスレベル1)。その他の治療としてはMD療法(MEL,DEX)が推奨される。再発時あるいはVGPR未到達時はボルテゾミブ(BOR),レナリドミド(LEN)などの新規薬剤を検討する。
CQ1 ALアミロイドーシスに対する自家造血幹細胞移植の適応基準は何か
- 推奨グレード
- カテゴリー2B
トロポニンT < 0.06ng/mL,収縮期血圧 > 90mmHg,腎機能(eGFR > 50mL/min/1.73m2),年齢(<70歳)やPS(≦2)などを基準に適応患者を選択する必要がある。
解説
移植適応症例の選択基準を厳格化することで自家造血幹細胞移植の治療関連死亡(treatment related mortality:TRM)が10.5%から1.1%まで低下したことが報告されている1)。Mayoクリニックからの報告ではトロポニンT ≧ 0.06ng/mLをカットオフ値とした場合,高値群では100日以内の死亡率が28%であったのに対し低値群では7%であり,トロポニンT高値の症例は移植適応とすべきではない2)。収縮期血圧 ≦ 90mmHgの低血圧とPS > 2の症例はTRMが高いと報告されており移植すべきではない3)。また,腎機能障害を有する症例では,30日以内に透析が必要となるリスクが高いことが報告されており,移植適応を慎重に検討する必要がある4,5)。
参考文献
1) Gertz MA, et al. Refinement in patient selection to reduce treatment-related mortality from autologous stem cell transplantation in amyloidosis. Bone Marrow Transplant. 2013; 48(4): 557-61.(3iiiA)
2) Gertz MA, et al. Troponin T level as an exclusion criterion for stem cell transplantation in light-chain amyloidosis. Leuk Lymphoma. 2008; 49(1): 36-41.(3iiiB)
3) Mollee PN, et al. Autologous stem cell transplantation in primary systemic amyloidosis: the impact of selection criteria on outcome. Bone Marrow Transplant. 2004; 33(3): 271-7.(3iiiB)
4) Leung N, et al. The impact of dialysis on the survival of patients with immunoglobulin light chain(AL)amyloidosis undergoing autologous stem cell transplantation. Nephrol Dial Transplant. 2016; 31(8): 1284-9.(3iiiB)
5) Palladini G, et al. Management of AL amyloidosis in 2020. Blood. 2020; 136(23): 2620-7.(レビュー)
CQ2 移植適応のALアミロイドーシスに対してどのような移植前治療が勧められるか
- 推奨グレード
- カテゴリー2B
移植適応症例には全例に自家移植前寛解導入療法が推奨される。現状ではD-BCD療法による寛解導入療法が推奨される。
解説
有効な治療法が開発された現状では,自家移植後の奏効を深めるためにもすべての症例で寛解導入療法が推奨される。BD療法(BOR,DEX)による寛解導入療法後に自家移植を行う群と自家移植のみの群とを比較した小規模単施設のランダム化比較試験では,1年血液学的奏効(86% vs. 54%),CR率(68% vs. 36%)で寛解導入療法群が優れた結果であった。さらに2年OS(95% vs. 69%),2年PFS(81% vs. 51%)で寛解導入療法群が優れていた1)。50例の移植適応症例で自家移植前のBD療法による寛解導入療法の効果を検討した第Ⅱ相試験では,治療関連毒性による脱落が多かった(30%)2)。これは経験の少ない施設が含まれていたことと,週2回ボルテゾミブ(BOR)が投与されたことが影響したものと思われる。D-BCD療法(DARA,BOR,CPA,DEX)はANDROMEDA試験で高い有効性と許容される毒性が示され,移植前の寛解導入療法に適していると思われる3)。ダラツムマブ(DARA)が投与できない場合はBCD療法(BOR,CPA,DEX)が推奨される。週2回のBOR投与は毒性が強いため推奨されない2)。
参考文献
1) Huang X, et al. Induction therapy with bortezomib and dexamethasone followed by autologous stem cell transplantation versus autologous stem cell transplantation alone in the treatment of renal AL amyloidosis: a randomized controlled trial. BMC Med. 2014; 12: 2.(1iiA)
2) Minnema MC, et al. Bortezomib-based induction followed by stem cell transplantation in light chain amyloidosis: results of the multicenter HOVON 104 trial. Haematologica. 2019; 104(11): 2274-82.(3iiiD)
3) Kastritis E, et al. Daratumumab-based treatment for immunoglobulin light-chain amyloidosis. N Engl J Med. 2021; 385(1): 46-58.(1iiDiv)
CQ3 移植適応のないALアミロイドーシスに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
移植非適応症例にはD-BCD療法が推奨される。
解説
D-BCD療法(DARA,BOR,CPA,DEX)はANDROMEDA試験で高い有効性と許容される毒性が示され,移植前の寛解導入療法に適していると思われる1)。ANDROMEDA試験ではStageⅢBを除く388例の未治療ALアミロイドーシスがD-BCD群とBCD群にランダムに割り付けられた。血液学的奏効率(HR)・CR率ともにD-BCD群で有意に良好であった(HR 92% vs. 77%,CR 53% vs. 18%)。6カ月時点の心と腎の臓器奏効率もD-BCD群が良好であった(心42% vs. 22%,腎54% vs. 27%)。有害事象に大きな差はみられなかったが,肺炎はD-BCD群で8%,BCD群で4%であった。この結果から,本邦でも2021年8月,ダラツムマブ(DARA)皮下注とボルテゾミブ(BOR)が,シクロホスファミド(CPA)+デキサメタゾン(DEX)との併用療法,D-BCD療法として全身性ALアミロイドーシスに対する承認を取得した。移植非適応のALアミロイドーシスに対する治療としてはD-BCD療法が推奨される。
その他の治療としては,MD療法(MEL,DEX)が96例を対象とした試験で67%にPR以上のHRがみられ,効果発現は4.5カ月と早く,臓器効果も48%にみられている2)。MD療法は忍容性が高く,その後の長期観察結果では平均OS 5.1年,PFS 3.8年であった3)。MD療法と自家移植とのランダム化比較試験でもその有用性が確認されている4)。
参考文献
1) Kastritis E, et al. Daratumumab-based treatment for immunoglobulin light-chain amyloidosis. N Engl J Med. 2021; 385(1): 46-58.(1iiDiv)
2) Palladini G, et al. Association of melphalan and high-dose dexamethasone is effective and well tolerated in patients with AL(primary)amyloidosis who are ineligible for stem cell transplantation. Blood. 2004; 103(8): 2936-8.(3iiiDiv)
3) Palladini G, et al. Treatment with oral melphalan plus dexamethasone produce long-term remission in AL amyloidosis. Blood. 2007; 110(2): 787-8.(3iiiDiv)
4) Jaccard A, et al. High-dose melphalan versus melphalan plus dexamethasone for AL amyloidosis. N Engl J Med. 2007; 357(11): 1083-93.(1iiA)

