第Ⅱ章 リンパ腫
Ⅱ リンパ腫
8 節外性NK/T細胞リンパ腫,鼻型
(extranodal NK/T-cell lymphoma, nasal type:ENKL)
総論
WHO分類(2017)ではNK細胞腫瘍として,節外性NK/T細胞リンパ腫,鼻型(extranodal NK/T-cell lymphoma,nasal type:ENKL),急速進行性NK細胞白血病(aggressive NK-cell leukemia:ANKL),慢性NK細胞リンパ増殖異常症(chronic lymphoproliferative disorders of NK cells:CLPD-NK)の3病型が記載されている1)。いずれも稀少病型であり,ANKLの頻度はENKLの7分の1以下であるため2),治療法に関するエビデンスは乏しい。このため本項ではENKLについてのみ取り扱う。
ENKLのほとんどはNK細胞由来であり,鼻腔およびその周辺(以下本項では鼻腔周辺)原発例においてT細胞由来のリンパ腫が少数存在するとされている。パラフィン材料を用いた現在の病理組織学的手法ではNK細胞型とT細胞型の鑑別ができないため,NK/Tとの用語が採用されている。NK細胞型とT細胞型の識別はフローサイトメトリーあるいはT細胞受容体再構成の遺伝子解析で可能となっており,鼻腔周辺以外の原発例およびANKLでは十分な検体が採取可能であるため識別できることが多い。鼻腔周辺原発例ではCD56発現に加えてEBウイルスの存在や細胞傷害性分子(TIA,Granzymeなど)の存在で他のPTCLとの鑑別を行っているのが現状である。
病期分類には,他の悪性リンパ腫と同様にLugano分類が用いられる。近年,アントラサイクリン非含有化学療法レジメンおよび治癒指向性放射線治療を受けた症例において樹立された予後予測モデルが提唱されている(PINK,PINK-E)3)。
PINK 4つの因子(年齢>60歳,Stage Ⅲ期またはⅣ期,遠隔リンパ節病変あり*,鼻腔外原発)
*鼻型の場合に腋窩リンパ節,鎖骨下リンパ節,縦隔リンパ節病変を有する。
PINKは予後因子の数によって以下の3つのリスクグループに分類する。
予後因子数0:低リスク
予後因子数1:中間リスク
予後因子数2~4:高リスク
PINK-E PINKの4つの因子(年齢>60歳,Stage Ⅲ期またはⅣ期,遠隔リンパ節病変あり,鼻腔外原発)に加えて,検出可能なEBV-DNAにつき各1点で計算する。
予後因子数0~1:低リスク
予後因子数2:中間リスク
予後因子数3~5:高リスク
臨床病期は治療法の選択に重要である。治療効果の判定に際しては,特に鼻腔周辺は解剖学的に複雑であること,腫瘍が消失しても粘膜肥厚などの非腫瘍組織の残存があり得ること,ENKLではpositron emission tomography(PET)検査において高率に18fluoro-2-deoxyglucose(FDG)の取り込みが認められることから4),FDG-PET/CTが有用である。
参考文献
1) Chan JKC, et al. Extranodal NK/T-cell lymphoma, nasal type. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, IARC; 2017: pp368-71.
2) Suzuki R, et al. Prognostic factors for mature natural killer(NK)-cell neoplasms: aggressive NK-cell leukemia and extranodal NK-cell lymphoma, nasal-type. Ann Oncol. 2010; 21(5): 1032-40.(3iiA)
3) Kim SJ, et al. A prognostic index for natural killer cell lymphoma after non-anthracycline-based treatment: a multicentre, retrospective analysis. Lancet Oncol. 2016; 17(3): 389-400.(3iiA)
4) Kako S, et al. FDG-PET in T-cell and NK-cell neoplasms. Ann Oncol. 2007; 18(10): 1685-90.
アルゴリズム
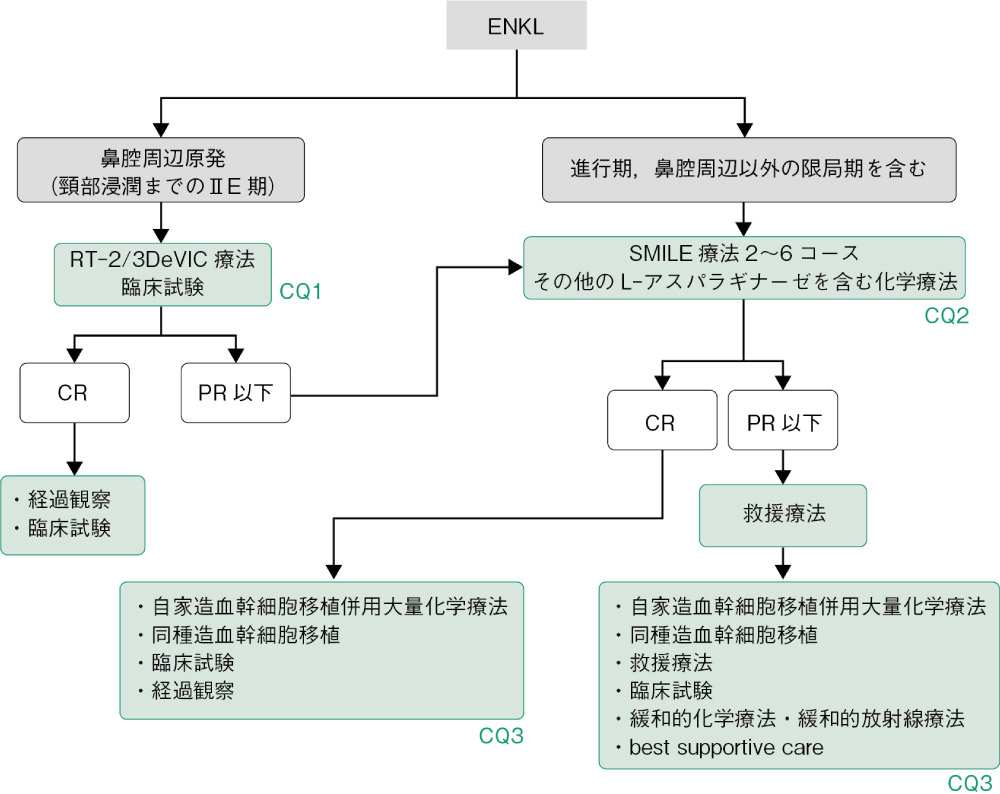
ENKLでは約7割の患者が鼻腔あるいはその周辺組織を中心とする限局期病変を有する。鼻腔周辺原発例で病変が頸部リンパ節までにとどまっている患者では,わが国で実施された第Ⅰ/Ⅱ相試験の結果から同時化学放射線療法であるRT-2/3DeVIC療法(DEX,ETP,IFM,CBDCA)を行うことが推奨され,また臨床試験への参加も勧められる(CQ1)。RT-2/3DeVIC療法で完全奏効(CR)を得た場合,地固め療法としての自家造血幹細胞移植併用大量化学療法(high-dose chemotherapy with autologous hematopoietic stem cell transplantation:HDC/AHSCT)を行うことは推奨されない。
鼻腔周辺原発で病変が腋窩リンパ節や縦隔病変など頸部リンパ節を超えて広がっている場合,鼻腔など上気道以外での発生例,初回治療後再発または部分奏効(PR)以下のENKLに対しては,第Ⅱ相試験の結果からSMILE療法(DEX,MTX,IFM,L-Asp,ETP)を行うことが推奨される(CQ2)。
初発進行期ENKLの全例および初回再発/治療抵抗性ENKLで救援療法後CR例では,エビデンスレベルは低いものの,移植後長期奏効を得ている患者が存在することから,年齢や全身状態などの問題がなければ,自家または同種移植が推奨される(CQ3)。救援療法によるPR以下のENKLの予後は不良であり,年齢や全身状態などの問題がなければ,自家または同種造血幹細胞移植が推奨される。
CQ1 初発鼻腔周辺限局期(頸部リンパ節浸潤までのⅡE期)ENKLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
同時化学放射線療法であるRT-2/3DeVIC療法が最も推奨される。ただし最良の治療法についてはコンセンサスがなく,臨床試験への参加も推奨される。
解説
ENKL患者の約7割が鼻腔あるいはその周辺組織を中心とする限局期病変を有する。ENKLではP糖蛋白関連薬を主体とするCHOP療法(CPA,DXR,VCR,PSL)の有効性が低く,この理由として正常NK細胞が多剤耐性(multi-drug resistance:MDR)に関与するP糖蛋白を発現していることが関連していると考えられている。一方で,病変部放射線治療単独により比較的良好なCR割合(65%)が得られることが早くから知られており1),放射線治療とMDR非関連薬を中心とする化学療法の併用療法が検討されてきた。多数例での後方視的解析において,アントラサイクリン含有化学療法に対するアントラサイクリン非含有化学療法の有効性と放射線療法併用の有効性が示されている2)。
稀少疾患であり,ランダム化比較試験により確立された標準治療はない。国内では,鼻腔周辺原発で病変が頸部リンパ節までの限局期ENKLを対象とし,同時化学放射線療法であるRT-2/3DeVIC療法(DEX,ETP,IFM,CBDCA)の第Ⅰ/Ⅱ相試験(JCOG0211-DI)が行われ3),OSが放射線治療単独の治療成績を上回り4),日常診療でも臨床試験と同様の効果および毒性であることが確認された5)。RT-2/3DeVIC療法のほかに臨床試験で開発されたものとしては,韓国の研究グループによるCCRT(RT,CDDP)-VIDL(ETP,IFM,DEX,L-Asp)療法6)などがある。RT-2/3DeVIC療法と比較して,CCRT-VIDL療法は治療期間が長いものの,放射線療法の線量は40Gyと低く抑えられている。最良の治療についてはコンセンサスがないものの,本邦において日常診療での安全性と有効性が確認されていることから5),RT-2/3DeVIC療法が最も推奨される。ただし,治療法の優劣は不明であり,臨床試験への参加も推奨される。臓器機能が保たれていないなど化学療法の同時併用もしくは追加を行えない場合は,放射線治療単独もオプションの一つとなり得る。
鼻腔周辺原発で病変が鎖骨下リンパ節など頸部リンパ節領域を超えて認められる場合は,放射線治療による有害反応が懸念されることに加え,限局期に対する治療では予後不良であることから5),進行期に準じて化学療法を行う。
初発鼻腔周辺限局期ENKLにおいて,初回治療後CRにおける地固め療法としてのHDC/AHSCTの有用性について,十分なサンプルサイズで評価した研究は少ない7,8)。さらに,MDR克服を意図した化学療法,あるいはそれらの併用による同時化学放射線療法を受けた患者を対象とした同様の研究はほとんどない。JCOG0211-DI試験では,治療後CR例ではHDC/AHSCTなどの後治療を行わず経過観察とされていた。また,国内31施設で日常診療としてRT-2/3DeVIC療法を受けたENKL患者150例の後方視的研究では,初回治療後CRでHDC/AHSCTを受けたのはわずか2例であり,そのうち1例で照射体積内の二次がん発生を認めた5)。5年OSはJCOG0211-DI試験で70%,後方視的研究で72%と良好であった。
以上より,RT-2/3DeVIC療法でCRとなれば,地固め療法としてのHDC/AHSCTを行わずに経過観察することが推奨される。米国造血細胞移植学会(ASBMT)の推奨ガイドでは,初回CR後HDC/AHSCTは実施すべきでないとされている9)。
参考文献
1) Kim GE, et al. Angiocentric lymphoma of the head and neck: patterns of systemic failure after radiation treatment. J Clin Oncol. 2000; 18(1): 54-63.(3iiA)
2) Qi SN et al. First-line non-antracycline-based chemotherapy for extranodal nasal-type NK/T-cell lymphoma: a retrospective analysis from the CLCG. Blood Adv. 2020; 4(13): 3141-53.
3) Yamaguchi M, et al. Phase I/II study of concurrent chemoradiotherapy for localized nasal natural killer/T-cell lymphoma: Japan Clinical Oncology Group Study JCOG0211. J Clin Oncol. 2009; 27(33): 5594-600.(3iiiA)
4) Yamaguchi M, et al. Concurrent chemoradiotherapy for localized nasal natural killer/T-cell lymphoma: an updated analysis of the Japan Clinical Oncology Group Study JCOG0211. J Clin Oncol. 2012; 30(32): 4044-6.(Correspondence)(3iiiA)
5) Yamaguchi M, et al. Treatments and Outcomes of Patients With Extranodal Natural Killer/T-Cell Lymphoma Diagnosed Between 2000 and 2013 : A Cooperative Study in Japan. J Clin Oncol. 2017; 35(1): 32-9.(3iiA)
6) Kim SJ, et al. Concurrent chemoradiotherapy followed by L-asparaginase-containing chemotherapy, VIDL, for localized nasal extranodal NK/T cell lymphoma: CISL08-01 phase II study. Ann Hematol. 2014; 93(11): 1895-901.(3iiiDiv)
7) Kim HJ, et al. High-dose chemotherapy with autologous stem cell transplantation in extranodal NK/T-cell lymphoma: a retrospective comparison with non-transplantation cases. Bone Marrow Transplant. 2006; 37(9): 819-24.(3iiA)
8) Lee J, et al. Autologous hematopoietic stem cell transplantation in extranodal natural killer/T cell lymphoma: a multinational, multicenter, matched controlled study. Biol Blood Marrow Transplant. 2008; 14(12): 1356-64.(3iiA)
9) Kharfan-Dabaja MA, at al. Clinical Practice Recommendations on Indication and Timing of Hematopoietic Cell Transplantation in Mature T-cell and NK/T-Cell Lymphomas: An International Collaborative Effort on Behalf of the Guidelines Committee of the American Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2017; 23(11): 1826-38.(ガイドライン)
CQ2 鼻腔周辺以外の限局期,初発進行期および初回再発/治療抵抗性ENKLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
多剤併用化学療法であるSMILE療法が最も推奨される。
解説
初発ENKLでは,約25%が骨髄浸潤などの全身播種を示し,アントラサイクリンを含む化学療法が行われていた時代のCR割合は15%,50%生存期間は4カ月と極めて予後不良であった1)。多剤耐性(MDR)に関与するP糖蛋白の影響を受けない薬剤を主体とするSMILE療法(DEX,MTX,IFM,L-Asp,ETP)がわが国を中心として東アジアで開発され,年齢15~69歳,PS 0~2の初発Ⅳ期,初回治療後再発/治療抵抗性ENKLを対象として第Ⅱ相試験が行われ,既存の治療成績と比較して優れたCR割合,1年OSを示した2)。本試験は初期に感染症死が2例発生し,その後リンパ球数500個/μL以上を適格基準としたことには留意すべきである。
NCCNガイドラインでは初発例に対してペグアスパルガーゼを用いたSMILE療法変法を挙げている。本邦でも2023年6月にペグアスパルガーゼが悪性リンパ腫を適応症に含めて承認されたが,併用レジメンとしての至適化のエビデンスに乏しい。また,初発例に対してオキサリプラチンを含むレジメン,再発難治例に対しては望ましいレジメンとしてペムブロリズマブとニボルマブを挙げているが,本邦では使用できない。
GELA/GOELAMSによる初回再発/治療抵抗性ENKLを対象としたAspaMetDex療法(L-Asp,MTX,DEX)の第Ⅱ相試験の結果が報告されているが,対象19例中12例が限局期例であり,17例は初回治療にCHOPまたはCHOP類似療法を受けていた3)。日本の初回標準治療を受けていた場合に,予後良好な患者が含まれている可能性がある。初発進行期例に対するAspaMet-Dex療法の第Ⅱ相試験も実施されたが,測定した全例で抗アスパラギナーゼ抗体が生じ,全奏効割合は58%にとどまった4)。このため,いずれの状態でも,現時点ではSMILE療法が最も推奨される。
参考文献
1) Suzuki R, et al. Prognostic factors for mature natural killer(NK)-cell neoplasms: aggressive NK-cell leukemia and extranodal NK-cell lymphoma, nasal-type. Ann Oncol. 2010; 21(5): 1032-40.(3iiA)
2) Yamaguchi M, et al. Phase II study of SMILE chemotherapy for newly diagnosed stage IV, relapsed, or refractory extranodal natural killer(NK)/T-cell lymphoma, nasal type: the NK-Cell Tumor Study Group study. J Clin Oncol. 2011; 29(33): 4410-6.(3iiiDiv)
3) Jaccard A, et al. Efficacy of L-asparaginase with methotrexate and dexamethasone (AspaMetDex regimen)in patients with refractory or relapsing extranodal NK/T-cell lymphoma, a phase 2 study. Blood. 2011; 117(6): 1834-9.(3iiiDiv)
4) Jaccard A, et al. A prospective phase II trial of an L-asparaginase containing regimen in extranodal NK/ T-cell lymphoma. Hematol Oncol. 2013; 31(Supple. S1): 129,[Abstract #099].(3iiiDiv)
CQ3 初発進行期ENKLおよび初回再発/治療抵抗性ENKLに対する救援療法による寛解導入後,地固め療法として造血幹細胞移植は勧められるか
- 推奨グレード
- カテゴリー2B
年齢や全身状態などの問題がなければ,自家または同種造血幹細胞移植が推奨される。
解説
予後不良とされてきた初回進行期および初回再発/治療抵抗性ENKLでは,これまで造血幹細胞移植療法なしに長期生存は困難であった。後方視的解析の結果ではあるが,自家移植1,2)もしくは同種移植3,4)を受けた一部患者で長期生存が報告されている。初発進行期ENKLを対象にVIDL療法(ETP,IFM,DEX,L-Asp)4コース後にupfrontの自家移植を併用した第Ⅱ相試験が報告され,27例中17例が自家移植を実施し,観察期間中央値31.2カ月において,PFS中央値は13.2カ月,OS中央値は27カ月,奏効期間中央値15.2カ月であった5)。なお,本試験では自家移植を実施した17例中4例で中枢神経再発をきたしている。近年レジストリ研究においてupfrontに自家移植が受けられた例での良好なPFSが報告された6)。
初発進行期ENKLおよび初回再発/治療抵抗性ENKLに対してSMILE療法(DEX,MTX,IFM,L-Asp,ETP)などL-アスパラギナーゼ(L-Asp)含有化学療法が行われている(CQ2)が,報告された臨床試験の成績は造血幹細胞移植が実施された患者を多く含むものである(2コースのSMILE療法完遂28例中19例に実施)4)。選択バイアスの可能性もあるが,サブグループ解析では自家または同種移植を受けた患者の方がOSは良好であった。化学療法のみで長期生存ないし奏効持続が得られるというデータはなく,現時点ではエビデンスレベルとしては低いが,患者の年齢や全身状態が問題なければ,自家または同種移植の実施が推奨される。
移植の種類に関しても選択バイアスの可能性はあるが,自家移植の成績は同種移植と同等かそれ以上であり2,7,8),CRで遂行可能な患者には自家移植実施の妥当性が示唆される。特に適切な同種骨髄・末梢血ドナーが存在しない場合,ドナー検索に時間をかけるより,CRでの自家移植の実施が推奨される。米国造血細胞移植学会(ASBMT)の推奨ガイドでは,自家移植はstrong recommendation,同種移植はweak recommendationとされているが,これを支持するエビデンスはない9)。
参考文献
1) Fox CP, et al. High-dose therapy and autologous stem cell transplantation for extra-nodal NK/T lymphoma in patients from the Western hemisphere: a study from the European Society for Blood and Marrow Transplantation. Leuk Lymphoma. 2015; 56(12): 3295-300.(3iiiA)
2) Yhim HY, et al. Clinical Outcomes and Prognostic Factors of Up-Front Autologous Stem Cell Transplantation in Patients with Extranodal Natural Killer/T Cell Lymphoma. Biol Blood Marrow Transplant. 2015; 21(9): 1597-604.(3iiiA)
3) Murashige N, et al. Allogeneic haematopoietic stem cell transplantation as a promising treatment for natural killer-cell neoplasms. Br J Haematol. 2005; 130(4): 561-7.(3iiiA)
4) Yamaguchi M, et al. Phase II study of SMILE chemotherapy for newly-diagnosed stage IV, relapsed or refractory extranodal natural killer(NK)/T-cell lymphoma, nasal type: the NK-Cell Tumor Study Group study. J Clin Oncol. 2011; 29(33): 4410-6.(3iiiDiv)
5) Song GY, et al. Open-label, single arm, multicenter phase II study of VIDL induction chemotherapy followed by upfront autologous stem cell transplantation in patients with advanced stage extranodal NK/T-cell lymphoma. Bone Marrow Transplant. 2021; 56(5): 1205-8.(3iiiDiv)
6) Yoon SE, et al. Comprehensive analysis of peripheral T-cell and natural killer/T-cell lymphoma in Asian patients: A multinational, multicenter, prospective registry study in Asia. Lancet Reg Health-West Pac. 2021; 10: 100126.(3iiiDiv)
7) Lee J, et al. Autologous hematopoietic stem cell transplantation in extranodal natural killer/T-cell lymphoma: a multinational, multicenter, matched controlled study. Biol Blood Marrow Transplant. 2008; 14(12): 1356-64.(3iiA)
8) Suzuki R, et al. Hematopoietic stem cell transplantation for extranodal NK/T-cell lymphoma, nasal-type: The Japan Society for Hematopoietic Cell Transplantation(JSHCT)Lymphoma Working Party. Ann Oncol. 2011; 22(Suppl. 4): iv95.(3iiA)
9) Kharfan-Dabaja MA, et al. Clinical Practice Recommendations on Indication and Timing of Hematopoietic Cell Transplantation in Mature T-Cell and NK/T-Cell Lymphomas: An International Collaborative Effort on Behalf of the Guidelines Committee of the American Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2017; 23(11): 1826-38.(ガイドライン)

