第Ⅱ章 リンパ腫
Ⅱ リンパ腫
5 びまん性大細胞型B細胞リンパ腫
(diffuse large B-cell lymphoma, not otherwise specified:DLBCL,NOS)
総論
WHO分類(2017)におけるびまん性大細胞型B細胞リンパ腫(diffuse large B-cell lymphoma,not otherwise specified:DLBCL,NOS)は,本邦の全NHLのうち3割強を占める,もっとも発生頻度の高い病型である1,2)。DLBCLとしての初発例の他に,他の低悪性度B細胞リンパ腫から組織学的進展する例もあり,さまざまな病態を示す不均一な疾患群である。CD10,bcl-6,IRF4/MUM1を用いた免疫組織染色や遺伝子発現プロファイルにより,細胞起源に基づいて胚中心B細胞亜型(germinal centre B-cell subtype)と活性化B細胞亜型/非胚中心B細胞亜型(activated B-cell subtype/non-germinal centre B-cell subtype)に分類される3)が,それらに基づく治療の層別化で予後が改善する明確な根拠はなく,一般的には推奨されない4-6)。
本項では,DLBCL,NOSに加え,DLBCLの亜型(subtype)のうちT細胞/組織球豊富型大細胞型B細胞リンパ腫(T-cell/histiocyte-rich large B-cell lymphoma),原発性皮膚びまん性大細胞型B細胞リンパ腫・下肢型(primary cutaneous DLBCL,leg type),およびEBV陽性びまん性大細胞型B細胞リンパ腫・非定形型(EBV-positive DLBCL,NOS),さらに類縁の病型である原発性縦隔大細胞型B細胞リンパ腫(primary mediastinal large B-cell lymphoma),血管内大細胞型B細胞リンパ腫(intravascular large B-cell lymphoma),慢性炎症関連びまん性大細胞型B細胞リンパ腫(DLBCL associated with chronic inflammation),リンパ腫様肉芽腫症(lymphomatoid granulomatosis),ALK陽性大細胞型B細胞リンパ腫(ALK-positive large B-cell lymphoma)をまとめてDLBCLとして取り扱う。
病期分類にはAnn Arbor分類7),およびそれを基にしたLugano分類(2014)8)が,予後予測モデルとしては国際予後指標(International Prognostic Index:IPI)9)が広く用いられている。近年,北米のCancer centerのグループにより,リツキシマブ時代のDLBCLに対する予後指標としてNCCNのIPI10)が提唱されている。これは年齢,血清LDH値をより細分化したもので,これによりかつてのIPIを用いるよりも低リスクと高リスクをより正確に区別することができるとされている。治療の効果判定には,FDG-PET/CTの結果に基づいたLugano分類(2014)8)が,広く用いられている。
参考文献
1)Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, IARC; 2017.(ガイドライン)
2)The world health organization classification of malignant lymphomas in japan: incidence of recently recognized entities. Lymphoma Study Group of Japanese Pathologists. Pathol Int. 2000; 50(9): 696-702.
3)Hans CP, et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. Blood. 2004; 103(1): 275-82.
4)Davies A, et al. Gene-expression profiling of bortezomib added to standard chemoimmunotherapy for diffuse large B-cell lymphoma(REMoDL-B): an open-label, randomised, phase 3 trial. Lancet Oncol. 2019; 20(5): 649-62.(1iiDiii)
5)Younes A, et al. Randomized Phase III Trial of Ibrutinib and Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone in Non-Germinal Center B-Cell Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2019; 37(15): 1285-95.(1iiDi)
6)Nowakowski GS, et al. ROBUST: A Phase III Study of Lenalidomide Plus R-CHOP Versus Placebo Plus R-CHOP in Previously Untreated Patients With ABC-Type Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2021; 39(12): 1317-28.(1iiDiii)
7)Carbone PP, et al. Report of the Committee on Hodgkin’s Disease Staging Classification. Cancer Res. 1971; 31(11): 1860-1.
8)Cheson BD, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol. 2014; 32(27): 3059-68.(レビュー)
9)International Non-Hodgkin’s Lymphoma Prognostic Factors Project. A predictive model for aggressive non-Hodgkin’s lymphoma. N Engl J Med. 1993; 329(14): 987-94.(3iA)
10)Zhou Z, et al. An enhanced International Prognostic Index(NCCN-IPI)for patients with diffuse large B-cell lymphoma treated in the rituximab era. Blood. 2014; 123(6): 837-42.(3iA)
アルゴリズム
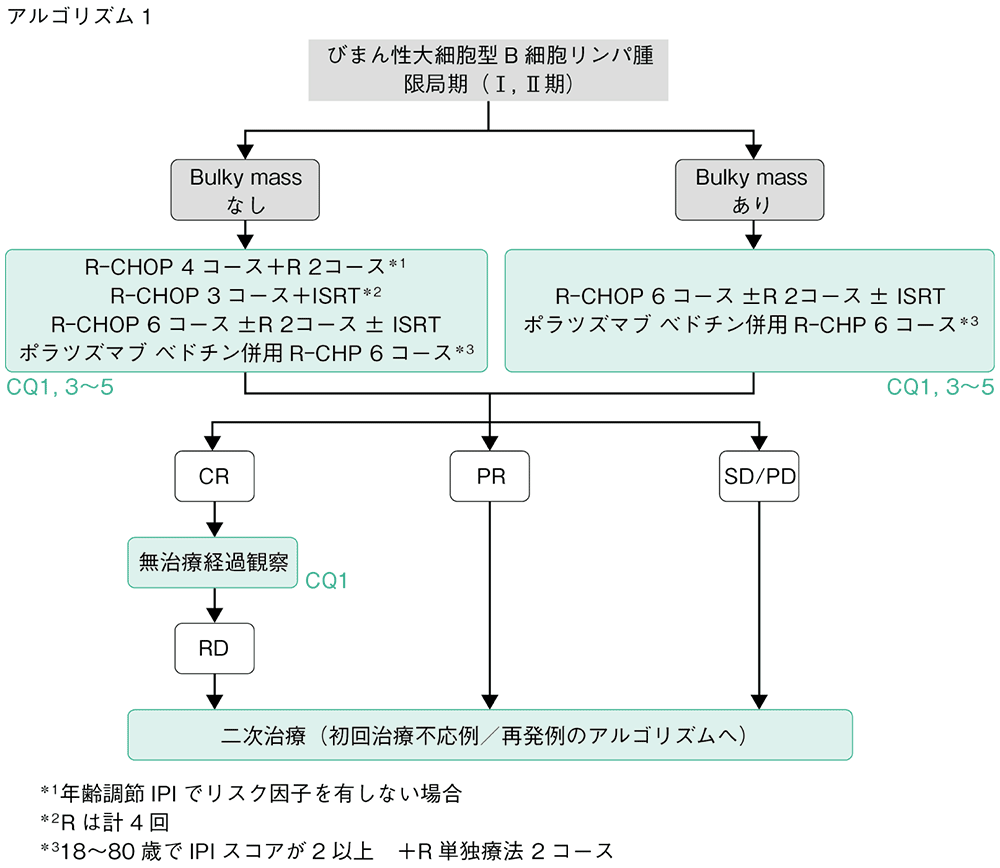
アルゴリズム1
DLBCL治療における限局期は,限局期における放射線治療を考慮する際にinvolved-field radiotherapy(IFRT)として1照射野で治療可能である連続性Ⅱ期を対象としていたことから,Ann Arbor分類での臨床病期Ⅰ期および連続性Ⅱ期に該当する。
大規模なランダム化比較試験の結果により,限局期DLBCLに対する標準治療はCHOP療法(CPA,DXR,VCR,PSL)3コースに引き続いてIFRTを行うcombined modality therapy(CMT)であった1)。なお,bulky massを有する例はCHOP療法3コースとIFRTとのCMTは推奨されない。リツキシマブ(R)導入後は,最大腫瘍径が10cmを超える,または縦隔病変の最大横径が最大胸郭内径の1/3以上のbulky massを有しない限局期DLBCLに対してはR-CHOP療法3コースと局所照射(かつてはIFRTが行われていたが,画像診断や放射線療法技術の進歩によって標的体積と照射線量を適切に小さくできるようなり,現在はinvolved site radiation therapy:ISRTが推奨されている)のCMT,あるいはR-CHOP療法6コースが,bulky massを有する場合はR-CHOP療法6コースが推奨される2,3)。R-CHOP療法3コースとISRTのCMTと,R-CHOP療法6コースを使い分ける明確な指標はなく,6コースの化学療法の適否可能性を考慮して治療を選択する。また,最大径が7.5cmを超える腫瘤を有さず,かつ年齢調節IPIでリスク因子を有しない場合は,R-CHOP療法4コース後にRのみを2コース追加する治療も標準治療の一つとして推奨される4)(CQ1)。Bulky massの有無を問わず,18~80歳でIPIスコアが2以上の患者に対しては,ポラツズマブ ベドチン(Pola)併用 R-CHP療法6コース(+R単独療法2コース)も標準治療の一つとして推奨される5)。化学療法の適応が困難な場合は,ISRTを行う。
化学療法後の地固め療法としての放射線照射については,8コースのCHOP療法後に30GyのIFRTを行っても生存が改善しないという比較試験が報告されている6)。しかし,比較試験のサブグループ解析や大規模な後方視的解析では放射線照射が行われた例で生存が改善しており7,8),治療前に病変が存在していた部位,特にbulky massの場合には,化学療法後にISRT(初発時の領域またはそれ以下)を考慮してもよいと考えられる。
治療後にCRへ至った例では無治療で経過観察する。PRまでの効果しか得られなかった場合は救援化学療法を行う。
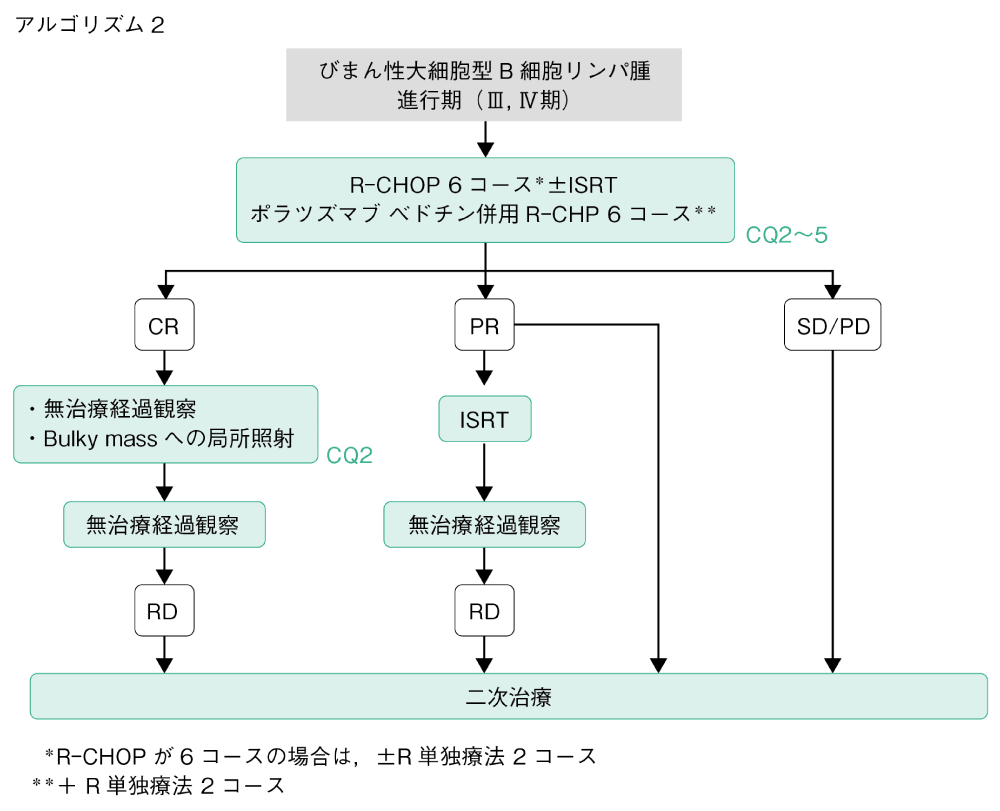
アルゴリズム2
CD20陽性の進行期DLBCLに対する化学療法は6~8コースのR-CHOP療法が標準治療であるが9),18~80歳でIPIスコアが2以上の患者に対しては,Pola併用R-CHP療法6コース(+R単独療法2コース)も標準治療の一つとして推奨される5)(CQ2~5)。標準的なR-CHOP療法のコース数は6~8コースであるが,6コースと8コースの差を前方視的に比較した臨床試験はないため,至適コース数について明確な根拠はない。年齢や合併症の有無など,化学療法の適否可能性を考慮してコース数を決定する。
R-CHOP療法後にCRとなった場合は,無治療経過観察とする10)。化学療法後に地固め療法として放射線照射を追加しても生存が改善する明確な根拠はないが11),治療前に7.5cm以上のbulky massを有していた高齢者では病変が存在していた部位への追加照射により予後が改善する可能性があるため6),化学療法後にISRTを考慮してもよい。若年者でIPIの高リスク群では自家造血幹細胞移植併用大量化学療法(high-dose chemotherapy with autologous hematopoietic stem cell transplantation:HDC/AHSCT)による地固め療法により予後が改善する可能性があるが12),一般診療として推奨できるだけのエビデンスは不十分であり,実施する場合は適切に計画された臨床試験のもとで行う必要がある。(CQ2)。
PRまでの効果しか得られず,残存病変が1標的体積に限局しており救援療法の実施が困難な場合は,局所照射を行う。
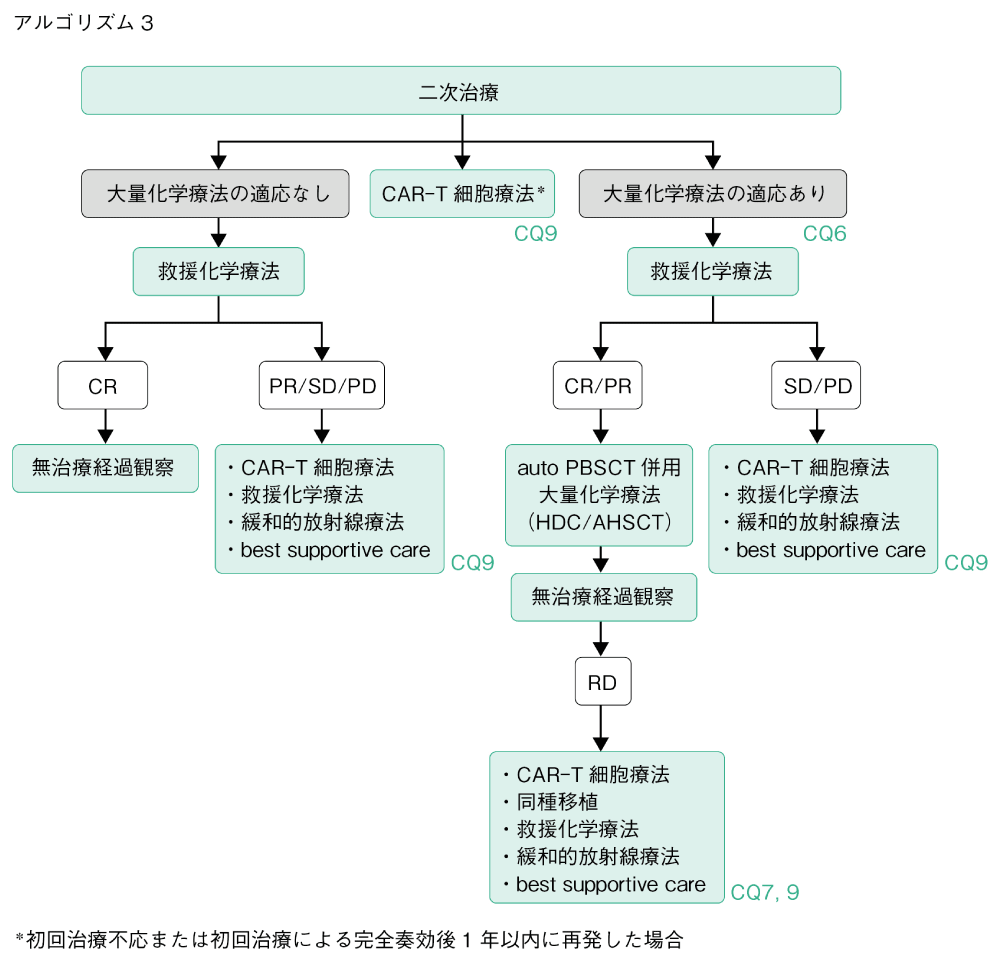
アルゴリズム3
再発・難治性DLBCLに対しては,救援療法により奏効(CR,PR)が得られ,年齢を含めた検討で適応があると判断される場合にはHDC/AHSCTを実施することが標準治療として推奨されるが13),初回治療不応または初回治療による完全奏効後1年以内に再発した患者に対してはアキシカブタゲン シロルユーセル(Axi-Cel)またはリソカブタゲン マラルユーセル(Liso-Cel)が,救援療法で奏効が得られない場合を含めたHDC/AHSCTの適応がない,またはHDC/AHSCT後に再発した患者に対しては,Axi-Cel,Liso-Celおよびチサゲンレクルユーセル(Tisa-Cel)のキメラ抗原受容体発現T細胞輸注療法(CAR-T細胞療法)が治療選択肢の一つとなる(CQ9)14,15)。
再発・難治性のDLBCLに対する救援化学療法の優劣は明らかではないため,レジメンは以下のいずれかが選択される。
救援化学療法
DHAP療法(DEX, CDDP, AraC)(+R)16,17)
(R-)ESHAP療法(mPSL, ETP, AraC, CDDP)18)
(R-)ICE療法(IFM, CBDCA, ETP)19)
CHASE(R)療法(CPA, AraC, DEX, ETP)20)
Dose adjusted(DA)-EPOCH(-R)療法(ETP, PSL, VCR, CPA, DXR)21)
MINE療法(MIT, IFM, メスナ,ETP)22)
GDP 療法(Gem, DEX, CDDP)23)
BR 療法(BEN,R)※24)
Pola 併用BR療法※25)
※HDC/AHSCTの適応がない場合
同種造血幹細胞移植はHDC/AHSCT後の再発・難治例に対して考え得る治療選択肢の一つであるが,治療関連死亡が多く,有用性を示すエビデンスが乏しいため,臨床試験での実施が推奨される(CQ7)。
2023年9月に抗CD20モノクローナル抗体製剤を含む少なくとも2つの標準的な治療が無効または治療後に再発したびまん性大細胞型B細胞リンパ腫(diffuse large B-cell lymphoma: DLBCL),高悪性度B細胞リンパ腫,原発性縦隔大細胞型B細胞リンパ腫,濾胞性リンパ腫 grade 3bに対し,二重特異性抗体薬エプコリタマブが承認された。DLBCLに関しては欧米で行われた第Ⅰ/Ⅱ相試験26)において,第Ⅱ相部分の用量拡大コホートで157人が治療を受け,追跡期間中央値10.7カ月で,全奏効割合が63.1%,完全奏効割合が38.9%で,50%奏効期間が12カ月(完全奏効例では未到達)で有害事象は管理可能であった27)。本邦で2つ以上の前治療歴を有する再発・難治性のCD20陽性B細胞リンパ腫の患者45人に対して第Ⅰ/Ⅱ相試験が行われ,海外の試験と同様の有効性と安全性が確認された28)。以上より,抗CD20モノクローナル抗体製剤を含む少なくとも2つの標準的な治療が無効または治療後に再発したDLBCL患者に対して,エプコリタマブ療法も推奨される(推奨グレード:カテゴリー2A)。
参考文献
1) Miller TP, et al. Chemotherapy alone compared with chemotherapy plus radiotherapy for localized intermediate-and high-grade non-Hodgkin’s lymphoma. N Engl J Med. 1998; 339(1): 21-6.(1iiDiii/1iiA)
2) Persky DO, et al. Phase II study of rituximab plus three cycles of CHOP and involved-field radiotherapy for patients with limited-stage aggressive B-cell lymphoma: Southwest Oncology Group study 0014. J Clin Oncol. 2008; 26(14): 2258-63.(3iiiDiii)
3) Pfreundschuh M, et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial(MInT)Group. Lancet Oncol. 2006; 7(5): 379-91.(1iiDi/1iiA)
4) Poeschel V, et al. Four versus six cycles of CHOP chemotherapy in combination with six applications of rituximab in patients with aggressive B-cell lymphoma with favourable prognosis(FLYER): a randomised, phase 3, non-inferiority trial. Lancet. 2019; 394(10216): 2271-81.(1iiDiii)
5) Tilly H, et al. Polatuzumab Vedotin in Previously Untreated Diffuse Large B-Cell Lymphoma. N Engl J Med 2022; 386(4): 351-63.(1iiDiii)
6) Horning SJ, et al. Chemotherapy with or without radiotherapy in limited-stage diffuse aggressive non-Hodgkin’s lymphoma: Eastern Cooperative Oncology Group study 1484. J Clin Oncol. 2004; 22(15): 3032-8.(1iiDii)
7) Held G, et al. Role of radiotherapy to bulky disease in elderly patients with aggressive B-cell lymphoma. J Clin Oncol. 2014; 32(11): 1112-8.(3iiiD)
8) Vargo JA, et al. Treatment Selection and Survival Outcomes in Early-Stage Diffuse Large B-Cell Lymphoma: Do We Still Need Consolidative Radiotherapy? J Clin Oncol. 2015; 33(32): 3710-7.(3iiiA)
9) Coiffier B, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. N Engl J Med. 2002; 346(4): 235-42.(1iiDi/1iiA)
10)Yuan T, et al. Maintenance therapy for untreated diffuse large B-cell lymphoma: a systematic review and network meta-analysis. Ther Adv Hematol. 2021; 12: 20406207211018894.(1iA)
11)Berger MD, et al. Impact on survival through consolidation radiotherapy for diffuse large B-cell lymphoma: a comprehensive meta-analysis. Haematologica. 2021; 106(7): 1923-31.(1iA)
12)Stiff PJ, et al. Autologous transplantation as consolidation for aggressive non-Hodgkin’s lymphoma. N Engl J Med. 2013; 369(18): 1681-90.(1iiDiii/1iiA)
13)Philip T, et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin’s lymphoma. N Engl J Med. 1995; 333(23): 1540-5.(1iiA)
14)Locke FL, et al. Axicabtagene Ciloleucel as Second-Line Therapy for Large B-Cell Lymphoma. N Engl J Med. 2022; 386(7): 640-54.(1iiDi)
15)Kamdar M, et al. Lisocabtagene maraleucel versus standard of care with salvage chemotherapy followed by autologous stem cell transplantation as second-line treatment in patients with relapsed or refractory large B-cell lymphoma(TRANSFORM): results from an interim analysis of an open-label, randomised, phase 3 trial. Lancet. 2022; 399(10343): 2294-308.(1iiDi)
16)Gisselbrecht C, et al. Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era. J Clin Oncol. 2010; 28(27): 4184-90.(1iiDi)
17)Mey UJ, et al. Dexamethasone, high-dose cytarabine, and cisplatin in combination with rituximab as salvae treatment for patients with relapsed or refractory aggressive non-Hodgkin’s lymphoma. Cancer Invest. 2006; 24(6): 593-600.(3iiiDiv)
18)Martín A, et al. R-ESHAP as salvage therapy for patients with relapsed or refractory diffuse large B-cell lymphoma: the influence of prior exposure to rituximab on outcome. A GEL/TAMO study. Haematologica. 2008; 93(12): 1829-36.(3iiiDiv)
19)Kewalramani T, et al. Rituximab and ICE as second-line therapy before autologous stem cell transplantation for relapsed or primary refractory diffuse large B-cell lymphoma. Blood 2004; 103(10): 3684-8.(3iiiDiv)
20)Oki Y, et al. Phase II study of a salvage regimen using cyclophosphamide, high-dose cytarabine, dexamethasone, etoposide, and rituximab in patients with relapsed or refractory B-cell non-Hodgkin’s lymphoma. Cancer Sci. 2008; 99(1): 179-84.(3iiiDiv)
21)Jermann M, et al. Rituximab-EPOCH, an effective salvage therapy for relapsed, refractory or transformed B-cell lymphomas: results of a phase II study. Ann Oncol. 2004; 15(3): 511-6.(3iiiDiv)
22)Rodriguez MA, et al. A phase Ⅱ trial of mesna/ifosfamide, mitoxantrone and etoposide for refractory lymphomas. Ann Oncol 1995; 6(6): 609-11.(3iiiDiv)
23)Crump M, et al. Gemcitabine, dexamethasone, and cisplatin in patients with recurrent or refractory aggressive histology B-cell non-Hodgkin lymphoma: a Phase II study by the National Cancer Institute of Canada Clinical Trials Group(NCIC-CTG). Cancer 2004; 101(8): 1835-42.(3iiiDiv)
24)Ohmachi K, et al. Multicenter phase II study of bendamustine plus rituximab in patients with relapsed or refractory diffuse large B-cell lymphoma. J Clin Oncol. 2013; 31(17): 2103-9.(3iiiDiv)
25)Sehn LH, et al. Polatuzumab Vedotin in Relapsed or Refractory Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2020; 38(2): 155-65.(2Div)
26)Hutchings M, Mous R, Clausen MR, et al. Dose escalation of subcutaneous epcoritamab in patients with relapsed or refractory B-cell non-Hodgkin lymphoma: an open-label, phase 1/2 study. Lancet 2021; 398(10306): 1157-69.(3iiiDiv)
27)Thieblemont C, Phillips T, Ghesquieres H, et al. Epcoritamab, a Novel, Subcutaneous CD3xCD20 Bispecific T-Cell-Engaging Antibody, in Relapsed or Refractory Large B-Cell Lymphoma: Dose Expansion in a Phase I/II Trial. J Clin Oncol. 2023; 41(12): 2238-47.(3iiiDiv)
28)Izutsu K, Kumode T, Yuda J, et al. Subcutaneous epcoritamab monotherapy in Japanese adults with relapsed/refractory diffuse large B-cell lymphoma. Cancer Sci. 2023; 114(12): 4643-53.(3iiiDiv)
CQ1 初発限局期DLBCLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
3週間隔のR-CHOP療法6コースが推奨される。IPIスコアが2以上の18~80歳の患者に対しては,ポラツズマブ ベドチン併用RCHP療法6コースも標準治療の一つとして勧められる。
- 推奨グレード
- カテゴリー2A
3週間隔のR-CHOP療法を3コース行った後にISRTを追加するCMTが推奨される。
- 推奨グレード
- カテゴリー1
年齢調整IPIスコアが0の60歳以下の患者に対しては,R-CHOP療法4コースにR 2コースを追加する治療も標準治療の一つとして勧められる。
解説
本項に記載する限局期は,DLBCLの限局期における放射線治療を考慮する際に,IFRTとして1照射野で治療可能である連続性Ⅱ期を対象としていたことから,Ann Arbor分類での臨床病期Ⅰ期および連続性Ⅱ期に該当する。現在の診療では,より照射体積を限定するためにISRTが行われている。
リツキシマブ(R)導入以前に行われた大規模比較試験であるSouthwest Oncology Group(SWOG)で行われたS8736試験で,CHOP療法(CPA,DXR,VCR,PSL)8コースとCHOP療法3コースに引き続いてIFRTを行うcombined modality therapy(CMT)が比較され,短期間でのPFSおよびOSでは,CMTの優越性が観察されたものの,長期成績ではその優位性が失われることが示された1,2)。2000年代に臨床病期Ⅰ/Ⅱ期の限局期患者が72%含まれるMabThera International Trial(MInT)によりR併用化学療法6コースがR非併用化学療法にEFS,OSで優ったことが報告され3),限局期DLBCLに対する標準治療は,R-CHOP療法3コース+IFRTかR-CHOP療法6~8コースと認識された。限局期DLBCLに対するR-CHOP療法6コースと8コースを比較する成績は報告されていないが,最近の臨床試験ではR-CHOP療法6コースが採用され,進行期の患者が多数を占めるGOYA試験のサブ解析においてもR-CHOP療法6コースで十分な可能性が示されている4)。
R導入後のCMTとして,SWOGで行われた年齢が61歳以上,Ⅱ期,LDH高値を予測因子とするstage-modified IPIで1つ以上の因子を有する限局期DLBCLを対象とした第Ⅱ相試験(S0014試験)では,R-CHOP療法3コース+RTの良好な治療成績が示された5)。The Lymphoma Study Association(LYSA)で行われた7 cmを超えるbulky massを有しない限局期DLBCLに対するランダム化非劣性試験では,R-CHOP-14療法4コース後の中間PETでCRに至った患者を対象に,stage-modified IPIで予後因子を有しない場合は,IFRTの追加の有無を比較し,有する場合は,R-CHOP-14療法2コース追加後にIFRT追加の有無が比較された。この試験では,R-CHOP-14療法4コース後にCRが得られた患者では,EFSおよびOSともに化学療法群がCMT群に劣らないことが示された6)。さらにSWOGで行われた10cmを超えるbulky massを有しない限局期DLBCLを対象に行われた第Ⅱ相試験(S1001試験)では,R-CHOP療法3コース後にPET陰性であれば,R-CHOP療法1コース追加し,PET陽性であればIFRTとイブリツモマブチウキセタンが追加され,PET陰性/陽性ともに5年PFSがそれぞれ89%,86%と良好な成績が得られた7)。
German Lymphoma Allianceによって行われた7.5cmを超えるbulky massを有さず,年齢調整IPIでリスク因子を有しない限局期DLBCLを対象に,R-CHOP療法6コースに対してR-CHOP療法4コース+R 2コースを比較するランダム化非劣性試験では,3年PFSがそれぞれ96%,94%と,R-CHOP療法4コース+R2コースのR-CHOP療法6コースに対する非劣性が示された8)。治療開始早期におけるRの強化はアウトカムの改善にはつながっていない9,10)。
さらに18~80歳でIPIスコアが2以上の患者を対象としたR-CHOP療法6コース(+R単剤療法2コース)とポラツズマブ ベドチン(Pola)併用R-CHP療法6コース(+R単剤療法2コース)の比較試験(POLARIX試験)では,臨床病期Ⅰ・Ⅱ期の患者が11%含まれ,主要評価項目であるPFSでPola併用R-CHP療法群がHR 0.73(95%CI 0.57-0.95,p=0.02)で有意にR-CHOP療法群を上回っていた11)。
以上から,限局期DLBCLに対しては,R-CHOP療法3コース+ISRTのCMT,あるいはR-CHOP療法6コースが勧められるが,現在の診療では,R-CHOP療法が選択されることがより一般的である。また,18~80歳でIPIスコアが2以上の患者に対しては,Pola併用R-CHP療法6コースも標準治療の一つとして勧められる。年齢調整IPIでリスク因子を有しない患者に対しては,R-CHOP療法4コース+R 2コースも選択肢の一つである。R-CHOP療法3~4コース後にFDG-PET/CT陰性の患者に対しては,R-CHOP療法4コースで十分な可能性がある。
参考文献
1) Miller TP, et al. Chemotherapy alone compared with chemotherapy plus radiotherapy for localized intermediate-and high-grade non-Hodgkin’s lymphoma. N Engl J Med. 1998; 339(1): 21-6.(1iiDiii/1iiA)
2) Stephens DM, et al. Continued Risk of Relapse Independent of Treatment Modality in Limited-Stage Diffuse Large B-Cell Lymphoma: Final and Long-Term Analysis of Southwest Oncology Group Study S8736. J Clin Oncol. 2016; 34(25): 2997-3004.(1iiDiii/1iiA)
3) Pfreundschuh M, et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial(MInT)Group. Lancet Oncol. 2006; 7(5): 379-91.(1iiDi)
4) Sehn LH, et al. No Added Benefit of Eight Versus Six Cycles of CHOP When Combined with Rituximab in Previously Untreated Diffuse Large B-Cell Lymphoma Patients: Results from the International Phase III GOYA Study. Blood. 2018; 132(suppl 1): 783.(2Diii)
5) Persky DO, et al. Phase II study of rituximab plus three cycles of CHOP and involved-field radiotherapy for patients with limited-stage aggressive B-cell lymphoma: Southwest Oncology Group study 0014. J Clin Oncol. 2008; 26(14): 2258-63.(3iiiDiii)
6) Lamy T, et al. R-CHOP 14 with or without radiotherapy in nonbulky limited-stage diffuse large B-cell lymphoma. Blood. 2018; 131(2): 174-81.(1iiDi/1iiDiii)
7) Persky DO, et al. Positron Emission Tomography-Directed Therapy for Patients With Limited-Stage Diffuse Large B-Cell Lymphoma: Results of Intergroup National Clinical Trials Network Study S1001. J Clin Oncol. 2020; 38(26): 3003-11.(3iiiDiii)
8) Poeschel V, et al. Four versus six cycles of CHOP chemotherapy in combination with six applications of rituximab in patients with aggressive B-cell lymphoma with favourable prognosis(FLYER): a randomised, phase 3, non-inferiority trial. Lancet. 2020; 394(10216): 2271-81.(1iiDiii)
9) Ohmachi K, et al. A randomized phase 2/3 study of R-CHOP vs CHOP combined with dose-dense rituximab for DLBCL: the JCOG0601 trial. Blood Adv. 2021; 5(4): 984-93.(1iiDiii)
10)Lugtenburg PJ, et al. Rituximab-CHOP With Early Rituximab Intensification for Diffuse Large B-Cell Lymphoma: A Randomized Phase III Trial of the HOVON and the Nordic Lymphoma Group(HOVON-84). J Clin Oncol. 2020; 38(29): 3377-87.(1iiDiv)
11)Tilly H, et al. Polatuzumab Vedotin in Previously Untreated Diffuse Large B-Cell Lymphoma. N Engl J Med. 2022; 386(4): 351-63.(1iiDiii)
CQ2 初発進行期DLBCLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
3週間間隔のR-CHOP療法6~8コースが標準治療として勧められるが,IPIスコアが2以上の18~80歳の患者に対しては,ポラツズマブ ベドチン併用R-CHP療法6コースも標準治療の一つとして勧められる。
解説
2000年代初めに海外で行われた,CHOP療法(CPA,DXR,VCR,PSL)とR-CHOP療法を比較した複数の臨床試験の結果に基づき,進行期DLBCLの標準治療はR-CHOP療法であるとされてきた。その後,R-CHOP療法を超えるべくさまざまな検討が行われてきた。第一寛解期にHDC/AHSCTを行う試みが海外の複数の研究グループで行われたがいずれの比較試験でもOSでHDC/AHSCTの優位性は認められず,これらの試験を統合したメタアナリシスでもPFS,OSにおいてHDC/AHSCTの有用性は示されなかった1)。米国Allianceが行ったR-CHOP療法とDA-EPOCH-R療法(ETP,PSL,VCR,CPA,DXR,R)の比較試験では,PFSとOSで両群間に差は認められず,毒性はDA-EPOCH-R療法が強かったことが報告されている2)。その他に,近年臨床導入されたシグナル伝達経路の分子を阻害する薬剤をR-CHOP療法に併用したり3-5),寛解後の維持療法に用いる等の試みや6,7),リツキシマブ(R)をオビヌツズマブに置き換える8)等の検討が国内外で大規模な比較試験として行われたが,いずれの治療も生存でR-CHOP療法を上回るものではなかった。
2021年に,18~80歳でIPIスコアが2以上の患者を対象としたR-CHOP療法6コース(+R単独療法 2コース)とポラツズマブ ベドチン(Pola)併用R-CHP療法 6コース(+R単独療法2コース)の比較試験で,Pola併用R-CHP療法群が2年のPFSで70.2% vs. 76.7%と有意にR-CHOP療法を上回っていたことが報告された。OSでは両群に差は認められなかったもののPola併用R-CHP療法によって増悪または再発,死亡,次治療といったイベントが25%減ったことが示されており9),これらの対象に対しては標準治療の一つとして勧められる。それ以外の対象に対するPola併用R-CHP療法の安全性と有効性は確立されておらず,R-CHOP療法に対する優位性は不明である。
標準的なR-CHOP療法のコース数は6~8コースであるが,6コースと8コースの差を前方視的に比較した臨床試験はないため至適コース数について明確な根拠はない.R-CHOP療法とオビヌツズマブ併用CHOP療法の比較試験のサブ解析において,R-CHOP療法が6コース行われた群と8コース行われた群を比較すると,3年のPFSで両群に差がなかったことが報告されている9,10)。
以上より,初発進行期DLBCLに対しては3週間間隔のR-CHOP療法 6~8コースが標準治療として勧められるが,IPIスコアが2以上の18~80歳の患者に対しては,Pola併用R-CHP 療法6コース(+R単独療法 2コース)も標準治療の一つとして勧められる。
参考文献
1) Epperla N, et al. Upfront autologous hematopoietic stem cell transplantation consolidation for patients with aggressive B-cell lymphomas in first remission in the rituximab era: A systematic review and meta-analysis. Cancer. 2019; 125(24): 4417-25.(1iA)
2) Bartlett NL, et al. Dose-Adjusted EPOCH-R Compared With R-CHOP as Frontline Therapy for Diffuse Large B-Cell Lymphoma: Clinical Outcomes of the Phase III Intergroup Trial Alliance/CALGB 50303. J Clin Oncol. 2019; 37(21): 1790-9.(1iiDiii)
3) Davies A, et al. Gene-expression profiling of bortezomib added to standard chemoimmunotherapy for diffuse large B-cell lymphoma(REMoDL-B): an open-label, randomised, phase 3 trial. Lancet Oncol. 2019; 20(5): 649-62.(1iiDiii)
4) Younes A, et al. Randomized Phase III Trial of Ibrutinib and Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone in Non-Germinal Center B-Cell Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2019; 37(15): 1285-95.(1iiiDi)
5) Nowakowski GS, et al. ROBUST: A Phase III Study of Lenalidomide Plus R-CHOP Versus Placebo Plus R-CHOP in Previously Untreated Patients With ABC-Type Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2021; 39(12): 1317-28.(1iiDiii)
6) Yuan T, et al. Maintenance therapy for untreated diffuse large B-cell lymphoma: a systematic review and network meta-analysis. Ther Adv Hematol. 2021; 12: 20406207211018894.(1iA)
7) Thieblemont C, et al. Lenalidomide Maintenance Compared With Placebo in Responding Elderly Patients With Diffuse Large B-Cell Lymphoma Treated With First-Line Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone. J Clin Oncol. 2017;35(22): 2473-81.(1iiDiii)
8) Vitolo U, et al. Obinutuzumab or Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone in Previously Untreated Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2017; 35(31): 3529-37.(1ii-Diii)
9) Tilly H, et al. Polatuzumab Vedotin in Previously Untreated Diffuse Large B-Cell Lymphoma. N Engl J Med. 2022; 386(4): 351-63.(1iiDiii)
10)Sehn LH, et al. No Added Benefit of Eight Versus Six Cycles of CHOP When Combined with Rituximab in Previously Untreated Diffuse Large B-Cell Lymphoma Patients: Results from the International Phase III GOYA Study. Blood. 2018; 132(Supplement 1): 783.(2Diii)
CQ3 DLBCLに対する中枢神経系再発予防としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
精巣原発のDLBCLでは,中枢神経系再発予防のためR-CHOP療法に予防的髄注を併用することが推奨される。
- 推奨グレード
- カテゴリー2B
中枢神経系再発予測モデルによる高リスクグループ,特別な節外病変を有する例,CD5陽性例では髄注や大量メトトレキサート療法を併用することで中枢神経系再発の頻度が下がる可能性があるが,有用性は確立していない。
解説
DLBCLでは,2.8~7.1%に中枢神経系(CNS)再発が起こるとされている1-3)。発症頻度より,全例にCNS再発予防を行うことは推奨されず,CNS再発リスクが高い一群のみに再発予防を行ってきた。リツキシマブ(R)併用化学療法下でCNS再発リスクが低減している可能性はあるが3),CNS再発予測モデルであるCNS-IPI(IPIの5つの因子と腎/副腎浸潤)スコア4以上である高リスクグループ2),精巣,骨髄,副鼻腔・鼻腔,眼窩,骨,末梢血,乳房,腎・副腎,子宮,卵巣・卵管などの節外臓器浸潤,CD5陽性4)はその対象になり得る。精巣原発のDLBCLに関しては,International Extranodal Lymphoma Study Groupにより大規模な後方視的解析が報告され,373例のうち52%が再発し,10年累積CNS再発は15%と高かった5)。同グループは,病期Ⅰ~Ⅱ期の初発の精巣原発DLBCL患者に対して,R-CHOP療法(R,CPA,DXR,VCR,PSL)6~8コースに4回のメトトレキサート(MTX)の髄注,対側精巣への放射線照射(Ⅱ期の例では,リンパ節病変の領域にも照射)を併用するという前方視的第Ⅱ相試験を行い,5年累積CNS再発割合が6%であった6)。これらの結果より,精巣原発のDLBCLに対しては予防的髄注と放射線照射の併用が推奨される。バーキットリンパ腫や成人T細胞白血病・リンパ腫の実績からCNS再発予防治療として髄注が広く行われている。R/オビヌツズマブ併用化学療法が行われたDLBCL 7,357例を対象としたシステマティックレビューやR-CHOP療法が行われたDLBCL 989例を対象とした後方視的解析の結果,予防的髄注はCNS再発予防効果が不十分である可能性が示された7,8)。他のCNS再発予防治療として大量MTX療法がある。CNS再発高リスクDLBCLに対し,R-CHOP療法に加えて大量MTX療法が1回以上投与された65例を対象として検討したところ,3年累積CNS再発割合が3%と低かった9)。未治療CD5陽性DLBCLを対象としたDA-EPOCH-R療法(ETP,PSL,VCR,CPA,DXR,R)4コース後に大量MTX療法2コースを行い,その後にDA-EPOCH-R療法4コースを行う第Ⅱ相試験の結果,47名が登録され2年CNS再発割合は9%であった10)。これらの結果から,大量MTX療法が有用である可能性があるが,相反する結果の報告もあり,確立した予防治療法はない11)。
参考文献
1) Bernstein SH, et al. Natural history of CNS relapse in patients with aggressive non-Hodgkin’s lymphoma: a 20-year follow-up analysis of SWOG 8516 -- the Southwest Oncology Group. J Clin Oncol. 2009;27(1): 114-9.(3iiiD)
2) Schmitz N, et al. CNS International Prognostic Index: A Risk Model for CNS Relapse in Patients With Diffuse Large B-Cell Lymphoma Treated With R-CHOP. J Clin Oncol. 2016;34(26): 3150-6.(3iiiD)
3) Villa D, et al. Incidence and risk factors for central nervous system relapse in patients with diffuse large B-cell lymphoma: the impact of the addition of rituximab to CHOP chemotherapy. Ann Oncol. 2010;21(5): 1046-52.(3iiiD)
4) Miyazaki K, et al. CD5-positive diffuse large B-cell lymphoma: a retrospective study in 337 patients treated by chemotherapy with or without rituximab. Ann Oncol. 2011;22(7): 1601-7.(3iiiDiv)
5) Zucca E, et al. Patterns of outcome and prognostic factors in primary large-cell lymphoma of the testis in a survey by the International Extranodal Lymphoma Study Group. J Clin Oncol. 2003;21(1): 20-7.(3iiiA)
6) Vitolo U, et al. First-line treatment for primary testicular diffuse large B-cell lymphoma with rituximab-CHOP, CNS prophylaxis, and contralateral testis irradiation: final results of an international phase II trial. J Clin Oncol. 2011; 29(20): 2766-72.(3iiiDiii)
7) Eyre TA, et al. Efficacy of central nervous system prophylaxis with stand-alone intrathecal chemotherapy in diffuse large B-cell lymphoma patients treated with anthracycline-based chemotherapy in the rituximab era: a systematic review. Haematologica. 2020;105(7): 1914-24.(3iiiD)
8) Kumar A, et al. Lack of benefit of central nervous system prophylaxis for diffuse large B-cell lymphoma in the rituximab era: findings from a large national database. Cancer. 2012;118(11): 2944-51.(3iiiD)
9) Abramson JS, et al. Intravenous methotrexate as central nervous system(CNS)prophylaxis is associated with a low risk of CNS recurrence in high-risk patients with diffuse large B-cell lymphoma. Cancer. 2010;116(18): 4283-90.(3iiiD)
10)Miyazaki K, et al. DA-EPOCH-R combined with high-dose methotrexate in patients with newly diagnosed stage II-IV CD5-positive diffuse large B-cell lymphoma: a single-arm, open-label, phase II study. Haematologica. 2020;105(9): 2308-15.(3iiiDiii)
11)Guirguis HR, et al. Impact of central nervous system(CNS)prophylaxis on the incidence and risk factors for CNS relapse in patients with diffuse large B-cell lymphoma treated in the rituximab era: a single centre experience and review of the literature. Br J Haematol. 2012;159(1): 39-49.(3iiiD)
CQ4 心機能の低下が予想される初発DLBCLに対して適切な化学療法は何か
- 推奨グレード
- カテゴリー2A
ドキソルビシンの投与量低減あるいは中止,持続投与への変更を考慮する。ドキソルビシンを他の薬剤へ変更した治療法は代替治療となる可能性があるが,有用性は証明されていない。
解説
ドキソルビシン(DXR)の代表的な毒性に心筋障害がある。心筋障害による心不全発症のリスクはDXRの累積投与量と相関しており,総投与量が400mg/m2未満では発症割合は0.14%程度であるが,550mg/m2になると7%,700mg/m2を超えると18%まで上昇する1)。DXRを含めた化学療法を投与されたがん患者49,017名を対象としたメタアナリシスでは,観察期間中央値9年における症候性心毒性発症割合は6%であったと報告されている2)。R-CHOP/CHOP療法におけるメタアナリシスでは心不全発症割合は2%であった3)。DXRを含めた化学療法を施行した65歳以上の高齢者DLBCLの大規模な後方視的研究において,化学療法のコース数が6コース未満であった場合は心不全のリスクは増加せず,高血圧のみが心不全のリスク因子であることが示された4)。これは高齢者DLBCLにおいて治療前に心機能が低下している割合が高く,高血圧,脂質代謝異常症,糖尿病などの心不全発症リスク因子を合併していることが背景にある。米国での後方視的解析の結果,CHOP療法(CPA,DXR,VCR,PSL)を受けた中悪性度NHL患者において6コース未満で早期治療中止群は6コース以上治療完遂群との比較において,74歳未満では生存期間が低下するが,75歳以上では生存期間は低下しなかった5)。同様に米国の大規模コホート研究では,80歳以上のDLBCLにおいて1コース目に85%以上のDXRを投与された群と85%未満の投与群とを比較すると,85%以上の投与群において治療関連死が多く1年生存割合が有意に不良であった6)。DLBCLに対する化学療法ではDXRのactual relative dose intensityが予後と相関するが7),これらのことより,心機能の低下が予想される高齢者に対しては,DXRによる心筋障害の危険性軽減のための薬剤の減量を行うことが推奨される。再発・難治性NHLを対象としたDA-EPOCH療法(ETP,PSL,VCR,CPA,DXR)の第Ⅱ相試験の結果,臨床的に問題となる心毒性は観察されなかったことから8),DXRの投与法をボーラス投与から持続投与へ変更することで心毒性は軽減される可能性が示唆されている。DXRを他の薬剤に変更した治療法として,非ペグ化リポソーマル・ドキソルビシンに変更したR-COMP療法(R,CPA,NPLD,VCR,PSL)は数多く検討され9-12),メタアナリシスの結果R-COMP療法はR-CHOP療法に対して奏効率,OS,PFSの点で非劣性であることが示された13)。心機能が低下したDLBCLを対象とした報告には,DXRをゲムシタビンに変更したR-GCVP療法(R,Gem,CPA,VCR,PSL)の第Ⅱ相試験14),DXRをエピルビシンに変更したR-CEOP療法(R,CPA,EPI,VCR,PSL)の第Ⅲ相試験15,16),エトポシドに変更したR-CEOP療法(R,CPA,ETP,VCR,PSL)の後方視的検討がある17)。いずれも比較的忍容性良好な結果と予後が示されており,代替治療法候補として期待される。DXRをピラルビシンに変更したR-THP-COP療法(R,CPA,THP-DXR,VCR,PSL)とR-CHOP療法のランダム化第Ⅲ相試験18),およびDXRをミトキサントロンへ変更したCNOP療法(CPA,MIT,VCR,PSL)のメタアナリシス結果19)のいずれもCHOP療法と比較して心毒性に差がなく,代替治療のエビデンスとはなり得ない。
参考文献
1) Von Hoff DD, et al. Risk factors for doxorubicin-induced congestive heart failure. Ann Intern Med. 1979; 91(5): 710-7.(3iiiDiv)
2) Lotrionte M, et al. Review and meta-analysis of incidence and clinical predictors of anthracycline cardiotoxicity. Am J Cardiol. 2013; 112(12): 1980-4.(1ivD)
3) Linschoten M, et al. Cardiovascular adverse events in patients with non-Hodgkin lymphoma treated with first-line cyclophosphamide, doxorubicin, vincristine, and prednisone(CHOP)or CHOP with rituximab(R-CHOP): a systematic review and meta-analysis. Lancet Haematol. 2020; 7(4): e295-308.(1ivD)
4) Hershman DL, et al. Doxorubicin, cardiac risk factors, and cardiac toxicity in elderly patients with diffuse B-cell non-Hodgkin’s lymphoma. J Clin Oncol. 2008; 26(19): 3159-65.(3iiiD)
5) Chrischilles EA, et al. Factors associated with early termination of CHOP therapy and the impact on survival among patients with chemosensitive intermediate-grade non-Hodgkin’s lymphoma. Cancer Control. 2003; 10(5): 396-403.(3iiiA)
6) Carson KR, et al. Comparative effectiveness of anthracycline-containing chemotherapy in United States veterans age 80 and older with diffuse large B-cell lymphoma. J Geriatr Oncol. 2015; 6(3): 211-8.(3iiiA)
7) Kwak LW, et al. Prognostic significance of actual dose intensity in diffuse large-cell lymphoma: results of a tree-structured survival analysis. J Clin Oncol. 1990; 8(6): 963-77.(3iiiA)
8) Wilson WH, et al. Dose-adjusted EPOCH chemotherapy for untreated large B-cell lymphomas: a pharmacodynamic approach with high efficacy. Blood. 2002; 99(8): 2685-93.(3iiiDiv)
9) Corazzelli G, et al. Biweekly rituximab, cyclophosphamide, vincristine, non-pegylated liposome-encapsulated doxorubicin and prednisone(R-COMP-14)in elderly patients with poor-risk diffuse large B-cell lymphoma and moderate to high ‘life threat’ impact cardiopathy. Br J Haematol. 2011; 154(5): 579-89.(3iiiDiv)
10)Fridrik MA, et al. Cardiotoxicity with rituximab, cyclophosphamide, non-pegylated liposomal doxorubicin, vincristine and prednisolone compared to rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisolone in frontline treatment of patients with diffuse large B-cell lymphoma: A randomised phase-III study from the Austrian Cancer Drug Therapy Working Grou[Arbeitsgemeinschaft Medikamentöse Tumortherapie AGMT](NHL-14). Eur J Cancer. 2016;58:112-21.(1iiDiv)
11)Luminari S, et al. Nonpegylated liposomal doxorubicin combination regimen in patients with diffuse large B-cell lymphoma and cardiac comorbidity. Results of the HEART01 phase II trial conducted by the Fondazione Italiana Linfomi. Hematol Oncol. 2018; 36(1): 68-75.(3iiiDiv)
12)Sancho JM, et al. R-COMP versus R-CHOP as first-line therapy for diffuse large B-cell lymphoma in patients ≥ 60 years: Results of a randomized phase 2 study from the Spanish GELTAMO group. Cancer Med. 2021; 10(4): 1314-26.(3iiiDiv)
13)Visco C, et al. Efficacy of R-COMP in comparison to R-CHOP in patients with DLBCL: A systematic review and single-arm metanalysis. Crit Rev Oncol Hematol. 2021; 163: 103377.(1iDiv)
14)Fields PA, et al. De novo treatment of diffuse large B-cell lymphoma with rituximab, cyclophosphamide, vincristine, gemcitabine, and prednisolone in patients with cardiac comorbidity: a United Kingdom National Cancer Research Institute trial. J Clin Oncol. 2014; 32(4): 282-7.(3iiiDiv)
15)Xue K, et al. Cardiotoxicity as indicated by LVEF and troponin T sensitivity following two anthracycline-based regimens in lymphoma: Results from a randomized prospective clinical trial. Oncotarget. 2016; 7(22): 32519-31.(1iiDiv)
16)Xu PP, et al. Anthracycline dose optimisation in patients with diffuse large B-cell lymphoma: a multicentre, phase 3, randomised, controlled trial. Lancet Haematol. 2019; 6(6): e328-37.(1iiDiii)
17)Moccia AA, et al. Long-term outcomes of R-CEOP show curative potential in patients with DLBCL and a contraindication to anthracyclines. Blood Adv. 2021; 5(5): 1483-9.(3iiiDii)
18)Hara T, et al. R-THP-COP versus R-CHOP in patients younger than 70 years with untreated diffuse large B cell lymphoma: A randomized, open-label, noninferiority phase 3 trial. Hematol Oncol. 2018; 36(4): 638-44.(1iiDiv)
19)Björkholm M, et al. CNOP(mitoxantrone)chemotherapy is inferior to CHOP(doxorubicin)in the treatment of patients with aggressive non-Hodgkin lymphoma(meta-analysis). Eur J Haematol. 2008; 80(6): 477-82.(1iDiv)
CQ5 高齢者DLBCLに対する標準治療は何か
- 推奨グレード
- カテゴリー1
80歳未満に対しては若年者と同じで,限局期にはR-CHOP療法3コース施行後に放射線治療を追加するCMTもしくはR-CHOP療法6~8コース,進行期にはR-CHOP療法6~8コースである。R-CHOP療法は標準量が推奨される。18~80歳でIPIスコアが2以上の患者に対しては,ポラツズマブ ベドチン併用R-CHP療法6コースも標準治療の一つとして勧められる。
- 推奨グレード
- カテゴリー2A
80歳以上の超高齢者に対しては,用量あるいはコース数を減らしたR-CHOP療法は妥当な治療選択肢の一つである。
解説
WHO分類では高齢者は65歳以上と定義されている。IPIにおいて年齢61歳以上が予後不良因子の一つであり,高齢そのものが予後不良と関係している。高齢患者は臓器機能低下を認め,併存疾患・合併症の存在,認知機能低下,社会的問題が存在する。また,若年者と比べて治療関連死亡割合および毒性が増加することが知られており,R-CHOP療法を減量もしくはコース数を減らすなどの治療が一般的に行われてきた1)。DLBCLを対象とした多くの臨床試験は年齢上限を80歳としており,PSおよび臓器機能が概ね良好で,重大な合併症を認めなければ,R-CHOP療法(R,CPA,DXR,VCR,PSL)が80歳までのDLBCLの標準治療レジメンである2,3)。18~80歳でIPIスコアが2以上の患者に対しては,ポラツズマブ ベドチン(Pola)併用R-CHP療法6コースも標準治療の一つとして勧められる4)。
Groupe d’Etude des Lymphomes de l’Adulte(GELA)で行われた80歳以上の全病期の初発超高齢患者を対象とした,低用量R-CHOP療法6コースに対する第Ⅱ相試験の結果,入院治療を必要とするような毒性の割合が低く,80歳超の患者に対しても治癒を望めることが明らかになった5)。80歳未満でPSおよび臓器機能が保たれている場合は,R-CHOP療法の用量強度を保つ必要がある。80歳以上の患者では大規模な臨床試験の実施が困難であるため,至適な治療方針は未確立である。上述した第Ⅱ相試験4)やメタアナリシスの結果6,7)から,減量R-CHOP療法が望ましい。標準治療が適さない対象を客観的に同定するため,治療前評価として有用な高齢者総合機能評価(comprehensive geriatric assessment:CGA)ツールが報告されている8-10)。
R-CHOP療法以外で第Ⅲ相試験によりR-CHOP療法との非劣性が証明されているレジメンとしては,ドキソルビシン(DXR)をピラルビシンに置き換えたR-THP-COP療法(R,CPA,THPDXR,VCR,PSL)11),エピルビシンに置き換えたR-CEOP療法(R,EPI,CPA,VCR,PSL)12)がある。減量EPOCH-R療法(ETP,PSL,VCR,CPA,DXR,R)13)は75歳以上の超高齢者を対象とした前方登録研究であり,3年OS,3年PFSが各々62.8%,60.8%であった。以上3つの治療レジメンは,減量R-CHOP療法が施行できない場合に選択できる。また,DXRをリポソーマル・ドキソルビシンに変更したR-COMP療法(R,CPA,NPLD,VCR,PSL)はメタアナリシス14)や第Ⅱ相試験15)の結果においてR-CHOP療法と同等の治療効果を示した。他にも単群の第Ⅱ相試験であるがBR療法(BEN,R)15)の2年OSは51%16),R-GemOx療法(R,GEM,L-OHP)16)の3年OSは65%であり17),いずれも許容できる毒性が示された。わが国ではベンダムスチン(BEN)は初発例に対して,リポソーマル・ドキソルビシン,オキサリプラチン(L-OHP)は悪性リンパ腫に対して保険適用外である。
再発・難治性高齢者DLBCL患者に対しては大規模な臨床試験が施行されておらず,標準治療は未確立である。抗CD79b抗体薬物複合体であるPola併用BR療法を試験治療とした第Ⅰ/Ⅱb試験18),R-GCVP療法(R,Gem,CPA,VCR,PSL)19)やfractionated ICE療法(IFM,CBDCA,ETP)20)を用いた後方視的解析,細胞治療を試験治療とした第Ⅰ/Ⅱ相試験のサブ解析の結果21)から,これらが治療選択肢となり得る治療レジメンである。ただし,患者の全身状態や臓器機能,各救援療法の特性を検討の上,適切な救援療法を選択する必要がある。
参考文献
1) Park S, et al. Multicenter Phase 2 Study of Reduced-Dose CHOP Chemotherapy Combined With Rituximab for Elderly Patients With Diffuse Large B-Cell Lymphoma. Clin Lymphoma Myeloma Leuk. 2019; 19(3): 149-56.(2Di)
2) Ohmachi K, et al. A randomized phase 2/3 study of R-CHOP vs CHOP combined with dose-dense rituximab for DLBCL: the JCOG0601 trial. Blood Adv. 2021; 5(4): 984-93.(1iiDiii/1iiA)
3) Delarue R, et al. Dose-dense rituximab-CHOP compared with standard rituximab-CHOP in elderly patients with diffuse large B-cell lymphoma(the LNH03-6B study): a randomised phase 3 trial. Lancet Oncol. 2013; 14(6): 525-33.(1iiDi/1iiA)
4) Tilly H, et al. Polatuzumab Vedotin in Previously Untreated Diffuse Large B-Cell Lymphoma. N Engl J Med. 2022; 386(4): 351-63.(1iiDiii)
5) Peyrade F, et al. Attenuated immunochemotherapy regimen(R-miniCHOP)in elderly patients older than 80 years with diffuse large B-cell lymphoma: a multicentre, single-arm, phase 2 trial. Lancet Oncol. 2011; 12(5): 460-8.(3iiiDiv)
6) Bataillard EJ, et al. Impact of R-CHOP dose intensity on survival outcomes in diffuse large B-cell lymphoma: a systematic review. Blood Adv. 2021; 5(9): 2426-37.(1iA)
7) Beygi S, et al. Frontline treatment of diffuse large B-cell lymphoma in elderly: a systematic review of clinical trials in post-rituximab era. Leuk Lymphoma. 2018; 59(12): 2847-61.(1iDiii)
8) Merli F, et al. Simplified Geriatric Assessment in Older Patients With Diffuse Large B-Cell Lymphoma: The Prospective Elderly Project of the Fondazione Italiana Linfomi. J Clin Oncol. 2021; 39(11): 1214-22.(3iiA)
9) Tavares A, et al. Diffuse large B-cell lymphoma in very elderly patients: Towards best tailored treatment - A systematic review. Crit Rev Oncol Hematol. 2021; 160: 103294.(1iDiv)
10)Isaksen KT, et al. A simplified frailty score predicts survival and can aid treatment-intensity decisions in older patients with DLBCL. Blood Adv. 2021; 5(22): 4771-82.(3iA)
11)Hara T, et al. R-THP-COP versus R-CHOP in patients younger than 70 years with untreated diffuse large B cell lymphoma: A randomized, open-label, noninferiority phase 3 trial. Hematol Oncol. 2018; 36(4): 638-44.(1iiDiv)
12)Xu PP, et al. Anthracycline dose optimisation in patients with diffuse large B-cell lymphoma: a multicentre, phase 3, randomised, controlled trial. Lancet Haematol. 2019; 6(6): e328-37.(1iiDiii)
13)Zhang WH, et al. Reduced-dose EPOCH-R chemotherapy for elderly patients with advanced stage diffuse large B cell lymphoma. Ann Hematol. 2018; 97(10): 1809-16.(2A)
14)Visco C, et al. Efficacy of R-COMP in comparison to R-CHOP in patients with DLBCL: A systematic review and single-arm metanalysis. Crit Rev Oncol Hematol. 2021; 163: 103377.(1iDiv)
15)Sancho JM, et al. R-COMP versus R-CHOP as first-line therapy for diffuse large B-cell lymphoma in patients ≥ 60 years: Results of a randomized phase 2 study from the Spanish GELTAMO group. Cancer Med. 2021; 10(4): 1314-26.(3iiiDiv)
16)Storti S, et al. Rituximab plus bendamustine as front-line treatment in frail elderly(>70 years)patients with diffuse large B-cell non-Hodgkin lymphoma: a phase II multicenter study of the Fondazione Italiana Linfomi. Haematologica. 2018; 103(8): 1345-50.(2Div)
17)Shen QD, et al. Gemcitabine-oxaliplatin plus rituximab(R-GemOx)as first-line treatment in elderly patients with diffuse large B-cell lymphoma: a single-arm, open-label, phase 2 trial. Lancet Haematol. 2018; 5(6): e261-9.(2Div)
18)Sehn LH, et al. Polatuzumab Vedotin in Relapsed or Refractory Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2020; 38(2): 155-65.(2Div)
19)Djebbari F, et al. Efficacy of R-GCVP in patients with late relapse of diffuse large B-cell lymphoma. Br J Haematol. 2019; 186(6): e191-5.(3iiiDiv)
20)Tanaka N, et al. Fractionated ifosfamide, carboplatin, and etoposide with rituximab as a safe and effective treatment for relapsed/refractory diffuse large B cell lymphoma with severe comorbidities. Ann Hematol. 2020; 99(11): 2577-86.(3iiiA)
21)Neelapu SS, et al. Outcomes of older patients in ZUMA-1, a pivotal study of axicabtagene ciloleucel in refractory large B-cell lymphoma. Blood. 2020; 135(23): 2106-9.(2Div)
CQ6 再発・難治性DLBCLに対して自家造血幹細胞移植併用大量化学療法は勧められるか
- 推奨グレード
- カテゴリー1
救援療法により奏効(CR+PR)が得られ,年齢を含めた検討で適応があると判断される場合には,自家造血幹細胞移植併用大量化学療法を実施することが勧められる。
- 推奨グレード
- カテゴリー1
初回治療不応または初回治療による完全奏効後1年以内に再発した患者に対しては,アキシカブタゲン シロルユーセルまたはリソカブタゲン マラルユーセルにより,自家造血幹細胞移植併用大量化学療法よりも予後の改善が期待できる。
解説
再発・難治性DLBCLに対して通常の救援療法単独での長期予後は不良であり,救援療法に続く地固め療法としてのHDC/AHSCTによる予後の改善が試みられてきた。DLBCLを主体とする再発・難治性中高悪性度リンパ腫に対して,自家造血幹細胞移植併用大量化学療法(HDC/AHSCT)の優位性を示した比較試験にPARMA試験がある1)。DHAP療法(DEX,CDDP,AraC)2コース後に奏効(CR+PR)を認めた患者に対して,さらに4コースのDHAP療法と放射線療法を実施する群とHDC/AHSCTと放射線療法を実施する群の比較で,5年OS,EFSともにHDC/AHSCT群が優れていたことが示されている。リツキシマブ(R)導入後にHDC/AHSCTの有無を比較した臨床試験は実施されていないが,再発・難治性DLBCL,中高悪性度リンパ腫に対する救援療法を比較した試験,欧米のグループによる再発・難治性DLBCLの予後を検討した大規模な研究において,HDC/ASCTが実施できなかった群は実施できた群よりも予後不良で,実施できた群ではPARMA試験の予後が再現できていたことが示されている2-4)。
2021年に,初回治療不応または初回治療によるCR後1年以内に再発した患者に対する,HDC/ASCTとCAR-T細胞療法を比較した臨床試験の結果が3つ報告された。アキシカブタゲン シロルユーセル(Axi-Cel)およびリソカブタゲン マラルユーセル(Liso-Cel)はHDC/ASCT群をEFSで有意に上回っていた5,6)のに対して,チサゲンレクルユーセル(Tisa-Cel)は優位性は示されなかった7)。3つの試験には橋渡し治療の有無,リンパ球採取からCAR-T製剤輸注までの期間に差異があり直接の比較は困難であるが,この試験の対象となるような初回治療不応または初回治療によるCR後1年以内に再発した患者に対しては,Axi-CelまたはLiso-Celにより予後の改善が期待される。
以上より,初回治療不応または初回治療によるCR後1年以内に再発した患者に対してはAxi-CelまたはLiso-Celが,HDC/AHSCTの対象となる再発・難治性DLBCLに対しては,救援療法に奏効(CR+PR)が認められる場合にはHDC/AHSCTを実施することが勧められるが,再発・難治性DLBCLに対するCAR-T療法の有効性については知見の集積が進んでおり,適応が拡大しつつあることに留意する。
参考文献
1) Philip T, et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin’s lymphoma. N Engl J Med. 1995; 333(23): 1540-5.(1iiA)
2) Gisselbrecht C, et al. Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era. J Clin Oncol. 2010; 28(27): 4184-90.(1iiDi)
3) Crump M, et al. Randomized comparison of gemcitabine, dexamethasone, and cisplatin versus dexamethasone, cytarabine, and cisplatin chemotherapy before autologous stem-cell transplantation for relapsed and refractory aggressive lymphomas: NCIC-CTG LY.12. J Clin Oncol. 2014; 32(31): 3490-6.(1iiDi)
4) Crump M, et al. Outcomes in refractory diffuse large B-cell lymphoma: results from the international SCHOLAR-1 study. Blood. 2017; 130(16): 1800-8.(3iiiA)
5) Locke FL, et al. Axicabtagene Ciloleucel as Second-Line Therapy for Large B-Cell Lymphoma. N Engl J Med. 2022; 386(7): 640-54.(1iiDi)
6) Kamdar M, et al. Lisocabtagene maraleucel versus standard of care with salvage chemotherapy followed by autologous stem cell transplantation as second-line treatment in patients with relapsed or refractory large B-cell lymphoma(TRANSFORM): results from an interim analysis of an open-label, randomised, phase 3 trial. Lancet. 2022; 399(10343): 2294-308.(1iiDi)
7) Bishop MR, et al. Second-Line Tisagenlecleucel or Standard Care in Aggressive B-Cell Lymphoma. N Engl J Med. 2022; 386(7): 629-39.(1iiDi)
CQ7 再発・難治性DLBCLに対して同種造血幹細胞移植は勧められるか
- 推奨グレード
- カテゴリー2B
難治例,自家造血幹細胞移植併用大量化学療法後の再発例に対して,同種造血幹細胞移植は考慮されるべき治療選択の一つとして勧められる。
解説
再発・難治性DLBCLに対しては,同種造血幹細胞移植(以下,同種移植)はHDC/AHSCTと比べて治療関連死亡が多く,OSでの優位性もないため1),まずはHDC/AHSCTの適応が考慮される。HDC/AHSCT後の再発・難治例は極めて予後不良であり2),何らかの臨床試験による治療法が推奨されるが,その選択肢の一つとして同種移植が挙げられる。
DLBCLに対する同種移植に関する大規模な前方視的試験のデータは乏しく,多くは後方視的解析である。The Center for International Blood and Marrow Transplant Researchとthe European Society for Blood and Marrow Transplantationのレジストリデータを用いた大規模な後方視的検討では,ハプロ移植,血縁HLA適合ドナーおよび非血縁HLA適合ドナーからの骨髄非破壊的同種移植でそれぞれ,3年の非再発治療関連死亡が22%,17%,26~30%と差がなく,3年OSが46%,50%,43~46%と同等であったと報告されている3)。本邦における再発・難治性DLBCLを対象とした同種移植に関する多施設による後方視的検討では,4年OSが23%,RFSが20%,累積の非再発治療関連死亡が23%,累積再発割合が57%であったと報告されている4)。なかでも移植時に奏効が得られていた患者では,4年OSが46%,RFSが36%であったとされている。これらの結果からは,同種移植により長期生存が得られる患者群が存在することが示されている。
以上より,HDC/AHSCT後の再発・難治例に対して,同種移植は考慮されるべき治療選択の一つである。
参考文献
1) Wang J, et al. Comparison of Survival Between Autologous and Allogeneic Stem Cell Transplantation in Patients with Relapsed or Refractory B-Cell Non-Hodgkin Lymphoma: A Meta-Analysis. Cell Transplant. 2020; 29 : 963689720975397.(1iA)
2) Crump M, et al. Outcomes in refractory diffuse large B-cell lymphoma: results from the international SCHOLAR-1 study. Blood 2017; 130(16): 1800-8.(3iiiA)
3) Dreger P, et al. PTCy-based haploidentical vs matched related or unrelated donor reduced-intensity conditioning transplant for DLBCL. Blood Adv. 2019; 3(3): 360-9.(3iiiA)
4) Izumi K, et al. Outcomes of allogeneic stem cell transplantation for DLBCL : a multi-center study from the Kyoto Stem Cell Transplantation Group. Ann Hematol. 2019; 98(12): 2815-23.(3iiiA)
CQ8 節外性リンパ腫など治療上特別な配慮が必要なDLBCLの病態・病型は何か
- 推奨グレード
- カテゴリー2B
原発性中枢神経系DLBCL,精巣原発DLBCL,原発性縦隔大細胞型B細胞リンパ腫に対しては,病型に応じた治療が有効である可能性がある。
解説
WHO分類(2017)で規定されるDLBCLの亜型や類縁病型,その他特徴的な病態を示す節外性DLBCLや特徴的なバイオマーカーを有するDLBCLの一部については治療上特別な配慮が有効である可能性がある。
原発性中枢神経系DLBCLでは,中枢神経系への薬剤移行などを考慮して,大量メトトレキサート(MTX)療法を基盤とする化学療法を先行し,引き続き全脳照射を行う治療法が推奨されてきた1)。しかし,全脳照射による遅発性中枢神経障害の発生を軽減するため,全脳照射の代替にチオテパを基盤とするHDC/AHSCTが試みられている。Memorial Sloan Kettering Cancer Center(MSKCC)で行われた第Ⅱ相試験では,R-MPV療法(R,MTX,PCZ,VCR)5コース後にCRを達成した患者にはHDC/AHSCTを行い,PRもしくはSDであった患者には,R-MPV療法2コース追加後,PRもしくはCRを達成した場合にHDC/AHSCTを行い,2年PFS 79%,2年OS 81%であった2)。International Extranodal Lymphoma Study Group(IELSG)で行われたランダム化第Ⅱ相試験(IELSG32試験)では,化学療法後にSD以上の効果が得られた患者で自家末梢血幹細胞採取が行われ,引き続き全脳照射かHDC/AHSCTを行うランダム化が行われ,2年PFSで全脳照射群は80%,HDC/AHSCT群は69%の成績が得られた3)。したがって,全脳照射の代替としてのHDC/AHSCTは,治療選択肢の一つである。また,再発・難治性原発性中枢神経系DLBCLに対しては,BTK阻害薬の有効性が示されている4)。
限局期精巣原発DLBCLでは,R-CHOP療法(R,CPA,DXR,VCR,PSL)に髄注および対側精巣照射を加えた治療法により良好な生存割合が報告されており,同治療法が推奨される5,6)。原発性縦隔大細胞型B細胞リンパ腫では,DA-EPOCH-R療法(ETP,PSL,VCR,CPA,DXR,R)の第Ⅱ相試験において,5年EFS 93%と報告され,化学療法後の放射線治療が省略可能であることとともに,同治療法の有効性が示されているが7),R-CHOP療法に放射線治療を組み合わせた治療法との比較試験は行われておらず,R-CHOP療法後のFDG-PET/CT陰性例に対する放射線治療の必要性についても,現時点では結論が出ていない。診断時に明らかな中枢神経系浸潤を認めない血管内大細胞型B細胞リンパ腫(IVLBCL)では,R-CHOP療法に大量MTX療法と髄注を組み合わせた治療の第Ⅱ相試験において試験治療の有効性が示され8),未治療臨床病期Ⅱ期~Ⅳ期CD5陽性DLBCLでは,DA-EPOCH-R療法に大量MTX療法を組み合わせる治療の第Ⅱ相試験において,その有効性が示された9)。IVLBCL,CD5陽性DLBCLのいずれも稀であり,同治療法が治療選択肢の一つである。
これら以外の節外性DLBCL,および総論でDLBCLとして取り扱うと記載したものについては,DLBCLガイドラインに従うことを推奨する。
参考文献
1) Morris PG, et al. Rituximab, methotrexate, procarbazine, and vincristine followed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: final results and long-term outcome. J Clin Oncol. 2013; 31(31): 3971-9.(3iiiDiii)
2) Omuro A, et al. R-MPV followed by high-dose chemotherapy with TBC and autologous stem-cell transplant for newly diagnosed primary CNS lymphoma. Blood. 2015; 125(9): 1403-10.(3iiiDiii/3iiiA)
3) Ferreri AJM, et al. Whole-brain radiotherapy or autologous stem-cell transplantation as consolidation strategies after high-dose methotrexate-based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study Group-32 phase 2 trial. Lancet Haematol. 2017; 4(11): e510-23.(3iiiDiii)
4) Narita Y, et al. Phase I/II study of tirabrutinib, a second-generation Bruton’s tyrosine kinase inhibitor, in relapsed/refractory primary central nervous system lymphoma. Neuro Oncol. 2021; 23(1): 122-33.(3iiiDiv)
5) Zucca E, et al. Patterns of outcome and prognostic factors in primary large-cell lymphoma of the testis in a survey by the International Extranodal Lymphoma Study Group. J Clin Oncol. 2003; 21(1): 20-7.(3iiiA)
6) Vitolo U, et al. First-line treatment for primary testicular diffuse large B-cell lymphoma with rituximab-CHOP, CNS prophylaxis, and contralateral testis irradiation: final results of an international phase II trial. J Clin Oncol. 2011; 29(20): 2766-72.(3iiiDiii)
7) Dunleavy K, et al. Dose-adjusted EPOCH-rituximab therapy in primary mediastinal B-cell lymphoma. N Engl J Med. 2013; 368(15): 1408-16.(3iiiDi)
8) Shimada K, et al. Rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisolone combined with high-dose methotrexate plus intrathecal chemotherapy for newly diagnosed intravascular large B-cell lymphoma(PRIMEUR-IVL): a multicentre, single-arm, phase 2 trial. Lancet Oncol. 2020; 21(4): 593-602.(3iiiDiii)
9) Miyazaki K, et al. DA-EPOCH-R combined with high-dose methotrexate in patients with newly diagnosed stage II-IV CD5-positive diffuse large B-cell lymphoma: a single-arm, open-label, phase II study. Haematologica. 2020; 105(9): 2308-15.(3iiiDiii)
CQ9 再発・難治性DLBCLに対してCAR-T細胞療法は勧められるか
- 推奨グレード
- カテゴリー1
一次治療でCRが得られないあるいは12カ月以内に再発した再発・難治性DLBCLに対して,CAR-T細胞療法は推奨される治療の一つである。ただし,その適応については適切に判断されることが推奨される。
解説
わが国において,悪性リンパ腫診療に応用されている3つのCAR-T製剤[チサゲンレクルユーセル(Tisa-Cel),アキシカブタゲン シロルユーセル(Axi-Cel),リソカブタゲン マラルユーセル(Liso-Cel)]は,いずれもCD19抗原を標的としたCAR-T製剤である。抗CD19 CAR-T製剤の治療歴がない,再発・難治性DLBCLに対して承認されているが,製剤により承認要件が異なる。共刺激分子にCD28あるいは4-1BBが用いられている点に相違があるが,3剤における有効性の差異は明らかではない1)。
再発・難治性DLBCLに対して行われたTisa-Cel,Axi-Cel,Liso-Celそれぞれの第Ⅱ相試験(JULIET試験,ZUMA-1試験,TRANSCEND NHL 001試験)では,CR割合は40~54%と報告された2-4)。JULIET試験における長期成績では,追跡期間中央値40.3カ月時点でのCR割合は39%で,CRを達成した患者の50%PFSは未到達であった5)。その他の報告でもCRを達成した患者に対しては,有効性が持続することが示されている6,7)。また,実際の診療において臨床試験参加者より前治療歴が多い患者や臨床試験の適格規準に合致しない患者においても一定の奏効割合が示されている8,9)。既存の治療との比較においては,再発・難治性DLBCLに対する大規模な後方視的研究であるSCHOLAR-1試験とZUMA-1試験,TRANSCEND NHL 001試験との傾向スコア分析あるいはマッチング調整間接比較法を用いた解析において,治療奏効割合,生存ともにCAR-T細胞療法が既存の治療より有効である可能性が示された10,11)。
さらに再発・難治性アグレッシブリンパ腫あるいは大細胞型B細胞リンパ腫に対する二次治療としてのAxi-Celの有効性を評価する第Ⅲ相試験(ZUMA-7試験)では,一次治療でCRが得られないあるいは12カ月以内に再発した再発・難治性DLBCLに対して,白金製剤を含む救援化学療法に奏効が得られた患者にHDC/AHSCTを行う標準治療群とCAR-T細胞療法群が比較された。追跡期間中央値24.9カ月の時点で,50%EFSは,CAR-T細胞療法群で8.3カ月,標準治療群で2.0カ月,2年EFSは,それぞれ41%,16%とCAR-T細胞療法群で有意に優れていた12)。同様の試験がTisa-Cel(BELINDA試験),Liso-Cel(TRANSFORM試験)に対しても行われたが,TRANSFORM試験では,CAR-T細胞療法群が標準治療群と比較してEFSで上回ったのに対し,BELINDA試験では,CAR-T細胞療法群は標準治療群と比較してEFSで上回らなかった13,14)。これらの3つの試験結果に基づき,二次治療に対してはAxi-CelおよびLiso-Celが承認されている。3つの試験間には,橋渡し治療の有無,リンパ球採取からCAR-T製剤輸注までの期間に差異があり,直接の比較は困難である。
CAR-T細胞療法には,サイトカイン放出症候群や神経毒性などの特徴的な有害事象があり,時に集中治療を必要とするなど慎重な安全性管理が必要とされるが15),治療により健康関連QOLを改善することも示されている16)。
以上から,CAR-T細胞療法は再発・難治性DLBCLに対して有効な治療であり,一次治療でCRが得られないあるいは12カ月以内に再発した再発・難治性DLBCLに対しては推奨される治療の一つである。また,HDC/AHSCT後に再発した患者もしくは救援化学療法で奏効が得られない場合を含むHDC/AHSCTの適応がない再発・難治性DLBCLに対して考慮されるべき治療選択肢である。しかし,その適応については承認要件を含み適切に判断されることが推奨される。
参考文献
1) Maloney DG, et al. Matching-adjusted indirect treatment comparison of liso-cel versus axi-cel in relapsed or refractory large B cell lymphoma. J Hematol Oncol. 2021; 14(1): 140.(3iiiDiv)
2) Schuster SJ, et al. Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. N Engl J Med. 2019; 380(1): 45-56.(3iiiDiv)
3) Neelapu SS, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med. 2017; 377(26): 2531-44.(3iiiDiv)
4) Abramson JS, et al. Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas(TRANSCEND NHL 001): a multicentre seamless design study. Lancet. 2020; 396(10254): 839-52.(3iiiDiv)
5) Schuster SJ, et al. Long-term clinical outcomes of tisagenlecleucel in patients with relapsed or refractory aggressive B-cell lymphomas(JULIET): a multicentre, open-label, single-arm, phase 2 study. Lancet Oncol. 2021; 22(10): 1403-15.(3iiiDiv/3iiiDiii)
6) Cappell KM, et al. Long-Term Follow-Up of Anti-CD19 Chimeric Antigen Receptor T-Cell Therapy. J Clin Oncol. 2020; 38(32): 3805-15.(3iiiDiv)
7) Locke FL, et al. Long-term safety and activity of axicabtagene ciloleucel in refractory large B-cell lymphoma(ZUMA-1): a single-arm, multicentre, phase 1-2 trial. Lancet Oncol. 2019; 20(1): 31-42.(3iiiDiv)
8) Sesques P, et al. Commercial anti-CD19 CAR T cell therapy for patients with relapsed/refractory aggressive B cell lymphoma in a European center. Am J Hematol. 2020; 95(11): 1324-33.(3iiiDiv)
9) Nastoupil LJ, et al. Standard-of-Care Axicabtagene Ciloleucel for Relapsed or Refractory Large B-Cell Lymphoma: Results From the US Lymphoma CAR T Consortium. J Clin Oncol. 2020; 38(27): 3119-28. (3iiiDiv)
10)Neelapu SS, et al. Comparison of 2-year outcomes with CAR T cells(ZUMA-1)vs salvage chemotherapy in refractory large B-cell lymphoma. Blood Adv. 2021; 5(20): 4149-55.(3iiiDiv/3iiiA)
11)Salles G, et al. Indirect Treatment Comparison of Liso-Cel vs. Salvage Chemotherapy in Diffuse Large B-Cell Lymphoma : TRANSCEND vs. SCHOLAR-1. Adv Ther. 2021; 38(6): 3266-80.(3iiiA/3iiiDiv)
12)Locke FL, et al. Axicabtagene Ciloleucel as Second-Line Therapy for Large B-Cell Lymphoma. N Engl J Med. 2022; 386(7): 640-54.(1iiDi)
13)Kamdar M, et al. Lisocabtagene maraleucel versus standard of care with salvage chemotherapy followed by autologous stem cell transplantation as second-line treatment in patients with relapsed or refractory large B-cell lymphoma(TRANSFORM): results from an interim analysis of an open-label, randomised, phase 3 trial. Lancet. 2022; 399(10343): 2294-308.(1iiDi)
14)Bishop MR, et al. Second-Line Tisagenlecleucel or Standard Care in Aggressive B-Cell Lymphoma. N Engl J Med. 2022; 386(7): 629-39.(1iiDi)
15)Azoulay É, et al. Outcomes in patients treated with chimeric antigen receptor T-cell therapy who were admitted to intensive care(CARTTAS): an international, multicentre, observational cohort study. Lancet Haematol. 2021; 8(5): e355-64.(3iii)
16)Patrick DL, et al. Effect of lisocabtagene maraleucel on HRQoL and symptom severity in relapsed/refractory large B-cell lymphoma. Blood Adv. 2021; 5(8): 2245-55.(3iiiC)

