第Ⅱ章 リンパ腫
Ⅱ リンパ腫
3 リンパ形質細胞性リンパ腫/ワルデンシュトレームマクログロブリン血症(lymphoplasmacytic lymphoma/Waldenström’s macroglobulinemia:LPL/WM)
総論
リンパ形質細胞性リンパ腫(lymphoplasmacytic lymphoma:LPL)は,低悪性度B細胞リンパ腫の一型であり,小型B細胞リンパ球,形質細胞への分化傾向にあるリンパ球,形質細胞が混在したリンパ系腫瘍と定義される1, 2)。ワルデンシュトレームマクログロブリン血症(Waldenström’s macroglobulinemia:WM)は,骨髄浸潤とIgM型M蛋白血症を伴うLPLのサブセットとして定義され,LPLの90〜95%を占める。IgM型M蛋白血症を伴うB細胞リンパ腫はLPL以外にも認められるため,診断上,注意が必要である。
LPL/WMの約4分の1は無症候性である。骨髄浸潤が高度である場合には,血球異常として貧血と血小板減少が認められる。また,IgM蛋白濃度が高値になると過粘稠度症候群をきたす。この場合,赤血球凝集に伴って,視力障害(眼底網膜静脈ソーセージ様変化)や脳血管障害を起こし得る。自己免疫疾患,寒冷凝集素症の合併や,クリオグロブリン血症,ミエリンに対する抗体活性によるミエリン融解が原因の末梢神経障害,アミロイドーシスを合併し得る。また,後天性von Willebrand病を合併し,凝固障害・出血症状を合併することがある。中枢神経に浸潤した場合Bing-Neel症候群と呼ばれる。
IgMが3 g/dL未満,骨髄中の腫瘍細胞の割合が10%未満で,かつ,症状のない場合,形質細胞腫瘍に準じて,IgM monoclonal gammopathy of undetermined significance(IgM-MGUS)と呼ぶが,non IgM-MGUSに比べて進展が速く,年に1〜5%がLPL/WM,その他のB細胞リンパ腫に進展する2)。
約90%の症例でMYD88L265P変異があり,約30%の症例でCXCR4遺伝子の変異がある2)。染色体異常として6番染色体長腕欠失(30〜50%)を認める。これらの異常は他のIgM産生リンパ腫との鑑別に有用である。
臨床経過は一般に緩徐であり,生存期間中央値は5〜10年以上である。症候性WMの予後予測の指標として,International Prognostic Scoring System for WM(IPSSWM)ならびにrevised IPSSWMが報告されている3)。revised IPSSWMは年齢(66〜75歳が1点,76歳以上が2点),β2ミクログロブリン>4mg/L,血清LDH>250 IU/L,血清アルブミン<3.5 g/dLによってスコア化され,5年生存割合は,スコア0が95%,1で86%,2で78%,3で78%,4〜5で36%であった。治療の効果判定には,第6回International Workshop on WM(IWWM)の判定規準が用いられており,臨床症状,血清IgM値,画像評価を組み合わせて評価する4)。
参考文献
1) Vijay A, et al. Waldenström macroglobulinemia. Blood. 2007; 109(12): 5096-103.(レビュー)
2) Swerdlow SH, et al. Lymphoplasmacytic Lymphoma. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, Lyon, IARC; 2017: pp232-5.(テキストブック)
3) Kastritis E, et al. A revised international prognostic score system for Waldenström’s macroglobulinemia. Leulemia. 2019; 33(11): 2654-61.(3iiiA)
4) Owen RG, et al. Response assessment in Waldenström macroglobulinaemia: update from the VIth International Workshop. Br J Haematol. 2013; 160(2): 171-6.(レビュー)
アルゴリズム
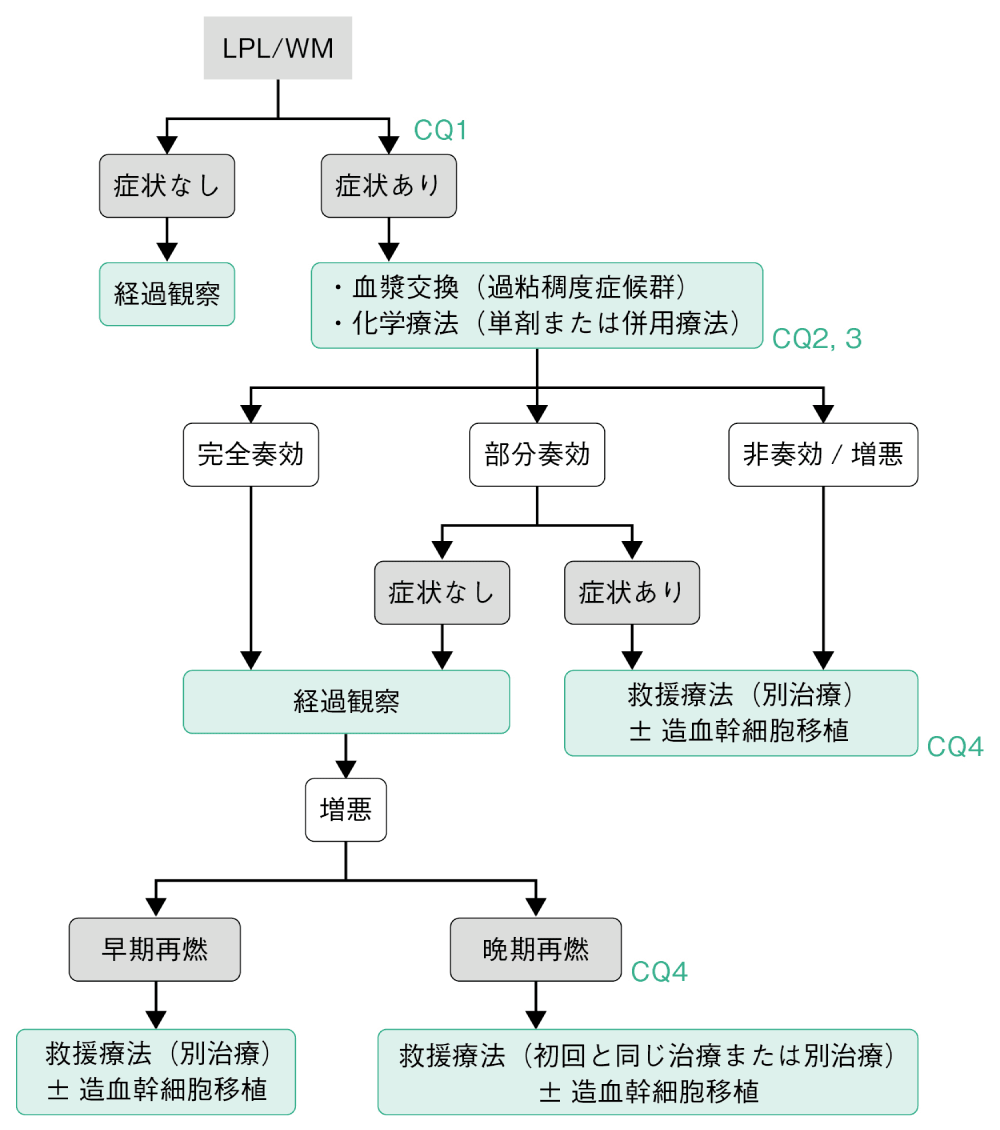
通常の化学療法では生存曲線は平坦化せず治癒は望めない1-3)。症状のない場合には,無治療で経過観察を行う。血球減少,全身症状,進行性リンパ節腫脹や肝脾腫などの症状がある場合,または,出現した場合には治療開始を考慮する(CQ1)3)。初回,および,再燃・再発時の化学療法としては,単剤としてリツキシマブ(R)やチラブルチニブ,併用療法としてR+アルキル化薬(DRC療法,R-CHOP療法),R+ベンダムスチン,R+ボルテゾミブ,R+イブルチニブが挙げられる(CQ2〜4)2)。至適初回レジメンは明らかではなく,症例ごとに検討する。自家造血幹細胞移植併用大量化学療法は,若年の高リスク患者や再発・再燃時の治療選択肢の一つとなり得るが,適応,実施時期,方法については未確立である(CQ4)1,2)。
参考文献
1) Vijay A, et al. Waldenström macroglobulinemia. Blood. 2007; 109(12): 5096-103.(レビュー)
2) Castillo JJ, et al. Consensus treatment recommendations from the tenth International Workshop for Waldenström Macroglobulinaemia. Lancet Haematol. 2020; 7: e827-37.(レビュー)
3) Dimopoulos MA, et al. Treatment recommendations for patients with Waldenström macroglobulinemia(WM)and related disorders: IWWM-7 consensus. Blood. 2014; 124(9): 1404-11.(レビュー)
CQ1 未治療WMに対してどの時点での治療開始が勧められるか
- 推奨グレード
- カテゴリー2A
WMに関連した臨床症状,合併症が出現した時点で治療を開始することが推奨される。
解説
未治療WMに対する治療介入は,全例に対して施行する必要はなく,WMに関連した臨床症状や合併症が認められる場合に治療介入を行う1-3)。血清IgM値はWMに伴う臨床症状と相関しない場合があり,血清IgM値のみを指標にして治療介入を決定するべきではない1,2)。治療介入を要する具体的な臨床症状としては,繰り返す発熱,寝汗,体重減少,全身倦怠感,進行性の症候性リンパ節腫脹,肝脾腫などである1-3)。また,WMの骨髄浸潤による正常造血の抑制に伴う貧血(Hb値10 g/dL以下),あるいは血小板減少(10 万/μL未満)を認める場合にも治療介入を考慮する。WMに関連した合併症として,過粘稠度症候群,寒冷凝集素症,症候性末梢神経障害,全身性アミロイドーシス,腎機能障害,症候性クリオグロブリン血症などが認められた症例も治療介入の対象である。
参考文献
1) Kyle RA, et al. Prognostic markers and criteria to initiate therapy in Waldenstrom’s macroglobulinemia: consensus panel recommendations from the Second International Workshop on Waldenstrom’s Macroglobulinemia. Semin Oncol. 2003; 30(2): 116-20.(レビュー)
2) Dimopoulos MA, et al. Treatment recommendations for patients with Waldenström macroglobulinemia(WM)and related disorders: IWWM-7 consensus. Blood. 2014; 124(9): 1404-11.(レビュー)
3) Leblond V, et al. Treatment recommendations from the Eighth International Workshop on Waldenström’s Macroglobulinemia. Blood. 2016; 128(10): 1321-8.(レビュー)
CQ2 症候性WMに対して血漿交換は勧められるか
- 推奨グレード
- カテゴリー1
症候性過粘稠度症候群を合併した場合,およびリツキシマブを含む治療前の血清IgM値が4,000mg/dL以上の場合においては血漿交換を実施し,その後速やかに化学療法を施行することが推奨される。
解説
症候性過粘稠度症候群を合併した場合においては,速やかに血漿交換を行うことが推奨される1,2)。また,リツキシマブ(R)を含む治療を行う場合は,治療前の血清IgM値が4,000mg/dL以上の症例においては,IgM flareを回避するために血漿交換を行う1-3)。血漿交換のみでは抗腫瘍効果は得られないため,速やかに化学療法を施行する必要がある1-6)。また,治療介入後のいかなる時期においても,症候性の過粘稠度症候群,クリオグロブリン血症,寒冷凝集素症の溶血発作を合併した際には,速やかに血漿交換を施行する3)。
参考文献
1) Leblond V, et al. Treatment recommendations from the Eighth International Workshop on Waldenström’s Macroglobulinemia. Blood. 2016; 128(10): 1321-8.(レビュー)
2) Padmanabhan A, et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice - Evidence-Based Approach from the Writing Committee of the American Society for Apheresis: The Eighth Special Issue. J Clin Apher. 2019; 34(3): 171-354.(ガイドライン)
3) Castillo JJ, et al. Consensus treatment recommendations from the tenth International Workshop for Waldenstr?m Macroglobulinaemia. Lancet Haematol. 2020; 7(11): e827-37.(レビュー)
4) Treon SP, et al. Paradoxical increases in serum IgM and viscosity levels following rituximab in Waldenstrom’s macroglobulinemia. Ann Oncol. 2004; 15(10): 1481-3.(3iiiD)
5) Ghobrial IM, et al. Initial immunoglobulin M ‘flare’ after rituximab therapy in patients diagnosed with Waldenstrom macroglobulinemia: an Eastern Cooperative Oncology Group Study. Cancer. 2004; 101(11): 2593-8.(3iiiD)
6) Treon SP, et al. Primary therapy of Waldenström macroglobulinemia with bortezomib, dexamethasone, and rituximab: WMCTG clinical trial 05-180. J Clin Oncol. 2009; 27(23): 3830-5.(3iiiDiv)
CQ3 未治療症候性WMに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
未治療症候性WMの初回治療としては,アルキル化薬,プロテアソーム阻害薬,抗体薬(リツキシマブ)の単剤または併用療法,BTK阻害薬が推奨される。
解説
未治療症候性WMに対しては,以下の治療法が推奨される1)。
単剤療法
・リツキシマブ(R)2)
・チラブルチニブ3)
併用療法
・R+アルキル化薬レジメン:DRC療法(DEX, R, CPA)4),R-CHOP療法(R, CPA, DXR,VCR, PSL)5)
・BR療法(BEN, R)6)
・BDR療法(BOR, DEX, R)7)
・R+イブルチニブ8-10)
上記の薬剤・治療レジメンにおけるランダム化比較試験の報告(iNNOVATE試験9,10),ASPEN試験11))は存在するものの,現時点において,どの薬剤・治療レジメンが安全性,治療効果に優れているかのコンセンサスは得られていない。治療期間や投与コース数が定まっているレジメンを用いるのか,BTK阻害薬のように増悪まで持続投与する治療法が優れているのか,についても結論は出ていない1)。
至適な初回治療レジメンは,毒性のプロファイルや治療期間,薬剤の投与経路などを勘案し,患者ごとに検討されるべきである1)。末梢神経障害のある場合では,ボルテゾミブやビンクリスチンを回避する1)。血清IgM値が4,000mg/dL以上の症例において,R単剤,あるいはR併用化学療法を施行する場合においては,IgM flareを回避するために速やかに血漿交換を行うともに,1コース目(状況によっては2コース目も)にはRの投与を控えることを考慮する1)。また,CQ2に示したように,治療介入後のいかなる時期においても,症候性の過粘稠度症候群,クリオグロブリン血症,寒冷凝集素症の溶血発作を合併した際には,速やかに血漿交換を施行する1)。
初回治療後のRの維持療法の意義に関しては,未確定である12,13)。
参考文献
1) Castillo JJ, et al. Consensus treatment recommendations from the tenth International Workshop for Waldenström Macroglobulinaemia. Lancet Haematol. 2020; 7(11): e827-37.(レビュー)
2) Dimopoulos MA, et al. Treatment of Waldenström’s macroglobulinemia with rituximab. J Clin Oncol. 2002; 20(9): 2327-33.(3iiiDiv)
3) Sekiguchi N, et al. A multicenter, open-label, phase II study of tirabrutinib (ONO/GS-4059)in patients with Waldenström’s macroglobulinemia. Cancer Sci. 2020; 111(9): 3327-37.(3iiiDiv)
4) Dimopoulos MA, et al. Primary treatment of Waldenström macroglobulinemia with dexamethasone, rituximab, and cyclophosphamide. J Clin Oncol. 2007; 25(22): 3344-9.(3iiiDiv)
5) Buske C, et al. The addition of rituximab to front-line therapy with CHOP(R-CHOP)results in a higher response rate and longer time to treatment failure in patients with lymphoplasmacytic lymphoma: results of a randomized trial of the German Low-Grade Lymphoma Study Group(GLSG). Leukemia. 2009; 23(1): 153-61.(1iiDiii)
6) Rummel MJ, et al. Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet. 2013; 381(9873): 1203-10.(1iiDiii)
7) Treon SP, et al. Primary therapy of Waldenström macroglobulinemia with bortezomib, dexamethasone, and rituximab: WMCTG clinical trial 05-180. J Clin Oncol. 2009; 27(23): 3830-5.(3iiiDiv)
8) Treon SP, et al. Ibrutinib Monotherapy in Symptomatic, Treatment-Naïve Patients With Waldenström Macroglobulinemia. J Clin Oncol. 2018; 36(27): 2755-61.(3iiiDiv)
9) Dimopoulos MA, et al. Phase 3 Trial of Ibrutinib plus Rituximab in Waldenström’s Macroglobulinemia. N Engl J Med. 2018; 378(25): 2399-410.(1iDiii)
10)Buske C, et al. Ibrutinib Plus Rituximab Versus Placebo Plus Rituximab for Waldenström’s Macroglobulinemia: Final Analysis From the Randomized Phase III iNNOVATE Study. J Clin Oncol. 2022; 40: 52-62.(1iDiii)
11)Tam CS, et al. A randomized phase 3 trial of zanubrutinib vs ibrutinib in symptomatic Waldenström macroglobulinemia: the ASPEN study. Blood. 2020; 136(18): 2038-50.(1iiDiv)
12)Castillo JJ, et al. Response and survival for primary therapy combination regimens and maintenance rituximab in Waldenström macroglobulinaemia. Br J Haematol. 2018; 181(1): 77-85.(3iii)
13)Rummel MJ, et al. Two Years Rituximab Maintenance Vs. Observation after First Line Treatment with Bendamustine Plus Rituximab(B-R)in Patients with Waldenström’s Macroglobulinemia(MW): Results of a Prospective, Randomized, Multicenter Phase 3 Study(the StiL NHL7-2008 MAINTAIN trial). Blood. 2019; 134(Supplement_1): 343.(1iiDiii)
CQ4 WMの再燃・再発時の救援療法にはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
初回治療後に再燃・再発した場合の救援療法として,抗体薬(リツキシマブ)の単剤,あるいはアルキル化薬,プロテアソーム阻害薬,BTK阻害薬,プリンアナログ, およびこれらの薬剤と抗体薬との併用療法が推奨される。
解説
再発・再燃のWMに対しては,抗体薬[リツキシマブ(R)]の単剤1),あるいはアルキル化薬,プロテアソーム阻害薬,BTK阻害薬2,3),プリンアナログ4), または抗体薬との併用療法5-9)が推奨される。しかし,初回治療と同様にランダム化比較試験が存在せず,どの薬剤・治療レジメンが安全性,治療効果に優れているかは明らかではなく,臨床試験への参加も選択肢になり得る。治療レジメンの選択に際しては,毒性のプロファイルや治療期間,薬剤の投与経路などを考慮し,患者ごとに検討されるべきである10)。
初回治療が奏効し,無治療期間が比較的長く続いた場合には,初回治療と同一の治療の再実施を考慮する。奏効期間が短い場合や抵抗性の場合は,初回治療とは異なる薬剤の単剤または併用療法が推奨される11, 12)。
自家造血幹細胞移植併用大量化学療法や同種造血幹細胞移植の有効性に関しては,一部の選択された症例に対しては治療選択肢となり得る可能性が示唆されている10, 13)。しかし,至適な対象症例や,タイミングについては未確立であり,臨床試験として実施することが望ましい。自家造血幹細胞移植併用大量化学療法が考慮される場合には,フルダラビンの使用を回避する10)。
参考文献
1) Dimopoulos MA, et al. Treatment of Waldenström’s macroglobulinemia with rituximab. J Clin Oncol. 2002; 20(9): 2327-33.(3iiiDiv)
2) Sekiguchi N, et al. A multicenter, open-label, phase II study of tirabrutinib (ONO/GS-4059)in patients with Waldenström’s macroglobulinemia. Cancer Sci. 2020; 111(9): 3327-37.(3iiiDiv)
3) Treon SP, et al. Ibrutinib in previously treated Waldenström’s macroglobulinemia. N Engl J Med. 2015; 372(15): 1430-40.(3iiiDiv)
4) Leblond V, et al. Results of a randomized trial of chlorambucil versus fludarabine for patients with untreated Waldenström macroglobulinemia, marginal zone lymphoma, or lymphoplasmacytic lymphoma. J Clin Oncol. 2013; 31(3): 301-7.(1iiDiv)
5) Dimopoulos MA, et al. Primary treatment of Waldenström macroglobulinemia with dexamethasone, rituximab, and cyclophosphamide. J Clin Oncol. 2007; 25(22): 3344-9.(3iiiDiv)
6) Buske C, et al. The addition of rituximab to front-line therapy with CHOP(R-CHOP)results in a higher response rate and longer time to treatment failure in patients with lymphoplasmacytic lymphoma: results of a randomized trial of the German Low-Grade Lymphoma Study Group(GLSG). Leukemia. 2009; 23(1): 153-61.(1iiDiii)
7) Treon SP, et al. Primary therapy of Waldenström macroglobulinemia with bortezomib, dexamethasone, and rituximab: WMCTG clinical trial 05-180. J Clin Oncol. 2009; 27(23): 3830-5.(3iiiDiv)
8) Dimopoulos MA, et al. Phase 3 Trial of Ibrutinib plus Rituximab in Waldenström’s Macroglobulinemia. N Engl J Med. 2018; 378(25): 2399-410.(1iDiii)
9) Treon SP, et al. Long-term outcomes to fludarabine and rituximab in Waldenström macroglobulinemia. Blood 2009; 113(16): 3673-8.(3iiiDiv)
10)Castillo JJ, et al. Consensus treatment recommendations from the tenth International Workshop for Waldenström Macroglobulinaemia. Lancet Haematol. 2020; 7(11): e827-37.(レビュー)
11)National Comprehiensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. Waldenstrom Macroglobulinemia/Lymphoplasmacytic Lymphoma. Version 2.2022. https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1475(ガイドライン)
12)Kastritis E, et al. Waldenström’s macroglobulinaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2018; 29(Suppl 4): iv41-50.(ガイドライン)
13)Parrondo RD, et al. Efficacy of Autologous and Allogeneic Hematopoietic Cell Transplantation in Waldenström Macroglobulinemia: A Systematic Review and Meta-analysis. Clin Lymphoma Myeloma Leuk. 2020; 20(10): e694-711.(1iA)

