第Ⅱ章 リンパ腫
Ⅱ リンパ腫
2 辺縁帯リンパ腫[節外性辺縁帯リンパ腫(粘膜関連リンパ組織型節外性辺縁帯リンパ腫),節性辺縁帯リンパ腫および脾辺縁帯リンパ腫を含む]
marginal zone lymphoma:MZL[extranodal marginal zone lymphoma:EMZL (extranodal marginal zone lymphoma of mucosa associated lymphoid tissue),nodal marginal zone lymphoma:NMZL,splenic marginal zone lymphoma:SMZL]
総論
辺縁帯リンパ腫(marginal zone lymphoma:MZL)はWHO分類(2022)1)にて節外性辺縁帯リンパ腫[extranodal marginal zone lymphoma of mucosa associated lymphoid tissue(MALT lymphoma):EMZL],節性辺縁帯リンパ腫(nodal marginal zone lymphoma:NMZL),脾辺縁帯リンパ腫(splenic marginal zone lymphoma:SMZL)に分類されており,共通する特徴として診断後の経過が緩徐でありインドレントリンパ腫の1病型と位置付けられている。MZLの形質を有するクローナルB細胞リンパ増殖性疾患がMZLへと進展することが近年報告されている2)。
EMZL,SMZL,NMZLは形態学的特徴およびフェノタイプは近似しているが臨床像および分子遺伝学的特徴などは異なっているもののNF-κ B,NOTCH活性化の関与が大きいとされている3)。IRTA-1発現,T-bet発現,t(11;18)(q21;q21)BIRC3/MALT1,t(14;18)(q32;q21)IGH/MALT1,t(1;14)(p22;q32)BCL10/IGH,およびt(3;14)(p14.1;q32)FOXP1/IGHはEMZLに関連している3,4)。IRTA-1発現,T-bet発現はNMZLにも関連している3,5)。KLF2変異,NOTCH2変異はNMZL,SMZLに関連している3,6)。
米国におけるSurveillance,Epidemiology,and End Results(SEER)データベースを用いた疫学調査7)によると人口10万人あたりの罹患数はEMZL,NMZL,SMZLの順に多く,各1.59,0.83,0.25であった。B細胞リンパ腫における割合はEMZL,NMZL,SMZLは各5%,2.4%,0.7%であった。NMZLと診断する際には粘膜関連リンパ組織に病変がないことのスクリーニングを十分に行う必要がある。EMZL,NMZL,SMZLのリンパ腫補正10年生存率は各84.7%,67.3%,62.7%であった。
EMZLは胃,眼付属器,小腸,大腸,肺,唾液腺,甲状腺,乳腺などの粘膜関連リンパ組織から発生するが,最も頻度が高いのは胃である7)。唾液腺,甲状腺を除きEMZLは男性に多い,これは女性において罹患が多いシェーグレン症候群や橋本病などを背景としてEMZLが発症していることと関連している8)。胃におけるHelicobacter pylori,眼付属器におけるChlamydia psittaci 9),小腸におけるCampylobacter jejuni 10)など細菌感染による炎症がEMZLの発生に関連していることが報告されている。H. pylori 胃炎に対して除菌が広く行われた結果,胃EMZLは米国において減少している11)。
2017年にEMZLにおける予後指標としてMALT-IPIが提唱された12)。これは401例が登録されたIELSG-19試験13)の主要評価項目であるEFSにおいて検討された。MALT-IPIは①病期Ⅲ期以上,②年齢70歳以上,③施設上限値を超えるLDH値,の3つの予後不良因子からなり,因子数によって3つのグループに分けられる。項目なしがLowリスク,1項目がIntermediateリスク,2~3項目がHighリスクとされた。5年EFSにおいてLowリスク群,Intermediateリスク群,Highリスク群は各70%,56%,29%であり,予後の層別化が示された。OSにおいてはLowリスク群とIntermediateリスク群は近接しているがHighリスク群とは明瞭に層別化された(p<0.0001)。Lowリスク群に対するHighリスク群のハザード比(HR)はEFSが3.3に対してOSは13.7であった。同様にIELSG-19試験のデータセットを用いた解析にて化学療法後24カ月以内に増悪した早期増悪群は有意に10年OSが不良であった(48% vs. 71%,HR 2.15,95% CI 1.19-3.90)14)。SMZLのリスク層別化の報告15,16)はあるが,NMZLについてはない。
参考文献
1) Alaggio R, et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Leukemia. 2022; 36(7): 1720-48.
2) Xochelli A, et al. Clonal B-cell lymphocytosis exhibiting immunophenotypic features consistent with a marginal-zone origin: is this a distinct entity? Blood. 2014; 123(8): 1199-206.
3) Rossi D, et al. Marginal-Zone Lymphomas. N Engl J Med. 2022; 386(6): 568-81.
4) Zucca E, et al. The spectrum of MALT lymphoma at different sites: biological and therapeutic relevance. Blood. 2016; 127(17): 2082-92.
5) Bob R, et al. Nodal reactive and neoplastic proliferation of monocytoid and marginal zone B cells: an immunoarchitectural and molecular study highlighting the relevance of IRTA1 and T-bet as positive markers. Histopathology. 2013; 63(4): 482-98.
6) Arcaini L, et al. Splenic marginal zone lymphoma: from genetics to management. Blood. 2016; 127(17): 2072-81.
7) Olszewski AJ, et al. Survival of patients with marginal zone lymphoma: analysis of the Surveillance, Epidemiology, and End Results database. Cancer. 2013; 119(3): 629-38.
8) Cerhan JR, et al. Epidemiology of Marginal Zone Lymphoma. Ann Lymphoma. 2021; 5: 1.
9) Collina F, et al. Chlamydia psittaci in ocular adnexa MALT lymphoma: a possible role in lymphomagenesis and a different geographical distribution. Infect Agent Cancer. 2012; 7: 8.
10)Al-Saleem T, et al. Immunoproliferative small intestinal disease(IPSID): a model for mature B-cell neoplasms. Blood. 2005; 105(6): 2274-80.
11)Khalil MO, et al. Incidence of marginal zone lymphoma in the United States, 2001-2009 with a focus on primary anatomic site. Br J Haematol. 2014; 165(1): 67-77.
12)Thieblemont C, et al. A MALT lymphoma prognostic index. Blood. 2017; 130(12): 1409-17.
13)Zucca E, et al. Final Results of the IELSG-19 Randomized Trial of Mucosa-Associated Lymphoid Tissue Lymphoma: Improved Event-Free and Progression-Free Survival With Rituximab Plus Chlorambucil Versus Either Chlorambucil or Rituximab Monotherapy. J Clin Oncol. 2017; 35(17): 1905-12.(1iiDi)
14)Conconi A, et al. Early progression of disease predicts shorter survival in MALT lymphoma patients receiving systemic treatment. Haematologica. 2020; 105(11): 2592-7.
15)Montalbán C, et al. Risk stratification for Splenic Marginal Zone Lymphoma based on haemoglobin concentration, platelet count, high lactate dehydrogenase level and extrahilar lymphadenopathy: development and validation on 593 cases. Br J Haematol. 2012; 159(2): 164-71.
16)Montalban C, et al. Simplification of risk stratification for splenic marginal zone lymphoma: a point-based score for practical use. Leuk Lymphoma. 2014; 55(4): 929-31.
アルゴリズム
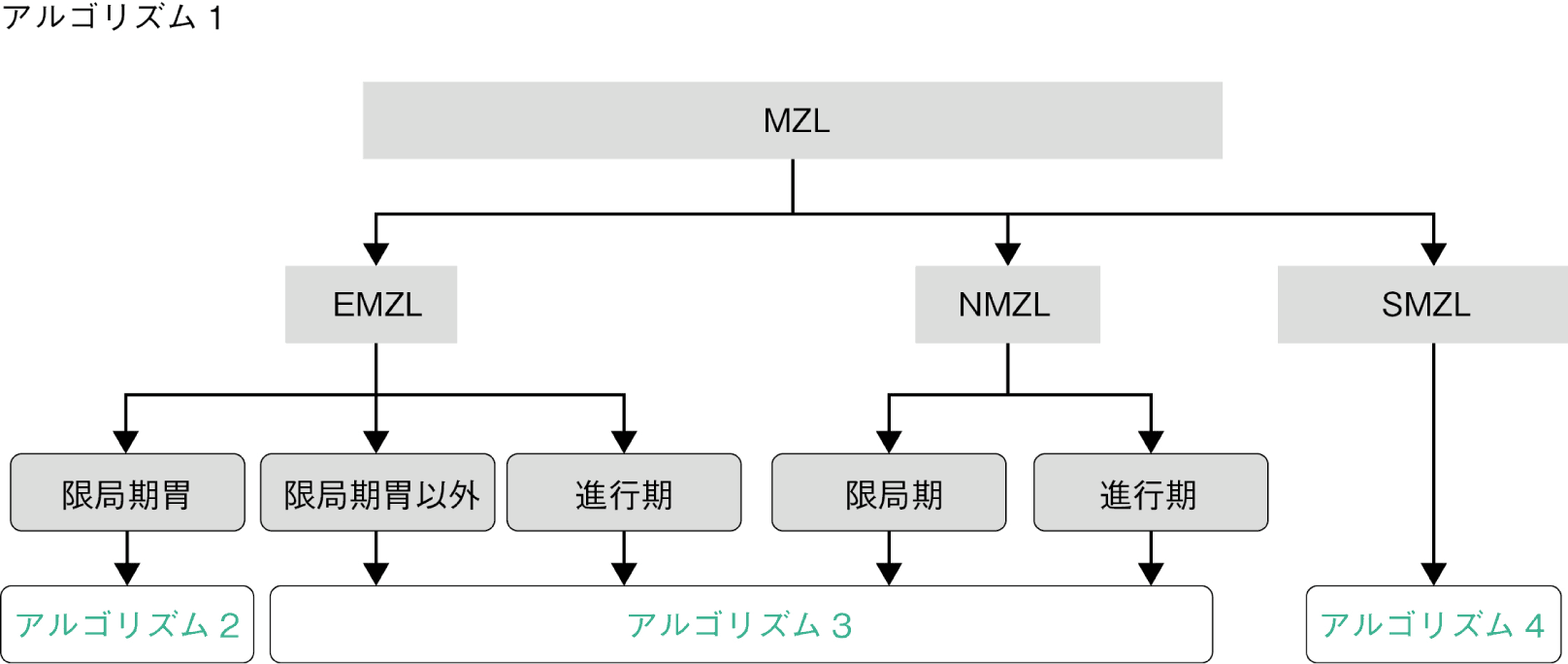
アルゴリズム1
アルゴリズム2,3,4へとつながるMZL全体のアルゴリズムを示す。
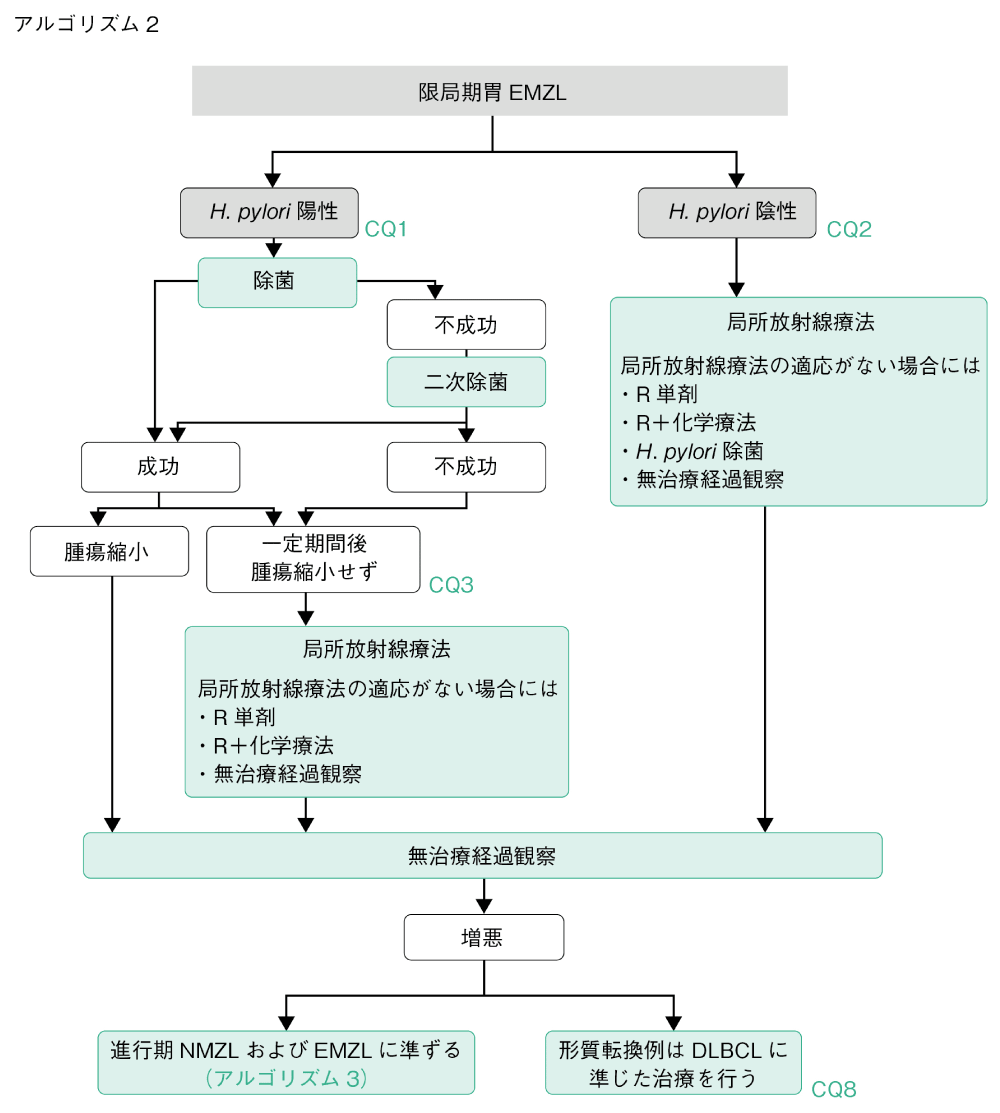
アルゴリズム2
限局期胃EMZLにおいてはH. pyloriの有無により治療アルゴリズムが決定される。H. pylori陽性の場合の初回治療として除菌が推奨される1)(CQ1)。陰性の場合の初回治療として局所放射線療法が推奨される2)(CQ2)。除菌後に効果が不十分な場合には,局所放射線療法が推奨される2)(CQ3)。
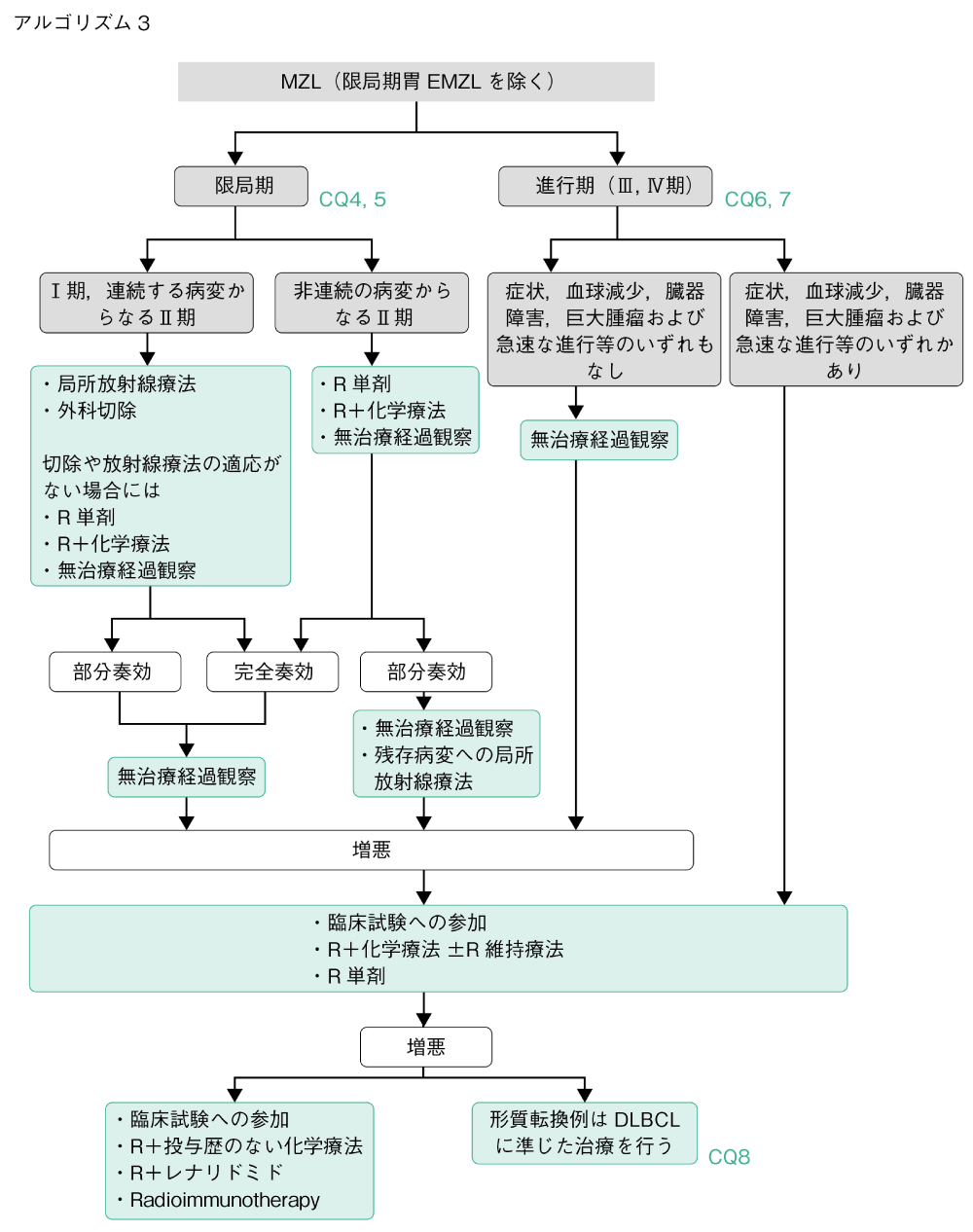
アルゴリズム3
胃以外の限局期EMZL,限局期NMZLの初回治療として局所放射線療法が推奨される3)(CQ4,5)。胃以外の進行期EMZL,進行期NMZLに対して化学療法が生存期間の改善に寄与したエビデンスは示されてない4-6)。したがって,症状や臓器障害がない場合には無治療経過観察が推奨される(CQ6,7)。MZLがびまん性大細胞型リンパ腫へ形質転換した場合には,後方視的解析しか報告がないものの,R-CHOP療法(R,CPA,DXR,VCR,PSL)をはじめとするびまん性大細胞型リンパ腫に準じた治療が推奨される7)(CQ8)。
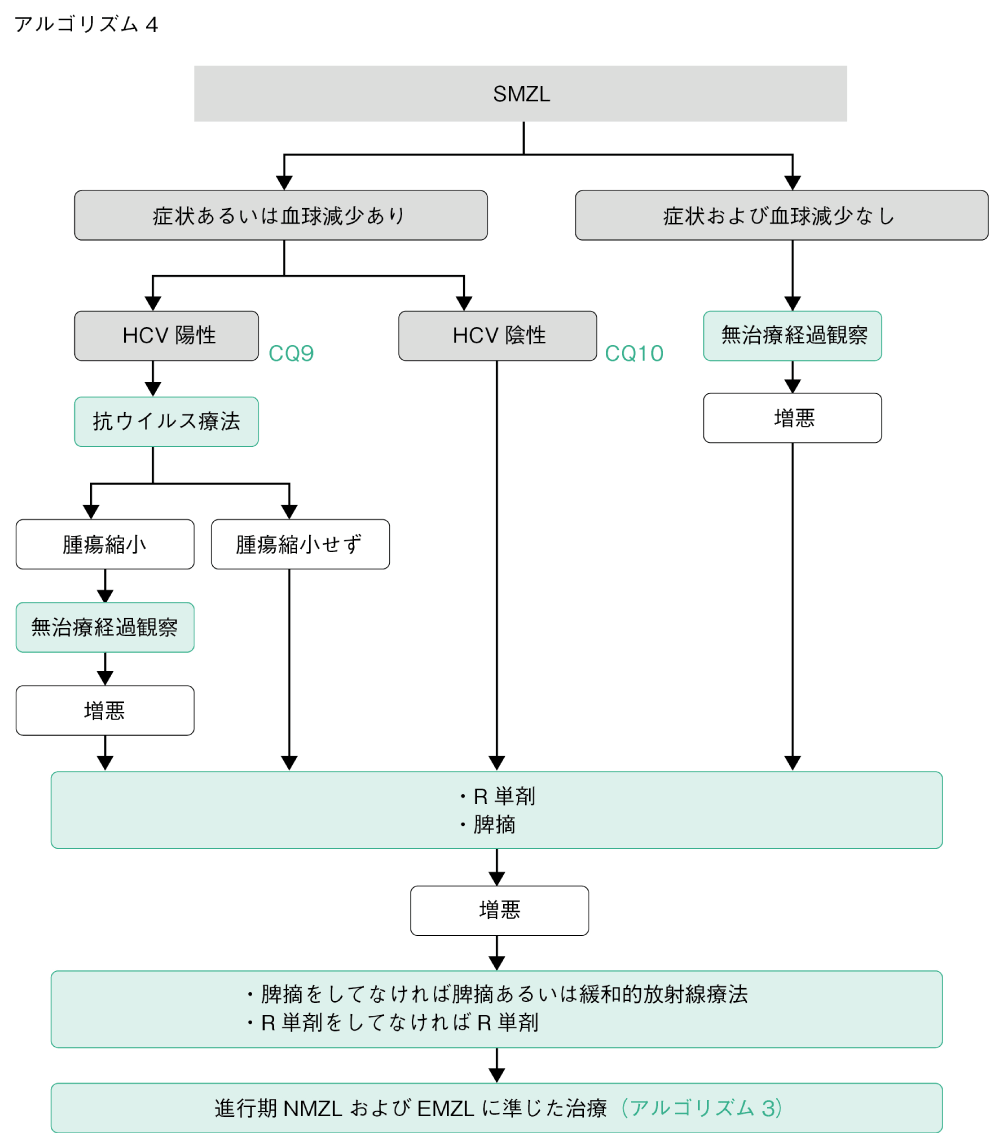
アルゴリズム4
SMZLは症状を有する場合および血球減少を呈する場合に治療対象となる。HCV感染がある場合には,HCVに対する抗ウイルス療法が初回治療として推奨される8)(CQ9)。HCV感染がない場合は,リツキシマブ(R)単剤療法あるいは脾臓摘出が推奨される9)(CQ10)。
参考文献
1) Wotherspoon AC, et al. Regression of primary low-grade B-cell gastric lymphoma of mucosa-associated lymphoid tissue type after eradication of Helicobacter pylori. Lancet 1993; 342(8871): 575-7.(3iiiDiv)
2) Teckie S, et al. Long-term outcome of 487 patients with early-stage extra-nodal marginal zone lymphoma. Ann Oncol 2017; 28(5): 1064-9.(3iiiA)
3) Hoskin P, et al. 4 Gy versus 24 Gy radiotherapy for follicular and marginal zone lymphoma(FoRT): long-term follow-up of a multicentre, randomised, phase 3, non-inferiority trial. Lancet Oncol 2021; 22(3): 332-40.(1iiDiii)
4) Rummel MJ, et al. Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 2013; 381(9873): 1203-10.(1iiDiii)
5) Zucca E, et al. Final Results of the IELSG-19 Randomized Trial of Mucosa-Associated Lymphoid Tissue Lymphoma: Improved Event-Free and Progression-Free Survival With Rituximab Plus Chlorambucil Versus Either Chlorambucil or Rituximab Monotherapy. J Clin Oncol 2017; 35(17): 1905-12.(1iiDi)
6) Flinn IW, et al. First-Line Treatment of Patients With Indolent Non-Hodgkin Lymphoma or Mantle-Cell Lymphoma With Bendamustine Plus Rituximab Versus R-CHOP or R-CVP: Results of the BRIGHT 5-Year Follow-Up Study. J Clin Oncol 2019; 37(12): 984-91.(1iiDiv)
7) Alderuccio JP, et al. Risk Factors for Transformation to Higher-Grade Lymphoma and Its Impact on Survival in a Large Cohort of Patients With Marginal Zone Lymphoma From a Single Institution. J Clin Oncol 2018: JCO1800138.(3iiiDiv)
8) Hermine O, et al. Regression of splenic lymphoma with villous lymphocytes after treatment of hepatitis C virus infection. N Engl J Med 2002; 347(2): 89-94.(3iiiDiv)
9) Kalpadakis C, et al. Treatment of splenic marginal zone lymphoma with rituximab monotherapy: progress report and comparison with splenectomy. Oncologist 2013; 18(2): 190-7.(3iiiDiv)
CQ1 初発H. pylori陽性限局期胃EMZLにはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
初発H. pylori 陽性限局期胃EMZLにはH. pylori除菌療法が推奨される。
解説
胃EMZLの発症にはH. pylori感染による慢性胃炎が一因であり,H. pyloriの除菌によってEMZLを寛解させることができる1)。したがって,H. pyloriの感染を伴う限局期胃EMZLはH. pylori除菌が有効であり,胃生検標本の検鏡でH. pyloriが検出できない場合は,尿素呼気試験や抗体検査など非侵襲的検査で検出を試みる。胃原発のEMZLで消化管Lugano病期分類が限局期のH. pylori陽性の場合では除菌療法を推奨する。胃切除術は侵襲性や再発率が高くH. pylori陽性限局期胃EMZLには推奨されない。H. pylori除菌にはプロトンポンプ阻害薬とクラリスロマイシンおよびアモキシシリン(またはメトロニダゾール)の併用が行われる。初回除菌療法後6週間以降に尿素呼気試験を行い,除菌の効果を判定する。除菌不成功であれば二次除菌を行う2)。除菌の成功率は90%以上であり,EMZLのCR 70~80%で達成される3-9)。H. pylori陽性限局期胃EMZLは予後良好であり,90%以上の症例が長期生存を示す4,6,7,10)。腫瘍細胞がt(11;18)の染色体転座(API2-MALT1転座)を有する症例,腫瘍が粘膜下層へ進展している症例では除菌による奏効割合が低い5,11)。除菌から寛解までの期間は数週間~1年以上と報告されており,寛解まで長期間かかる症例も存在する10,12,13)。そのため,除菌成功後にリンパ腫病変が残存する場合も注意深く胃内視鏡検査でフォローすることが肝要である。寛解を達成したあとは定期的に内視鏡検査を行い,再発の有無を確認する。32件の報告をまとめた胃EMZL 1,408例のシステマティックレビューでは,除菌療法後の再発率は年2.2%と報告されている5)。
参考文献
1) Wotherspoon AC, et al. Regression of primary low-grade B-cell gastric lymphoma of mucosa-associated lymphoid tissue type after eradication of Helicobacter pylori. Lancet. 1993; 342(8871): 575-7.(3iiiDiv)
2) Asaoka D, et al. Trends of second-line eradication therapy for Helicobacter pylori in Japan: a multicenter study in the Tokyo metropolitan area. Helicobacter. 2013; 18(6): 468-72.(3iiDiv)
3) Schmelz R, et al. Sequential H. pylori eradication and radiation therapy with reduced dose compared to standard dose for gastric MALT lymphoma stages IE & II1E: a prospective randomized trial. J Gastroenterol. 2019; 54(5): 388-95.(3iiiDiv)
4) Nakamura S, et al. Long-term clinical outcome of gastric MALT lymphoma after eradication of Helicobacter pylori: a multicentre cohort follow-up study of 420 patients in Japan. Gut. 2012; 61(4): 507-13.(3iiiA)
5) Zullo A, et al. Effects of Helicobacter pylori eradication on early stage gastric mucosa-associated lymphoid tissue lymphoma. Clin Gastroenterol Hepatol. 2010; 8(2): 105-10.(レビュー)
6) Stathis A, et al. Long-term outcome following Helicobacter pylori eradication in a retrospective study of 105 patients with localized gastric marginal zone B-cell lymphoma of MALT type. Ann Oncol. 2009; 20(6): 1086-93.(3iiiA)
7) Andriani A, et al. Management and long-term follow-up of early stage H. pylori-associated gastric MALT-lymphoma in clinical practice: an Italian, multicentre study. Dig Liver Dis. 2009; 41(7): 467-73.(3iiiA)
8) Chen LT, et al. Long-term results of anti-Helicobacter pylori therapy in early-stage gastric high-grade transformed MALT lymphoma. J Natl Cancer Inst. 2005; 97(18): 1345-53.(3iiiA)
9) Steinbach G, et al. Antibiotic treatment of gastric lymphoma of mucosa-associated lymphoid tissue. An uncontrolled trial. Ann Intern Med. 1999; 131(2): 88-95.(3iiiDiv)
10)Wündisch T, et al. Long-term follow-up of gastric MALT lymphoma after Helicobacter pylori eradication. J Clin Oncol. 2005; 23(31): 8018-24.(3iiiA)
11)Liu H, et al. T(11;18)is a marker for all stage gastric MALT lymphomas that will not respond to H. pylori eradication. Gastroenterology. 2002; 122(5): 1286-94.(3iiiDiv)
12)Bertoni F, et al. Molecular follow-up in gastric mucosa-associated lymphoid tissue lymphomas: early analysis of the LY03 cooperative trial. Blood. 2002; 99(7): 2541-4.(1iiDiii)
13)Montalban C, et al. Treatment of low grade gastric mucosa-associated lymphoid tissue lymphoma in stage I with Helicobacter pylori eradication. Long-term results after sequential histologic and molecular follow-up. Haematologica. 2001; 86(6): 609-17.(3iiiDiv)
CQ2 初発H. pylori陰性限局期胃EMZLにはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
初発H. pylori陰性限局期胃EMZLには局所放射線治療(ISRT 24~30Gy)が推奨される。
解説
H. pyloriの感染を伴う限局期胃EMZLはH. pylori除菌が有効であるため,H. pyloriの感染の有無を十分に検索することが治療決定に重要である。胃生検標本の検鏡でH. pyloriが検出できない場合は,尿素呼気試験や抗体検査など非侵襲的検査で検出を試みる。侵襲的検査と非侵襲的検査のいずれの方法においてもH. pyloriが陰性の限局期胃EMZLには局所放射線治療(involved-site radiation therapy:ISRT)24~30Gyが推奨される。ただし,胃のような臓器の節外性リンパ腫では,その臓器全体を照射野に含めるのが原則である。放射線治療により95%以上の奏効割合1-3)が期待できる。放射線治療後の再発の多くは照射野外4)であり,放射線治療は良好な局所制御が期待できる。放射線治療を施行したH. pylori陰性を含む限局期胃EMZLの長期予後は良好であり,90%以上の5年OS2,5,6)と,70~90%の10年OSが期待できる1,7-9)。放射線治療が適応とならない例ではリツキシマブ(R)単剤療法が選択肢である。H. pylori除菌後残存もしくはH. pylori陰性胃EMZLにR単剤療法を行った報告では全奏効率は70~80%と報告されている10,11)。放射線治療もしくはR単剤療法を施行後,初回評価を3カ月後,その後は3~6カ月後に内視鏡を再検し,CRが確認できれば経過観察を行う。EMZLの残存を認めた場合は,免疫化学療法の施行を検討する。
参考文献
1) Yahalom J, et al. Involved-site radiotherapy for Helicobacter pylori-independent gastric MALT lymphoma: 26 years of experience with 178 patients. Blood Adv. 2021; 5(7): 1830-6.(3iiiA)
2) Teckie S, et al. Long-term outcome of 487 patients with early-stage extra-nodal marginal zone lymphoma. Ann Oncol. 2017; 28(5): 1064-9.(3iiiA)
3) Goda JS, et al. Long-term outcome in localized extranodal mucosa-associated lymphoid tissue lymphomas treated with radiotherapy. Cancer. 2010; 116(16): 3815-24.(3iiiA)
4) Tsang RW, et al. Localized mucosa-associated lymphoid tissue lymphoma treated with radiation therapy has excellent clinical outcome. J Clin Oncol. 2003; 21(22): 4157-64.(3iiiA)
5) Nam H, et al. Long-Term Clinical Outcome and Predictive Factors for Relapse after Radiation Therapy in 145 Patients with Stage I Gastric B-Cell Lymphoma of Mucosa-Associated Lymphoid Tissue Type. Cancers(Basel). 2021; 13(2): 169.(3iiiA)
6) Ruskoné-Fourmestraux A, et al. Exclusive moderate-dose radiotherapy in gastric marginal zone B-cell MALT lymphoma: Results of a prospective study with a long term follow-up. Radiother Oncol. 2015; 117(1): 178-82.(3iiiA)
7) Fang P, et al. A Prospective Trial of Radiation Therapy Efficacy and Toxicity for Localized Mucosa-associated Lymphoid Tissue(MALT)Lymphoma. Int J Radiat Oncol Biol Phys. 2021; 109(5): 1414-20.(3iiiDi)
8) Wirth A, et al. Long-term outcome for gastric marginal zone lymphoma treated with radiotherapy: a retrospective, multi-centre, International Extranodal Lymphoma Study Group study. Ann Oncol. 2013; 24(5): 1344-51.(3iiiA)
9) Vrieling C, et al. Long-term results of stomach-conserving therapy in gastric MALT lymphoma. Radiother Oncol. 2008; 87(3): 405-11.(3iiiB)
10)Conconi A, et al. Clinical activity of rituximab in extranodal marginal zone B-cell lymphoma of MALT type. Blood. 2003; 102(8): 2741-5.(3iiiDiv)
11)Martinelli G, et al. Clinical activity of rituximab in gastric marginal zone non-Hodgkin’s lymphoma resistant to or not eligible for anti-Helicobacter pylori therapy. J Clin Oncol. 2005; 23(9): 1979-83.(3iiiDiv)
CQ3 初発H. pylori陽性限局期胃EMZLに対しH. pylori除菌後にリンパ腫の残存がみられる場合にはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
H. pylori除菌後にリンパ腫の進行がみられる場合には,ISRT 24~30Gyを推奨する。
解説
H. pylori陽性限局期胃EMZLではH. pylori除菌が第一選択となる。除菌した症例の20~30%は除菌が不成功もしくは寛解後に再発をきたす1-4)。除菌後3カ月時点でH. pyloriが陽性の場合は二次除菌を試みる。H. pylori除菌から寛解までの期間は数週間~1年以上と報告されており,寛解まで長期間かかる症例も存在する5-7)。そのため,除菌成功後もEMZLの残存がみられる無症状例では,3カ月ごとに胃内視鏡検査を繰り返し施行し,病変の消失に至るかどうか注意深く観察することが可能である。症状を有するEMZL残存症例,病勢の進行がある症例,再発症例ではISRT 24~30Gyが推奨される8-10)。放射線治療の適応とならない症例は,リツキシマブ(R)単剤療法11)もしくは進行期に準じて免疫化学療法が推奨される。
参考文献
1) Schmelz R, et al. Sequential H. pylori eradication and radiation therapy with reduced dose compared to standard dose for gastric MALT lymphoma stages IE & II1E: a prospective randomized trial. J Gastroenterol. 2019; 54(5): 388-95.(3iiiDiv)
2) Nakamura S, et al. Long-term clinical outcome of gastric MALT lymphoma after eradication of Helicobacter pylori: a multicentre cohort follow-up study of 420 patients in Japan. Gut. 2012; 61(4): 507-13.(3iiiA)
3) Zullo A, et al. Effects of Helicobacter pylori eradication on early stage gastric mucosa-associated lymphoid tissue lymphoma. Clin Gastroenterol Hepatol. 2010; 8(2): 105-10.(レビュー)
4) Stathis A, et al. Long-term outcome following Helicobacter pylori eradication in a retrospective study of 105 patients with localized gastric marginal zone B-cell lymphoma of MALT type. Ann Oncol. 2009; 20(6): 1086-93.(3iiiA)
5) Wündisch T, et al. Long-term follow-up of gastric MALT lymphoma after Helicobacter pylori eradication. J Clin Oncol. 2005; 23(31): 8018-24.(3iiiA)
6) Bertoni F, et al. Molecular follow-up in gastric mucosa-associated lymphoid tissue lymphomas: early analysis of the LY03 cooperative trial. Blood. 2002; 99(7): 2541-4.(1iiDiii)
7) Montalban C, et al. Treatment of low grade gastric mucosa-associated lymphoid tissue lymphoma in stage I with Helicobacter pylori eradication. Long-term results after sequential histologic and molecular follow-up. Haematologica. 2001; 86(6): 609-17.(3iiiDiv)
8) Yahalom J, et al. Involved-site radiotherapy for Helicobacter pylori-independent gastric MALT lymphoma: 26 years of experience with 178 patients. Blood Adv. 2021; 5(7): 1830-6.(3iiiA)
9) Teckie S, et al. Long-term outcome of 487 patients with early-stage extra-nodal marginal zone lymphoma. Ann Oncol 2017; 28(5): 1064-9.(3iiiA)
10)Goda JS, et al. Long-term outcome in localized extranodal mucosa-associated lymphoid tissue lymphomas treated with radiotherapy. Cancer. 2010; 116(16): 3815-24.(3iiiA)
11)Conconi A, et al. Clinical activity of rituximab in extranodal marginal zone B-cell lymphoma of MALT type. Blood 2003; 102(8): 2741-5.(3iiiDiv)
CQ4 胃以外の初発限局期EMZLにはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
局所制御として放射線療法が推奨される。局所制御を要しないあるいは放射線療法の適応とならない場合にはリンパ腫による症状や臓器障害が出現するまでの経過観察は妥当と考えられる。
解説
限局期EMZLに対する臨床試験の多くは放射線治療に関するものである。第Ⅱ相試験1-4)および第Ⅲ相試験が報告されているが,第Ⅲ相試験に関してはインドレントリンパ腫のなかにMZLが含まれた内容となっている。総照射線量40~45Gyを標準群として24Gyと比較した第Ⅲ相試験においては局所再発率,OSに差を認めなかった5)。また,総照射線量24Gy(12分割)を標準群として4Gy(2分割)と比較した第Ⅲ相試験において4Gy群は24Gy群に対して劣っていた(HR 3.42,95%CI 2.09-5.55,p<0.0001)6)。5年の局所無増悪率は24Gy群89.9%,4Gy群で70.4%であった(HR 3.46,95%CI 2.25-5.33,p<0.0001)。MZLに限った解析では,5年の局所無増悪率は24Gyで100%,4Gyで88%であり24Gyで良好な結果であった(p=0.015)7)。
胃を含む限局期の解析となるが,米国のSEERデータベースを用いた7,961例の後方視的研究では10年生存率はそれぞれ放射線療法のみ75.7%,手術のみ70%,化学療法のみ64%,経過観察62.6%,手術と放射線療法82.1%,手術と化学療法および放射線療法81.0%であった。単変量解析にて手術と放射線療法は放射線単独と比べて予後良好であった(HR 0.77,95%CI 0.64-0.93,p=0.005)。化学療法を追加することの有益性は確認されなかった。後方視的研究の単変量解析の結果のみを用いて放射線単独よりも手術と放射線療法が真に有望な治療であるかどうかを判断することは困難である8)。
化学療法を含むランダム化比較試験が1件報告されている。限局期のみでなく進行期を多数例含む研究にとどまっている9)。
なお,胃EMZLにおいては有効とされているH. pylori の除菌であるが,胃以外のEMZLを対象とした前方視的試験において有意な結果は示されていない10)。
参考文献
1) MacManus MP, et al. Prospective Phase II trial of radiation therapy in localised non-gastric marginal zone lymphoma with prospective evaluation of autoimmunity and Helicobacter pylori status: TROG 05.02/ALLG NHL15. Eur J Cancer. 2021; 152 : 129-38.(3iiDiii)
2) Aviles A, et al. Low-dose radiotherapy(2x2 g)versus low doses and rituximab in the treatment of marginal zone b-cell lymphoma previously untreated. Leuk Res 2020; 98: 106443.(1iiDiii)
3) Fang P, et al. A Prospective Trial of Radiation Therapy Efficacy and Toxicity for Localized Mucosa-associated Lymphoid Tissue(MALT)Lymphoma. Int J Radiat Oncol Biol Phys. 2021; 109(5): 1414-20.(3ii-Dii)
4) Isobe K, et al. A multicenter phase II study of local radiation therapy for stage IEA mucosa-associated lymphoid tissue lymphomas: a preliminary report from the Japan Radiation Oncology Group(JAROG). Int J Radiat Oncol Biol Phys. 2007; 69(4): 1181-6.(3iiA)
5) Lowry L, et al. Reduced dose radiotherapy for local control in non-Hodgkin lymphoma: a randomised phase III trial. Radiother Oncol. 2011; 100(1): 86-92.(1iiDiv)
6) Hoskin PJ, et al. 4 Gy versus 24 Gy radiotherapy for patients with indolent lymphoma(FORT): a randomised phase 3 non-inferiority trial. Lancet Oncol. 2014; 15(4): 457-63.(1iiDiii)
7) Hoskin P, et al. 4 Gy versus 24 Gy radiotherapy for follicular and marginal zone lymphoma(FoRT): long-term follow-up of a multicentre, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2021; 22(3): 332-40.(1iiDiii)
8) Alderuccio JP, et al. Treatments and Outcomes in Stage I Extranodal Marginal Zone Lymphoma in the United States. Cancers(Basel). 2021; 13(8): 1803.(3iA)
9) Zucca E, et al. Final Results of the IELSG-19 Randomized Trial of Mucosa-Associated Lymphoid Tissue Lymphoma: Improved Event-Free and Progression-Free Survival With Rituximab Plus Chlorambucil Versus Either Chlorambucil or Rituximab Monotherapy. J Clin Oncol. 2017; 35(17): 1905-12.(1iiDi)
10)Grünberger B, et al. Antibiotic treatment is not effective in patients infected with Helicobacter pylori suffering from extragastric MALT lymphoma. J Clin Oncol. 2006; 24(9): 1370-5.(3iiDiv)
CQ5 初発限局期NMZLにはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
局所制御として放射線療法が推奨される。局所制御を要しないあるいは放射線療法の適応とならない場合にはリンパ腫による症状や臓器障害が出現するまでの経過観察は妥当と考えられる。
解説
EMZLよりもさらに発症頻度が低いためにNMZLに関するエビデンスは極めて限られたものとなっている。限局期NMZLのみを対象とした前方視的試験は報告されていない。
インドレントリンパ腫のなかにMZLが含まれた第Ⅲ相試験では,総照射線量40~45Gyを標準群として24Gyと比較した第Ⅲ相試験においては局所再発率,OSに差を認めなかった1)。また,総照射線量24Gy(12分割)を標準群として4Gy(2分割)と比較した第Ⅲ相試験において4Gy群は24Gy群に対して劣っていた(HR 3.42,95%CI 2.09-5.55,p<0.0001)2)。5年の局所無増悪率は24Gy群89.9%,4Gy群で70.4%であった(HR 3.46,95%CI 2.25-5.33,p<0.0001)。MZLに限った解析では5年の局所無増悪率は24 Gyで100%,4Gyで88%であり,24Gyで良好な結果であった(p=0.015)ただし,MZLのなかでの節外性と節性の割合について記載はされてない3)。
参考文献
1) Lowry L, et al. Reduced dose radiotherapy for local control in non-Hodgkin lymphoma: a randomised phase III trial. Radiother Oncol. 2011; 100(1): 86-92.(1iiDiv)
2) Hoskin PJ, et al. 4 Gy versus 24 Gy radiotherapy for patients with indolent lymphoma(FORT): a randomised phase 3 non-inferiority trial. Lancet Oncol. 2014; 15(4): 457-63.(1iiDiii)
3) Hoskin P, et al. 4 Gy versus 24 Gy radiotherapy for follicular and marginal zone lymphoma(FoRT): long-term follow-up of a multicentre, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2021; 22(3): 332-40.(1iiDiii)
CQ6 初発進行期EMZLに無治療経過観察は推奨されるか
- 推奨グレード
- カテゴリー2A
リンパ腫による症状,臓器障害等が出現するまでの無治療経過観察が推奨される。
解説
EMZLの進行期と限局期を比較検討した後方視的研究では,診断時に約1/3の症例が進行期であり初回治療後のCR割合(化学療法未施行45%)および10年生存率は同等であった1)。
MZLのみを対象とした経過観察と治療介入のランダム化比較試験の報告はないものの,無症状のインドレントリンパ腫を対象としたなかにMZLが含まれる第Ⅲ相臨床試験が報告されている。chlorambucilと経過観察(局所放射線治療は許容)との比較であり,観察期間中央値16年においてOSに差を認めなかった。経過観察群で10年後に化学療法を必要としなかったのは19%であり,70歳以上に限ると40%であった2)。
未治療EMZLを対象とした第Ⅲ相試験ではchlorambucil単独療法,chlorambucil+リツキシマブ(R)療法,R単剤療法にランダム化された。5年EFSは,chlorambucil単独で51%,R単剤で50%,併用で68%だった(p=0.0009)。PFSも併用療法で有意に良好であった(p=0.0119)が,5年OSは,各群とも約90%であった。ただし,この試験には限局期症例も多数含まれており,StageⅠ42.4%,StageⅢ/Ⅳ 43.6%であった3)。
MZLを含む進行期症候性インドレントリンパ腫を対象とした第Ⅲ相試験では,R-CVP療法(R,CPA,VCR,PSL),R-CHOP療法(R,DXR,CPA,VCR,PSL)にランダム化された。PR以上となった症例にはR維持療法が実施された。5年EFSはR-CVP群61%,R-CHOP群56%と差を認めず,有害事象は有意にR-CVP群で少なかった。組織型別のサブグループ解析にて濾胞性リンパ腫に対するMZLのEFSはHR 0.84(0.44,1.62)であった4)。
BR療法(BEN,R)を検討したMZLを含む進行期インドレントリンパ腫を対象とした第Ⅲ相試験が複数報告されている。BR療法,R-CHOP療法にランダム化された試験では,インドレントリンパ腫およびマントル細胞リンパ腫の全体解析でPFSにおいてBR療法が有意に良好(BR療法69.5カ月 vs. R-CHOP療法31.2カ月,HR 0.58,95%CI 0.44-0.74,p<0.0001)であったが,MZLに限ったサブグループ解析ではPFSに差を認めなかった(HR 0.70,95%CI 0.34-1.43,p=0.3249)5)。BR療法,R-CVP療法あるいはR-CHOP療法にランダム化された試験では,MZLに関するサブグループ解析は示されてないが,奏効割合においてBR療法はR-CVP/R-CHOP療法に比べて非劣性であった6,7)。
参考文献
1) Thieblemont C, et al. Mucosa-associated lymphoid tissue lymphoma is a disseminated disease in one third of 158 patients analyzed. Blood. 2000; 95(3): 802-6.(3iiA)
2) Ardeshna KM, et al. Long-term effect of a watch and wait policy versus immediate systemic treatment for asymptomatic advanced-stage non-Hodgkin lymphoma: a randomised controlled trial. Lancet 2003; 362(9383): 516-22.(1iiA)
3) Zucca E, et al. Final Results of the IELSG-19 Randomized Trial of Mucosa-Associated Lymphoid Tissue Lymphoma: Improved Event-Free and Progression-Free Survival With Rituximab Plus Chlorambucil Versus Either Chlorambucil or Rituximab Monotherapy. J Clin Oncol. 2017; 35(17): 1905-12.(1iiDi)
4) Walewski J, et al. First-line R-CVP versus R-CHOP induction immunochemotherapy for indolent lymphoma with rituximab maintenance. A multicentre, phase III randomized study by the Polish Lymphoma Research Group PLRG4. Br J Haematol. 2020; 188(6): 898-906.(1iiDi)
5) Rummel MJ, et al. Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet. 2013; 381(9873): 1203-10.(1iiDiii)
6) Flinn IW, et al. Randomized trial of bendamustine-rituximab or R-CHOP/R-CVP in first-line treatment of indolent NHL or MCL: the BRIGHT study. Blood. 2014; 123(19): 2944-52.(1iiDiv)
7) Flinn IW, et al. First-Line Treatment of Patients With Indolent Non-Hodgkin Lymphoma or Mantle-Cell Lymphoma With Bendamustine Plus Rituximab Versus R-CHOP or R-CVP: Results of the BRIGHT 5-Year Follow-Up Study. J Clin Oncol. 2019; 37(12): 984-91.(1iiDiv)
CQ7 初発進行期NMZLに無治療経過観察は推奨されるか
- 推奨グレード
- カテゴリー2A
リンパ腫による症状,臓器障害等が出現するまでの無治療経過観察が推奨される。
解説
EMZLよりもさらに発症頻度が低いためにNMZLに関するエビデンスは極めて限られたものとなっている。進行期NMZLのみを対象とした前方視的試験は報告されてない。
無症状のインドレントリンパ腫を対象としたなかにMZLが含まれる第Ⅲ相臨床試験が報告されている。chlorambucilと経過観察(局所放射線治療は許容)との比較であり,観察期間中央値16年においてOSに差を認めなかった。経過観察群で10年後に化学療法を必要としなかったのは19%であり,70歳以上に限ると40%であった1)。
MZLを含む進行期症候性インドレントリンパ腫を対象とした第Ⅲ相試験では,R-CVP療法(R,CPA,VCR,PSL),R-CHOP療法(R,DXR,CPA,VCR,PSL)にランダム化された。PR以上となった症例にはリツキシマブ(R)維持療法が実施された。5年EFSはR-CVP群61%,R-CHOP群56%と差を認めず,有害事象は有意にR-CVP群で少なかった。組織型別のサブグループ解析にて濾胞性リンパ腫に対するMZLのEFSはHR 0.84(0.44,1.62)であった2)。
BR療法(BEN,R)を検討したMZLを含む進行期インドレントリンパ腫を対象とした第Ⅲ相試験が複数報告されている。BR療法,R-CHOP療法にランダム化された試験では,インドレントリンパ腫およびマントル細胞リンパ腫の全体解析でPFSにおいてBR療法が有意に良好(BR療法69.5カ月 vs. R-CHOP療法31.2カ月,HR 0.58,95%CI 0.44-0.74,p<0.0001)であったが,MZLに限ったサブグループ解析ではPFSに差を認めなかった(HR 0.70,95%CI 0.34-1.43,p=0.3249)3)。BR療法,R-CVP療法あるいはR-CHOP療法にランダム化された試験では,MZLに関するサブグループ解析は示されていないが,奏効割合においてBR療法はR-CVP/R-CHOP療法に比べて非劣性であった4,5)。
参考文献
1) Ardeshna KM, et al. Long-term effect of a watch and wait policy versus immediate systemic treatment for asymptomatic advanced-stage non-Hodgkin lymphoma: a randomised controlled trial. Lancet. 2003; 362(9383): 516-22.(1iiA)
2) Walewski J, et al. First-line R-CVP versus R-CHOP induction immunochemotherapy for indolent lymphoma with rituximab maintenance. A multicentre, phase III randomized study by the Polish Lymphoma Research Group PLRG4. Br J Haematol. 2020; 188(6): 898-906.(1iiDi)
3) Rummel MJ, et al. Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet. 2013; 381(9873): 1203-10.(1iiDiii)
4) Flinn IW, et al. Randomized trial of bendamustine-rituximab or R-CHOP/R-CVP in first-line treatment of indolent NHL or MCL: the BRIGHT study. Blood. 2014; 123(19): 2944-52.(1iiDiv)
5) Flinn IW, et al. First-Line Treatment of Patients With Indolent Non-Hodgkin Lymphoma or Mantle-Cell Lymphoma With Bendamustine Plus Rituximab Versus R-CHOP or R-CVP: Results of the BRIGHT 5-Year Follow-Up Study. J Clin Oncol. 2019; 37(12): 984-91.(1iiDiv)
CQ8 組織学的形質転換をきたしたMZLにはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
DLBCLに準じた治療が推奨される。
解説
MZLにおいて組織学的形質転換に関する臨床研究は限られたものとなっている。疫学的にも報告は限られており,組織学的形質転換の割合は報告により異なっている。解析対象症例数が300例以上の報告における組織学的形質転換の割合はMZL全体で7.5%(SMZL 11.4%,NMZL 17.2%,EMZL 6.4%)1),あるいは3.8%(SMZL 5%,NMZL 3%,EMZL 4%)2)であった。
MZLから組織学的形質転換するまでの期間については複数の報告があり,中央値29カ月(1.3~135カ月)1),中央値2.8年(1~12年)2),中央値22カ月(6.4~201.5カ月)3)などとなっている。診断時に組織学的形質転換と診断されるケースも一定数存在する。EMZLに限った解析であるが,組織学的形質転換と診断された症例の70%が診断時に形質転換を認めているとの報告がある4)。
組織学的形質転換後の治療に関する報告は後方視的研究のみであり,DLBCLで行われるR-CHOP療法(R,CPA,DXR,VCR,PSL)あるいはアンスラサイクリン系抗がん薬を含むCHOP類似療法が多く選択されていた1-8)。解析対象症例数が300例以上の報告における組織学的形質転換と診断後の予後については複数報告があり,形質転換後のOS中央値は7.3年1),2年OSは57%2),あるいはPFS中央値15カ月3)などとなっている。前方視的検討がなされていないものの,DLBCLに準じた治療にて予後の改善が期待される。
参考文献
1) Alderuccio JP, et al. Risk Factors for Transformation to Higher-Grade Lymphoma and Its Impact on Survival in a Large Cohort of Patients With Marginal Zone Lymphoma From a Single Institution. J Clin Oncol. 2018: JCO1800138.(3iiiDiv)
2) Conconi A, et al. Histologic transformation in marginal zone lymphomas†. Ann Oncol. 2015; 26(11): 2329-35.(3iiiDiv)
3) Kiesewetter B, et al. Transformed mucosa-associated lymphoid tissue lymphomas: A single institution retrospective study including polymerase chain reaction-based clonality analysis. Br J Haematol. 2019; 186(3): 448-59.(3iiiDiv)
4) Maeshima AM, et al. Clinicopathological features of histological transformation from extranodal marginal zone B-cell lymphoma of mucosa-associated lymphoid tissue to diffuse large B-cell lymphoma: an analysis of 467 patients. Br J Haematol. 2016; 174(6): 923-31.(3iiiDiv)
5) Bastidas-Mora G, et al. Clinico-biological features and outcome of patients with splenic marginal zone lymphoma with histological transformation. Br J Haematol. 2022; 196(1): 146-55.(3iiiDiv)
6) Rodrigues CD, et al. Clinical Characteristics, Treatment and Evolution of Splenic and Nodal Marginal Zone Lymphomas-Retrospective and Multicentric Analysis of Portuguese Centers. Clin Lymphoma Myeloma Leuk. 2021; 21(11): e839-44.(3iiiDiv)
7) Tedjaseputra A, et al. Excellent outcomes of transformed lymphomas in the rituximab era without autologous stem cell transplantation: an Australian single-centre experience. Intern Med J. 2021; 51(11): 1825-34.(3iiiDiv)
8) Xing KH, et al. Outcomes in splenic marginal zone lymphoma: analysis of 107 patients treated in British Columbia. Br J Haematol. 2015; 169(4): 520-7.(3iDiv)
CQ9 症状のある未治療HCV陽性SMZLにHCV除去療法は推奨されるか
- 推奨グレード
- カテゴリー2A
症状のあるHCV抗体陽性SMZLは肝臓内科にコンサルトの上,抗ウイルス療法を行うことが推奨される。
解説
SMZLは,一般的に緩徐な経過を示し,無治療で長期の生存期間を示す例がある。脾腫による症状や血球減少を伴わない無症候性患者は経過観察を考慮する1,2)。
C型肝炎ウイルス(HCV)抗体が陽性のSMZLは,抗ウイルス療法によりSMZLの改善1,3-5)と長期間の奏効6)が期待できる。そのため,HCV抗体が陽性のSMZLは肝臓内科にコンサルトの上で適切な抗ウイルス療法を行うことが推奨される。HCV抗体陽性SMZL 23例に抗ウイルス療法を施行したイタリアからの報告では,全奏効割合が82%とリンパ腫の改善を認め,奏効期間中央値は33カ月であった7)。また,HCV抗体陽性のSMZL 17例に抗ウイルス療法を行った報告では,4例がCR,7例がPRを達成し,1年間のPFSおよびOSはそれぞれ75%と98%であった8)。
抗ウイルス療法が適応とならない,もしくは抗ウイルス療法が無効な症状のあるHCV陽性SMZLでは,リツキシマブ(R)単剤療法が推奨される4,9)。リンパ腫による全身症状や臓器障害を認める場合や腫瘍の増殖速度が早い場合は,免疫化学療法の施行を考慮する10-12)。
参考文献
1) Rossotti R, et al. Rapid clearance of HCV-related splenic marginal zone lymphoma under an interferon-free, NS3/NS4A inhibitor-based treatment. A case report. J Hepatol. 2015; 62(1): 234-7.
2) Arcaini L, et al. Splenic and nodal marginal zone lymphomas are indolent disorders at high hepatitis C virus seroprevalence with distinct presenting features but similar morphologic and phenotypic profiles. Cancer. 2004; 100(1): 107-15.(3iiiDiv)
3) Hermine O, et al. Regression of splenic lymphoma with villous lymphocytes after treatment of hepatitis C virus infection. N Engl J Med. 2002; 347(2): 89-94.(3iiiDiv)
4) Arcaini L, et al. Antiviral treatment in patients with indolent B-cell lymphomas associated with HCV infection: a study of the Fondazione Italiana Linfomi. Ann Oncol. 2014; 25(7): 1404-10.(3iiiA)
5) Vallisa D, et al. Role of anti-hepatitis C virus(HCV)treatment in HCV-related, low-grade, B-cell, non-Hodgkin’s lymphoma: a multicenter Italian experience. J Clin Oncol. 2005; 23(3): 468-73.(3iiiDiv)
6) Rattotti S, et al. Lymphomas associated with chronic hepatitis C virus infection: A prospective multicenter cohort study from the Rete Ematologica Lombarda(REL)clinical network. Hematol Oncol. 2019; 37(2): 160-7.(3iiiDiv)
7) Arcaini L, et al. Antiviral treatment in patients with indolent B-cell lymphomas associated with HCV infection: a study of the Fondazione Italiana Linfomi. Ann Oncol. 2014; 25(7): 1404-10.(3iiiA)
8) Arcaini L, et al. Interferon-free antiviral treatment in B-cell lymphoproliferative disorders associated with hepatitis C virus infection. Blood. 2016; 128(21): 2527-32.(3iiiDiv)
9) Alric L, et al. Antiviral Treatment of HCV-Infected Patients with B-Cell Non-Hodgkin Lymphoma: ANRS HC-13 Lympho-C Study. PLoS One. 2016; 11(10): e0162965.(3iiiDiv)
10)Kalpadakis C, et al. Treatment of splenic marginal zone lymphoma: should splenectomy be abandoned. Leuk Lymphoma. 2014; 55(7): 1463-70.(レビュー)
11)Iannitto E, et al. Efficacy of bendamustine and rituximab in splenic marginal zone lymphoma: results from the phase II BRISMA/IELSG36 study. Br J Haematol. 2018; 183(5): 755-65.(3iiiDiv)
12)Florindez JA, et al. Splenic marginal zone lymphoma: A US population-based survival analysis(1999-2016). Cancer. 2020; 126(21): 4706-16.(3iDiv)
CQ10 症状のある未治療HCV陰性SMZLにはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
症状のある未治療HCV陰性SMZLにはリツキシマブ単剤療法が推奨される。
解説
HCV抗体が陰性のSMZLは,無症候性の場合は無治療経過観察が推奨される1)。脾腫による腹部症状や血球減少など症候を有するHCV抗体陰性SMZLは,リツキシマブ(R)単剤もしくは脾臓摘出が治療選択肢となる。106例のSMZLに対するR単剤は全奏効率が90%以上,10年DFSが70%2-5)と高い治療効果が報告されている。脾臓摘出においても局所症状の改善と血球減少の改善が期待でき6,7),脾臓摘出による5年PFSは50~60%,5年OSは70~80%と報告されている5,8)。脾臓摘出は侵襲性が高く,短期・長期の合併症に注意が必要であるため,近年はRを推奨する報告が多い8,9)。自己免疫性溶血性貧血や免疫性血小板減少の合併例に対する標準治療は確立しておらず,症例ごとに治療方針を検討する。Rが無効で,脾腫による症状がある場合は脾臓摘出を考慮する1,6,7,10)。Rと脾臓摘出が無効である,リンパ腫による全身症状や臓器障害を認める,腫瘍の増殖速度が早い,以上の3つの場合は免疫化学療法の施行を考慮する11,12)。
参考文献
1) Thieblemont C, et al. Treatment of splenic marginal zone B-cell lymphoma: an analysis of 81 patients. Clin Lymphoma. 2002; 3(1): 41-7.(3iiiDiv)
2) Kalpadakis C, et al. Treatment of splenic marginal zone lymphoma with rituximab monotherapy: progress report and comparison with splenectomy. Oncologist. 2013; 18(2): 190-7.(3iiiDiv)
3) Kalpadakis C, et al. Rituximab monotherapy is highly effective in splenic marginal zone lymphoma. Hematol Oncol. 2007; 25(3): 127-31.(3iiiDiv)
4) Tsimberidou AM, et al. Outcomes in patients with splenic marginal zone lymphoma and marginal zone lymphoma treated with rituximab with or without chemotherapy or chemotherapy alone. Cancer. 2006; 107(1): 125-35.(3iiiDiv)
5) Kalpadakis C, et al. Rituximab monotherapy in splenic marginal zone lymphoma: prolonged responses and potential benefit from maintenance. Blood. 2018; 132(6): 666-70.(3iiiDiv)
6) Pata G, et al. Still a role for surgery as first-line therapy of splenic marginal zone lymphoma? Results of a prospective observational study. Int J Surg. 2017; 41: 143-9.(3iiiDiv)
7) Lenglet J, et al. Long-term follow-up analysis of 100 patients with splenic marginal zone lymphoma treated with splenectomy as first-line treatment. Leuk Lymphoma. 2014; 55(8): 1854-60.(3iiiDiv)
8) Kalpadakis C, et al. Treatment of splenic marginal zone lymphoma: should splenectomy be abandoned? Leuk Lymphoma. 2014; 55(7): 1463-70.(レビュー)
9) Kalpadakis C, et al. Should rituximab replace splenectomy in the management of splenic marginal zone lymphoma? Best Pract Res Clin Haematol. 2018; 31(1): 65-72.(レビュー)
10)Sima A, et al. Superior outcome for splenectomised patients in a population-based study of splenic marginal zone lymphoma in Sweden. Br J Haematol. 2021; 194(3): 568-79.(3iDiv)
11)Florindez JA, et al. Splenic marginal zone lymphoma: A US population-based survival analysis(1999-2016). Cancer 2020; 126(21): 4706-16.(3iDiv)
12)Iannitto E, et al. Efficacy of bendamustine and rituximab in splenic marginal zone lymphoma: results from the phase II BRISMA/IELSG36 study. Br J Haematol. 2018; 183(5): 755-65.(3iiiDiv)

