第Ⅰ章 白血病
Ⅰ 白血病
6 骨髄異形成症候群
(myelodysplastic syndromes:MDS)
総論
骨髄異形成症候群(myelodysplastic syndromes:MDS)は未熟な造血細胞に生じた異常が原因と考えられる骨髄系造血器腫瘍の一つである1,2)。1982年のFrench-American-British(FAB)分類3)によって疾患概念が明らかとなり,現在はWHO分類(2017)4)を用いて診断,分類がなされる。しかし,臨床的にはFAB分類による取り扱いも併用されている。単一あるいは複数系統の血球減少,血球の形態学的異形成,骨髄における無効造血,急性白血病転化のリスクを特徴とするが,単一疾患ではなく複数の疾患からなる症候群の集まり(syndromes)と捉えられている。したがって,現在の病型分類のみでは臨床的な対応を決定するには十分ではないと考えられる。高齢者に多く,加齢が発症の重要なリスクと想定されるが,MDSの半数以上に染色体異常がありさらにほぼ全例に何らかのゲノム変異が同定されることから,未分化な造血細胞に生じたゲノム変異が発症に関与すると考えられている。染色体検査レベルでは確認できないゲノム変異が多数あり,主要なものはほぼ同定されていると考えられているが5),それらの意義については一部が解明されているのみで,今後の検討が必要である。
WHO分類(2017)での診断は,血球減少,末梢血と骨髄の芽球割合,造血細胞の異形成,染色体異常によってなされ,診断におけるゲノム変異所見の役割はまだ,限定的である。MDSは種々の血液疾患と境界を接しており,経過観察や他疾患の除外とともに,現在でも診断の重要な部分は形態学的な判断に負うところが大きい1,2)。同一病型であっても患者間の予後には大きな違いがみられるため,臨床的判断には病型診断に加えて予後予測が必須である。確定診断が得られた後は,診断時の血液所見,骨髄所見,染色体異常,一部のゲノム変異などによって患者ごとの疾患リスクを予測し,それが治療方針決定の重要な情報となる。予後は,MDSの血球減少に関連した事象(感染症,出血など)と白血病化に大きく影響されるが,本疾患は高齢者に多いことより,併存疾患,年齢など患者背景も予後に大きく関連する。
治療においては基本的な支持療法(定期的な経過観察,社会生活を含む患者活動への支援,血球減少への対応,感染症への対応など)はMDS全例に対して実施されるが,臨床的リスクによって治療方針が異なる。
現在でも根治療法は同種造血幹細胞移植のみだが,患者集団の年齢などから同種移植の恩恵にあずかる症例は一部に限られている。一方で,MDSの分子病態解析の進歩に伴って新薬開発が続いており,治療にも新たな展開がみられている。
参考文献
1) 三谷絹子編集.特発性造血障害疾患の診療の参照ガイド 令和元年度改訂版 http://zoketsushogaihan.umin.jp/resources.html(ガイドライン)
2) Cazzola M. Myelodysplastic syndromes. N Engl J Med. 2020; 383(14): 1358-74.(レビュー)
3) Bennett JM, et al. Proposals for the classification of the myelodysplastic syndromes. Br J Haematol. 1982; 51(2): 189-99.
4) Hasserjian RP, et al. Myelodysplastic syndromes. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, Lyon, IARC; 2017: pp98-106.(テキストブック)
5) Haferlach T, et al. Landscape of genetic lesions in 944 patients with myelodysplastic syndromes. Leukemia. 2014; 28(2): 241-7.(3iii)
アルゴリズム
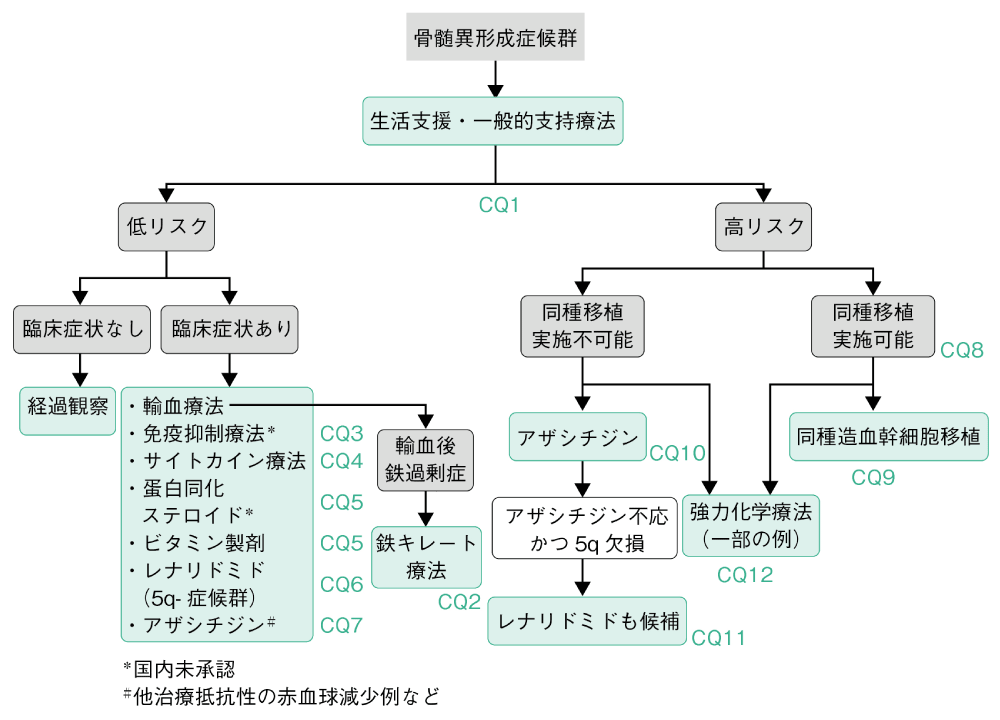
MDSは多様な病態を有する疾患の集合体であり,治療方針を決定する上では診断と病型分類のみでは不十分である。そのため,主に臨床的な因子を用いて予後予測がなされる(CQ1)。複数の予後予測スコアリングシステムが提唱されており,それぞれに特徴がみられるが,臨床的な対応はMDSを低リスクと高リスクの2群に分けて考慮されることが多い。1994年に発表されたInternational prognostic scoring system(IPSS)ではMDSを4群に分けLow,Intermediate(Int)-1を低リスク,Int-2,Highを高リスクとし,低リスクと高リスクで臨床的対応を選択するという層別化が行われてきた。2012年に発表されたその改訂版であるRevised IPSS(IPSS-R)はIPSSよりも層別化能がさらに優れており,現在はこちらが広く利用されている(CQ1)。
まず,MDSに対してはリスクにかかわらず適切な間隔での医学的観察・受診,患者の社会的生活への支援など一般的な支持療法が重要となる。低リスクで無症状の場合は経過観察を続け,低リスクで血球減少による症状がある例,および高リスク例に対して治療が実施される。低リスク例においては血球減少に対する対応(貧血に対する赤血球輸血,血小板減少時の血小板輸血,感染症対策など)に加えてその改善を治療の第一目標とし,高リスク例では白血病転化リスクが高いことより,疾患の自然経過を変えることを目指したより積極的な治療方針がとられる。
MDSによる慢性貧血への基本的な支持療法は輸血であるが,赤血球輸血依存例などでは,輸血に伴う輸血後鉄過剰症を合併する。これは予後の悪化に関連する可能性があるため,MDSの輸血後鉄過剰症に対しては鉄キレート療法が治療の選択肢として考えられる(CQ2)。低リスク例の血球減少に対しては免疫抑制療法(CQ3,国内保険適用外),サイトカイン療法(CQ4)の効果が報告されており,本邦では蛋白同化ステロイド療法やビタミン製剤投与(CQ5)が考慮されてきた。また,5番染色体長腕の欠損を伴う5q-症候群でみられる血球減少(貧血)へのレナリドミド(LEN)(CQ6),一部の低リスク例に対するアザシチジン(AZA)投与(CQ7)も血球回復に一定の効果が報告されている。しかし,治療によって一定の血球回復がみられても,こうした治療によって低リスクMDSの生存期間延長につながるのか,明らかなエビデンスはない。
高リスク例は自然経過では予後が悪いため,低リスク例と比較してより積極的な対応がなされる。年齢や患者背景,ドナーなどの条件が許せば同種造血幹細胞移植(CQ8)の積極的な適応が考慮される。最近では高齢者例などを中心に前処置を減弱した同種移植も実施される(CQ9)。これまでのところ治癒をもたらす治療法は同種造血幹細胞移植のみだが,移植がなされない例に対してはAZAが選択される(CQ10)。AZAはランダム化比較試験によって同種造血幹細胞移植非適応の高リスク例の予後を改善することが示されている。5番染色体長腕の欠損を伴った例ではLENも投与可能である(CQ11)。一部の高リスク例に対しては白血病治療に準じた抗がん薬投与も考慮される(CQ12)。
CQ1 MDSの予後予測法,リスク分類として勧められるのは何か
- 推奨グレード
- カテゴリー2A
IPSSやWHO分類に基づく予後予測スコアリングシステム(WPSS),IPSSの改訂版であるIPSS-Rのように複数の因子を組み合わせて予後を予測するスコアリングシステムが勧められる。特に,多くの外部検証においてIPSS-Rが優れていることが示されており,IPSS-Rが最も広く用いられている。
解説
MDSは多様な疾患単位の集合体であり,単なる病型分類では十分な予後予測はできないと考えられている。造血細胞の形態的な特徴,特に芽球割合,血球減少の程度や減少している系統数,染色体所見は予後と関連する。そこで,それらをスコア化し,その合計点数でMDSの予後を予測するIPSSが開発された。IPSSはMDSを骨髄芽球割合,血球減少の系統数,染色体グループという3因子の点数によって4群に層別化するものである1)。FAB分類に基づいて作成されているため,現在のWHO分類(2017)では急性骨髄性白血病(AML)に含まれる芽球20~30%の例も取り扱っている。IPSSはこれまで多数の臨床研究で用いられている(表1,2)1)。
その改訂版であるIPSS-Rは2012年に発表されたが,7,000例以上の症例から作成された予後予測スコアリングで,IPSSと同じ因子を用いるが,染色体核型の分類,芽球割合や血球減少の取扱いが変更されている(表3~5)2)。これらによってMDSを5群に分類するもので,IPSSと比較して予後予測の精度が上がっている2)。
表1 IPSS予後因子スコア
| 予後因子 | 予後因子のスコア | ||||
|---|---|---|---|---|---|
| 0 | 0.5 | 1 | 1.5 | 2 | |
| 骨髄芽球% | <5% | 5~10% | 11~20% | 21~30% | |
| 核型 | 良好 | 中間 | 不良 | ||
| 血球減少 | 0/1系統 | 2/3系統 | |||
| 〈血球減少基準〉 | 〈核型によるリスク〉 |
| 好中球<1,800/μL | 良好:正常,20q-,-Y,5q- |
| Hb<10 g/dL | 中間:良好と不良以外 |
| 血小板<10 万/μL | 不良:複雑核型(3個以上),7番異常 |
(文献1)より引用)
表2 IPSSによる予後層別化
| 予後リスクの評価 | スコア合計点数 |
|---|---|
| Low | 0点 |
| Intermediate-1(Int-1) | 0.5~1点 |
| Intermediate-2(Int-2) | 1.5~2点 |
| High | 2.5点以上 |
(文献1)より引用)
表3 IPSS-R予後因子スコア
| 予後因子の配点 | 0 | 0.5 | 1 | 1.5 | 2 | 3 | 4 |
|---|---|---|---|---|---|---|---|
|
核型 (表5参照) |
Very good | − | Good | − | Intermediate | Poor | Very poor |
| 骨髄芽球比率(%) | ≦2 | − | >2~<5 | − | 5~10 | >10 | − |
| Hb(g/dL) | ≧10 | − | 8以上10未満 | <8 | − | − | − |
|
血小板数 (×103/μL) |
≧100 | 50~<100 | <50 | − | − | − | − |
|
好中球数 (×103/μL) |
≧0.8 | <0.8 | − | − | − | − | − |
(文献2)より引用)
表4 IPSS-Rによる予後層別化
| リスク群 | 点数 |
|---|---|
| Very low | ≦1.5 |
| Low | >1.5~3 |
| Intermediate | >3~4.5 |
| High | >4.5~6 |
| Very high | >6 |
(文献2)より引用)
表5 IPSS-Rにおける染色体リスク群
| 予後グループ | 染色体核型 |
|---|---|
| Very good | -Y,del(11q) |
| Good | 正常,del(5q),del(12p),del(20q),double including del(5q) |
| Intermediate | del(7q),+8,+19,i(17q),any other single or double independent clones |
| Poor |
-7 inv(3)/t(3q)/del(3q) double including -7/del(7q) complex:3 abnormalities |
| Very poor | Complex:>3 abnormalities |
(文献2)より引用)
予後予測因子にWHO分類(2001)と輸血依存性を採用したのがWPSSで,初診時ばかりでなく病期進展時にも適応できるという特徴がある3)。WHO分類の改訂とともにWPSSは改訂を受けているが4,5),IPSS,WPSSなどの複数の予後予測システムとIPSS-Rの予後予測能を比較する複数の外部検証において,IPSS-Rが優れた予後予測能を示していることから,IPSS-Rが最も広く利用されている6,7)。
IPSSおよびIPSS-Rの作成時には積極的な治療を受けた患者を対象としていないが,積極的治療を受けた患者に対してもIPSS-Rの検証が行われ,積極的治療を受けた患者の予後予測にも適応できることが示されている8,9)。
IPSS-Rは診断時のリスク分類を用いて予後予測を行うが,時間経過とともに死亡や白血病移行のハザードは変化する。IPSS-Rの作成に用いられたMDSデータベースを用いた解析ではIPSS-Rにおいて高リスクに分類されるMDSの死亡・白血病移行のハザードが時間経過とともに低下するのに対し,低リスクMDSでは変化が少ないことが示された10)。時間経過による病態進展リスクの変化を加味するとIPSS-Rスコア3.5以下を低リスク群,4.0以上を高リスク群に分類することによってMDSの予後を2群に分類できるとされ,NCCNガイドラインではMDSをIPSS-Rスコア3.5をカットオフとして低リスク・高リスクに分類することが推奨されている11)。なお,わが国のMDS症例におけるIPSS-Rの検証においてはIntermediateに分類される群はそれより低リスクに分類される例とOSがほぼ同等であり,日本人においてはIPSS-RでIntermediateに分類される例は低リスクとして扱うべきである可能性がある。ただし,この研究ではIntermediateリスク群のおよそ3割にAZAによる治療が施されており,これが予後を改善した可能性がある9)。
その他の予後予測システムとしては,テキサス大学MDアンダーソンがんセンターから公表された予後スコアリングシステムがあるほか12,13),併存疾患の多い患者における予後予測の補完などが試みられている14-16)。また,低形成MDS,治療関連MDSやメチル化阻害薬治療を受けた患者,メチル化阻害薬抵抗性の患者,同種移植を受けた患者などについても予後予測モデルの作成が試みられ報告されている17-21)。
MDSの大部分において発症の原因となるドライバー変異がゲノム解析によって同定できることから,こうした遺伝子変異に基づく予後予測モデルについても複数の報告があり,IPSS-Rとの併用が有用である可能性がある22-27)。
参考文献
1) Greenberg P, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood. 1997; 89(6): 2079-88.(3iiA)
2) Greenberg PL, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood. 2012; 120(12): 2454-65.(3iiA)
3) Malcovati L, et al. Time-dependent prognostic scoring system for predicting survival and leukemic evolution in myelodysplastic syndromes. J Clin Oncol. 2007; 25(23): 3503-10.(3iiA)
4) Malcovati L, et al. Impact of the degree of anemia on the outcome of patients with myelodysplastic syndrome and its integration into the WHO classification-based Prognostic Scoring System(WPSS). Haematologica. 2011; 96(10): 1433-40.(3iiA)
5) Della Porta MG, et al. Validation of WHO classification-based Prognostic Scoring System(WPSS)for myelodysplastic syndromes and comparison with the revised International Prognostic Scoring System(IPSS-R). A study of the International Working Group for Prognosis in Myelodysplasia(IWG-PM). Leukemia. 2015; 29(7): 1502-13.(3iiA)
6) Neukirchen J, et al. Validation of the revised international prognostic scoring system(IPSS-R)in patients with myelodysplastic syndrome: a multicenter study. Leuk Res. 2014; 38(1): 57-64.(3iiA)
7) Moreno Berggren D, et al. Prognostic scoring systems for myelodysplastic syndromes(MDS)in a population-based setting: a report from the Swedish MDS register. Br J Haematol. 2018; 181(5): 614-27.(3iA)
8) Mishra A, et al. Validation of the revised International Prognostic Scoring System in treated patients with myelodysplastic syndromes. Am J Hematol. 2013; 88(7): 566-70.(3iiA)
9) Kawabata H, et al. Validation of the revised International Prognostic Scoring System in patients with myelodysplastic syndrome in Japan: results from a prospective multicenter registry. Int J Hematol. 2017; 106(3): 375-84.(3iiA)
10)Pfeilstöcker M, et al. Time-dependent changes in mortality and transformation risk in MDS. Blood. 2016; 128(7): 902-10.(3iiA)
11)National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Myelodysplastic Syndromes Version 3.2022. https://www.nccn.org/professionals/physician_gls/pdf/mds.pdf (ガイドライン)
12)Kantarjian H, et al. Proposal for a new risk model in myelodysplastic syndrome that accounts for events not considered in the original International Prognostic Scoring System. Cancer. 2008; 113(6): 1351-61.(3iiA)
13)Garcia-Manero G, et al. A prognostic score for patients with lower risk myelodysplastic syndrome. Leukemia. 2008; 22(3): 538-43.(3iiiA)
14)Della Porta MG, et al. Risk stratification based on both disease status and extra-hematologic comorbidities in patients with myelodysplastic syndrome. Haematologica. 2011; 96(3): 441-9.(3iiA)
15)Nakaya A, et al. Does the hematopoietic cell transplantation specific comorbidity index(HCT-CI)predict transplantation outcomes? A prospective multicenter validation study of the Kanto Study Group for Cell Therapy. Biol Blood Marrow Transplant. 2014; 20(10): 1553-9.(3iiA)
16)Starkman R, et al. An MDS-specific frailty index based on cumulative deficits adds independent prognostic information to clinical prognostic scoring. Leukemia. 2020; 34(5): 1394-406.(3iiA)
17)Tong WG, et al. Predicting survival of patients with hypocellular myelodysplastic syndrome: development of a disease-specific prognostic score system. Cancer. 2012; 118(18): 4462-70.(3iiA)
18)Quintás-Cardama A, et al. A prognostic model of therapy-related myelodysplastic syndrome for predicting survival and transformation to acute myeloid leukemia. Clin Lymphoma Myeloma Leuk. 2014; 14(5): 401-10.(3iiA)
19)Itzykson R, et al. Prognostic factors for response and overall survival in 282 patients with higher-risk myelodysplastic syndromes treated with azacitidine. Blood. 2011; 117(2): 403-11.(3iiA)
20)Nazha A, et al. The efficacy of current prognostic models in predicting outcome of patients with myelodysplastic syndromes at the time of hypomethylating agent failure. Haematologica. 2016; 101(6): e224-7.(3iiA)
21)Shaffer BC, et al. Scoring System Prognostic of Outcome in Patients Undergoing Allogeneic Hematopoietic Cell Transplantation for Myelodysplastic Syndrome. J Clin Oncol. 2016; 34(16): 1864-71.(3iiiA)
22)Nazha A, et al. A Personalized Prediction Model for Outcomes after Allogeneic Hematopoietic Cell Transplant in Patients with Myelodysplastic Syndromes. Biol Blood Marrow Transplant. 2020; 26(11): 2139-46.(3iiA)
23)Papaemmanuil E, et al. Clinical and biological implications of driver mutations in myelodysplastic syndromes. Blood 2013; 122(22): 3616-27; quiz 3699.(3iiiDii)
24)Haferlach T, et al. Landscape of genetic lesions in 944 patients with myelodysplastic syndromes. Leukemia. 2014; 28(2): 241-7.(3iiA)
25)Nazha A, et al. Incorporation of molecular data into the Revised International Prognostic Scoring System in treated patients with myelodysplastic syndromes. Leukemia 2016; 30(11): 2214-20.(3iiA)
26)Bersanelli M, et al. Classification and Personalized Prognostic Assessment on the Basis of Clinical and Genomic Features in Myelodysplastic Syndromes. J Clin Oncol. 2021; 39(11): 1223-33.(3iiA)
27)Bernard E, et al. Molecular International Prognostic Scoring System for Myelodysplastic Syndromes. NEJM Evid. 2022; 1(7): EVIDoa2200008.(3iiA)
CQ2 輸血による鉄過剰症に対する鉄キレート療法の適応基準は何か
- 推奨グレード
- カテゴリー2B
1年以上など一定期間の予後が見込まれ,赤血球輸血による鉄過剰状態にある低リスクMDSでは鉄過剰症に伴う臓器障害の進行や死亡リスクの低減を期待して鉄キレート療法を行う。
- 推奨グレード
- カテゴリー2B
高リスクMDSでは,鉄キレート療法による生存期間の延長は証明されていない。しかし,同種造血幹細胞移植を予定している症例では,治療関連死亡および生存率の改善のために鉄キレート療法を検討する。
解説
一定量以上の赤血球輸血は鉄過剰症の原因となり,輸血依存MDS患者で臓器障害を生じた例や死亡例では鉄過剰症状態にあることが多いと報告されている1)。組織の過剰鉄は活性酸素種の産生を介して組織傷害の原因になるとされているが,鉄キレート薬を投与することで,体内から過剰鉄が排出され,臓器障害が改善する2,3)。
輸血依存および高フェリチン血症はMDSにおける予後不良因子として報告されており,メタアナリシスを含む複数の解析で血清フェリチン値1,000 ng/mL以上は有意な負の生存因子であることが示されている4-6)。そして,低リスクMDSにおける鉄キレート療法は患者予後を改善することが2つのメタアナリシスにおいて示されており7,8),近年行われた低リスクMDSを対象とした第Ⅱ相ランダム化比較試験(TELESTO試験)では,デフェラシロクスはプラセボと比較して心機能・肝機能増悪や白血病への進展,死亡をイベントとした,EFSを延長したことが報告されている9)。
以上のことから,鉄過剰症を伴う低リスクMDSでは臓器障害の進行や死亡リスクの低減を期待して鉄キレート療法を行うことが推奨される。本邦の特発性造血障害に関する調査研究班より発行された診療の参照ガイドでは,1年以上の予後が見込まれる血清フェリチン値1,000 ng/mL以上の鉄過剰症低リスクMDSに対しては鉄キレート療法の施行が推奨されている10)。体内鉄のモニターは血清フェリチン値を利用し,500~1,000 ng/mLの維持が目標とされている。
なお,高リスクMDSにおける鉄キレート療法の報告は極めて少なく,予後についての有効性は証明されていない11)。しかし,骨髄破壊的前処置を行った同種移植症例において,移植前の輸血依存および高フェリチン血症はOSとNRMに対する予後不良因子であることが報告されており12),小児における後方視的研究では移植前に鉄キレート療法を行い,血清フェリチン値が1,000 ng/mL未満まで低下した症例では,治療関連死亡と生存率の改善が認められたことが報告されているため13),少なくとも移植前に血清フェリチン値を1,000 ng/mL未満まで下げることができた症例では予後改善の可能性があることが示唆される。
以上より,鉄過剰症を伴う造血幹細胞移植予定患者では,移植前血清フェリチン値を1,000 ng/mL未満に保てるよう,移植前に鉄キレート療法を検討する。しかし,鉄キレート薬には腎障害など特有の有害事象リスクがあるため,施行の際には併存疾患,併用薬の評価を行い有害事象の合併には十分に注意すべきである。
参考文献
1) Takatoku M, et al. Retrospective nationwide survey of Japanese patients with transfusion-dependent MDS and aplastic anemia highlights the negative impact of iron overload on morbidity/mortality. Eur J Haematol. 2007; 78(6): 487-94.(3iiiA)
2) Gattermann N, et al. Deferasirox in iron-overloaded patients with transfusion-dependent myelodysplastic syndromes: Results from the large 1-year EPIC study. Leuk Res. 2010; 34(9): 1143-50.(3iiiA)
3) Greenberg PL, et al. Prospective assessment of effects on iron-overload parameters of deferasirox therapy in patients with myelodysplastic syndromes. Leuk Res. 2010; 34(12): 1560-5.(3iiDiv)
4) Pileggi C, et al. Role of serum ferritin level on overall survival in patients with myelodysplastic syndromes: Results of a meta-analysis of observational studies. PLoS One. 2017; 12(6): e0179016.(3iiiA)
5) Malcovati L, et al. Prognostic factors and life expectancy in myelodysplastic syndromes classified according to WHO criteria: a basis for clinical decision making. J Clin Oncol. 2005; 23(30): 7594-603.(3iiiA)
6) Garcia-Manero G, et al. A prognostic score for patients with lower risk myelodysplastic syndrome. Leukemia 2008; 22(3): 538-43.(3iiA)
7) Yang S, et al. Iron chelation therapy in patients with low- to intermediate-risk myelodysplastic syndrome: A systematic review and meta-analysis. Br J Haematol. 2022; 197(1): e9-e11.(3iiiA)
8) Abraham I, et al. Survival outcomes in iron chelated and non-chelated patients with lower-risk myelodysplastic syndromes: Review and pooled analysis of observational studies. Leuk Res. 2017; 57: 104-8.(3iiiA)
9) Angelucci E, et al. Iron Chelation in Transfusion-Dependent Patients With Low- to Intermediate-1-Risk Myelodysplastic Syndromes: A Randomized Trial. Ann Intern Med. 2020; 172(8): 513-22.(3iiiDi)
10)輸血後鉄過剰症診療の参照ガイド 令和1 年度改訂版.厚生労働科学研究費補助金(難治性疾患等政策研究事業)特発性造血障害に関する調査研究班.研究代表者:三谷絹子,2020. http://zoketsushogaihan.umin.jp/resources.html(ガイドライン)
11)Musto P, et al. Iron-chelating therapy with deferasirox in transfusion-dependent, higher risk myelodysplastic syndromes: a retrospective, multicentre study. Br J Haematol. 2017; 177(5): 741-50.(3iiiA)
12)Alessandrino EP, et al. Prognostic impact of pre-transplantation transfusion history and secondary iron overload in patients with myelodysplastic syndrome undergoing allogeneic stem cell transplantation: a GITMO study. Haematologica. 2010; 95(3): 476-84.(3iiA)
13)Lee JW, et al. Effect of iron overload and iron-chelating therapy on allogeneic hematopoietic SCT in children. Bone Marrow Transplant. 2009; 44(12): 793-7.(3iiiB)
CQ3 低リスクMDSに対して免疫抑制療法は勧められるか
- 推奨グレード
- カテゴリー2A
低リスクMDSの一部症例に対して,造血回復目的に抗胸腺細胞グロブリンやシクロスポリンを用いた免疫抑制治療が有効である。奏効予測因子は未確定であるが,若年齢,HLA-DR15陽性例,罹患期間・輸血歴の短い症例,骨髄低形成症例などでは有効性が期待される。免疫抑制療法による白血病への移行リスクの増悪は確認されていない。
(国内保険適用外)
解説
MDS,特に芽球増加を伴わない低リスクMDSの一部において,抗胸腺細胞グロブリン(anti-thymocyte globulin:ATG),シクロスポリン(CsA)を用いた免疫抑制療法(immunosuppressive therapy:IST)によって造血回復が認められる。欧米ではATG(CsA併用を含む)の有効性を検討した報告が多く,単群前方視的研究や後方視的研究では30~50%程度の奏効率が認められている1-5)。ATG+CsAとbest supportive care(BSC)を比較したランダム化比較試験では,ATG+CsA群において6カ月後の血液学的奏効率が有意に高く(ATG+CsA群13/45例 vs. BSC群4/43例),骨髄低形成が奏効予測因子であったが,予後は両群で同等であり,AMLへの移行リスクも同等であった6)。一方,CsA単独療法や副腎皮質ステロイド(mPSL)の有効性は主に本邦を含むアジアで検討されており,CsA(蛋白同化ホルモン等の併用を含む)で40~60%程度7-11),mPSLパルス療法(CsAの併用含む)では33.3%12)の血液学的奏効が報告されている。
ISTに対する奏効予測因子として挙げられているのは,若年齢1,2,13),HLA-DR15陽性1,7,13),血小板減少2),短期間の罹患・輸血依存4,13),CD8陽性terminal memory T細胞高値4),CD4 Ki67陽性率高値4),低IPSSスコア4,7),細胞核型4,7),PNH型血球陽性8,11)などであるが,報告によってこれらの因子の有意性は異なり,一定の結論は得られていない。また,中国で行われた低リスクMDSを対象とした前方視的研究では,HLA-DR15陽性,骨髄細胞密度30%未満,骨髄T細胞分画異常のいずれかに当てはまる症例ではISTによる奏効率が77.5%と高く,当てはまる項目が多いほど有効性が高いことが示されている14)。なお,MDSの一部にT細胞分画のSTAT3変異陽性症例や大顆粒リンパ球(large granular lymphocyte:LGL)を伴う症例が認められ,これらの症例では低形成骨髄,好中球減少が認められることが報告されており,低形成MDSとSTAT3変異の関連が指摘されている15)。
これらの臨床試験の結果はメタアナリシスによってまとめられており,22試験,570例を解析対象とした統合研究では,ISTの奏効率は42.5%であり,CR率は12.5%,輸血依存からの脱却率は33.4%であった16)。ATG+CsAで奏効率は高くなる傾向にあったが,データが十分ではなく本研究では奏効因子の抽出はできていない。米国・欧州15施設による国際多施設共同コホートデータを用いた後方視的研究でも,全奏効率48.8%,CR率11.2%,赤血球輸血脱却率30%と同様の治療成績が報告されているが,骨髄低形成症例において赤血球輸血からの離脱が期待しやすいものの,年齢,輸血依存性,PNH型血球やLGLクローンの存在,HLA-DR15陽性はISTへの反応を予測しなかった17)。
ISTによるAMLへの進展リスクについては,ランダム化比較試験ではBSCと有意差を認めておらず6),またNIHによる複数の臨床試験結果を国際データベース(International Myelodysplasia Risk Analysis Workshop:IMRAW)と比較したデータでもISTによるAML移行の増悪は証明されていない1)。メタアナリシスではIST治療後のAMLへの進展率は8.6%(1年・1人あたり)と計算されているが,試験間に有意な異質性が存在する16)。
このように,ISTに対する奏効予測因子は科学的には確定していないものの,若年齢,HLA-DR15陽性例,罹患期間・輸血歴の短い症例,骨髄低形成症例など,メタアナリシスのほか,ランダム化比較試験や比較的多数の後方視的・前方視的研究で指摘された因子を持つ症例ではISTが考慮される。また,ISTによるAMLへの移行リスクの増悪は確認されていない。ただし,MDSに対する免疫抑制療法は保険適用外である。
参考文献
1) Sloand EM, et al. Factors affecting response and survival in patients with myelodysplasia treated with immunosuppressive therapy. J Clin Oncol. 2008; 26(15): 2505-11.(3iiiDiv)
2) Molldrem JJ, et al. Antithymocyte globulin for treatment of the bone marrow failure associated with myelodysplastic syndromes. Ann Intern Med. 2002; 137(3): 156-63.(3iiiDiv)
3) Killick SB, et al. A pilot study of antithymocyte globulin(ATG)in the treatment of patients with ‘low-risk’ myelodysplasia. Br J Haematol. 2003; 120(4): 679-84.(3iiiDiv)
4) Komrokji RS, et al. A phase II multicenter rabbit anti-thymocyte globulin trial in patients with myelodysplastic syndromes identifying a novel model for response prediction. Haematologica. 2014; 99(7): 1176-83.(3iiiDiv)
5) Broliden PA, et al. Antithymocyte globulin and cyclosporine A as combination therapy for low-risk non-sideroblastic myelodysplastic syndromes. Haematologica. 2006; 91(5): 667-70.(3iiiDiv)
6) Passweg JR, et al. Immunosuppressive therapy for patients with myelodysplastic syndrome: a prospective randomized multicenter phase III trial comparing antithymocyte globulin plus cyclosporine with best supportive care--SAKK 33/99. J Clin Oncol. 2011; 29(3): 303-9.(1iiDiv)
7) Shimamoto T, et al. Cyclosporin A therapy for patients with myelodysplastic syndrome: multicenter pilot studies in Japan. Leuk Res. 2003; 27(9): 783-8.(3iiDiv)
8) Ishikawa T, et al. A prospective study of cyclosporine A treatment of patients with low-risk myelodysplastic syndrome: presence of CD55(-)CD59(-)blood cells predicts platelet response. Int J Hematol. 2007; 86(2): 150-7.(3iiiDiv)
9) Ogata M, et al. Response to cyclosporine therapy in patients with myelodysplastic syndrome: a clinical study of 12 cases and literature review. Int J Hematol. 2004; 80(1): 35-42.(3iiiDiv)
10)Chen S, et al. Treatment of myelodysplastic syndrome with cyclosporin A. Int J Hematol. 2007; 85(1): 11-7.(3iiiDiv)
11)Wang H, et al. Clinical significance of a minor population of paroxysmal nocturnal hemoglobinuria-type cells in bone marrow failure syndrome. Blood. 2002; 100(12): 3897-902.(3iiiDiv)
12)Yamada T, et al. Immunosuppressive therapy for myelodysplastic syndrome: efficacy of methylprednisolone pulse therapy with or without cyclosporin A. J Cancer Res Clin Oncol. 2003; 129(8): 485-91.(3iiiDiv)
13)Saunthararajah Y, et al. HLA-DR15(DR2)is overrepresented in myelodysplastic syndrome and aplastic anemia and predicts a response to immunosuppression in myelodysplastic syndrome. Blood. 2002; 100(5): 1570-4.(3iiiDiv)
14)Xiao L, et al. The use of selective immunosuppressive therapy on myelodysplastic syndromes in targeted populations results in good response rates and avoids treatment-related disease progression. Am J Hematol. 2012; 87(1): 26-31.(3iiiDiv)
15)Jerez A, et al. STAT3 mutations indicate the presence of subclinical T-cell clones in a subset of aplastic anemia and myelodysplastic syndrome patients. Blood. 2013; 122(14): 2453-9.(3iiiDiv)
16)Stahl M, et al. Use of immunosuppressive therapy for management of myelodysplastic syndromes: a systematic review and meta-analysis. Haematologica. 2020; 105(1): 102-11.(3iiiDiv)
17)Stahl M, et al. The use of immunosuppressive therapy in MDS: clinical outcomes and their predictors in a large international patient cohort. Blood Adv. 2018; 2(14): 1765-72.(3iiiDiv)
CQ4 低リスクMDSの血球減少に対してサイトカイン療法は勧められるか
- 推奨グレード
- カテゴリー2A
血清エリスロポエチン濃度低値(200 U/Lあるいは500 U/L未満),赤血球輸血非依存あるいは低依存の貧血を伴う低リスクMDSに対して,ESA製剤(エリスロポエチンあるいはダルベポエチンα)の投与が貧血を改善させる(本邦ではダルベポエチンαのみ保険適用)。
- 推奨グレード
- カテゴリー2B
G-CSFは好中球減少を改善し,感染症リスクを低減する。著明な好中球減少症例や感染症発症時などでは,G-CSF投与による炎症増悪など全身病態への影響を観察しながら,抗菌薬と併用しG-CSFを短期間用いることを検討してよい。AMLへの進展リスクは現時点では証明されていない。
- 推奨グレード
- カテゴリー2B
G-CSFの併用は,ESA製剤への反応性を増強するが,QOLの改善は証明されていない。この目的でのG-CSFの使用は本邦では保険適用外である。
- 推奨グレード
- カテゴリー1
貧血を伴う低リスクMDS-RSに対しては,ルスパテルセプトの使用が貧血の改善に有用である。
- 推奨グレード
- カテゴリー2B
血小板減少を伴う低リスクMDSに対して,トロンボポエチン受容体作動薬は血小板数を増加させ,重篤な出血の発生率を低減するが,本邦では保険適用外である。AMLへの進展リスクや予後への負の影響は現時点では証明されていない。
解説
1.赤血球造血刺激因子(ESA)製剤
低リスクMDSの貧血に対するエリスロポエチン(EPO)投与は,一部の症例で貧血を改善する。エポエチンα(EPOα)とプラセボを比較した2つのランダム化二重盲検第Ⅲ相試験では,EPOα150 U/kg/日投与で8週後に赤血球反応率36.8%(vs. プラセボ10.8%)1),EPOα450 U/kg/週(1,050 U/kg/週まで増量可)投与では24週後に赤血球反応率31.8%(vs. プラセボ4.4%)と報告されており2),EPOα群で有意な貧血の改善が認められた。両試験に共通して,輸血低依存と血清EPO低値(200 U/L以下)が有効性の予測因子として指摘されている。また,環状鉄芽球(ring sideroblast:RS)を伴うMDSへの有効性については,前者の試験ではRARSに対してEPOαはプラセボと比較して有効性に差を認めないのに対して[EPOα 37.5% vs. プラセボ18.2%(p=0.6)]1),後者ではRARS/RCMD-RSとRA/RCMDでEPOαの有効性に有意な差を認めない(38.1% vs. 30.2%)2)。どちらの試験でもMDS-RSに対して35%程度の有効性は確認されているため,見解は確定されないものの,血清EPO値など予測因子が条件を満たせばMDS-RSに対してもEPOαの効果は期待できると考えられる。ただ,欧米レジストリデータにおけるESA製剤投与後の経過を検討した研究では,RSを伴う症例では再燃が多い傾向にあることが示唆されている3)。
ESA製剤[EPOおよびダルベポエチンα(DPO)]の有効性はその他複数の系統的レビュー,統合解析研究においても報告されている4-6)。また,スカンジナビア地域における多施設研究の結果,血清EPO値(カットオフ値100および500 U/L)と輸血依存度(カットオフ値2単位/月)を用いたスコアがEPOとG-CSF併用時の奏効予測に有用であることが示されており,ESA製剤の奏効予測ツールとして参照されている7,8)。
現在,本邦では持続性EPO製剤であるDPOのみが保険承認されているが,これまでの臨床試験では38~72%の奏効率が報告されている9)。ドイツでは,Hb 10 g/dL以下かつ治療前EPO値500 U/L以下のIPSS low/int-1 146例を対象に,DPO 500μg 3週間ごとの投与による5~24週までの赤血球輸血依存離脱を主要評価項目としたプラセボ対照二重盲検第Ⅲ相試験が行われ,輸血施行患者がDPO群36.1%に対して,プラセボ群59.2%とDPO群で有意な輸血低減が報告されている10)。
日本および韓国で,血清EPO濃度500 U/L未満の低リスクMDSを対象とするESA製剤の用量反応試験としてDPO 60μg,120μg,240μg週1回投与のランダム割り付け試験が行われ,輸血量が50%以上減少する効果はそれぞれの用量で64.7%,44.4%,66.7%(群間に統計学的有意差なし)であり,全体としての効果は58.0%に認められた11)。本試験の結果をもとに,DPOは低リスクMDSに伴う貧血に対して本邦の保険適用を取得し,推奨用量は240μgとなっている。
なお,血清EPO値はHb値と強い負の相関を示す。本邦の低リスクMDSを対象とした解析では,EPO 500 U/Lに相当するHb濃度は7.6 g/dL12),8.29 g/dL13)と報告されており,このHb濃度では多くの症例が輸血非依存であった。DPOは血清EPO値が500 U/L以上であっても投与することは可能だが,EPO値が低く,輸血量が少ない例での反応性が良いことは考慮すべきであり,Hb値を参考にしながら,適切な時期に治療を行うことが重要である。また,DPOは高リスクMDSには有効性および安全性が評価されていないため投与しない。
2.顆粒球コロニー刺激因子(G-CSF)製剤
G-CSFは腫瘍細胞を増幅するリスクなどが考慮され,MDSに対して使用を避ける傾向にある。MDS 18例(16例はRAEBあるいはRAEB-tの高リスク症例)に対してG-CSFを投与した報告14)では,16例で好中球数が増加し,中止後2~4週間かけて元のレベルに戻ったこと,そして好中球数1,500 /μL以上の期間では,それ以下の期間と比較して有意に細菌感染症が抑制されたことが報告されている。AMLへの進展は3例であった。また,MDSおよびMDSから進行した二次性AMLに対して強力寛解導入療法を行った105例を対象とした,G-CSFの有無で治療成績を比較した無作為割り付け試験の結果によると15),G-CSF併用群で有意に好中球減少期間が短く,感染症が低頻度であり,奏効率も高かったことが報告されている。しかし,両群で寛解維持期間やOSに有意差は認められなかった。
EPO製剤とG-CSFの併用による治療効果を無治療のコホートと比較した研究によると16),OSはEPO+G-CSF群で有意に延長しており,AMLへの進展は両群で有意差を認めなかった。この結果はG-CSFの使用はAML進展リスクに影響を与えないことを間接的に示唆していると考えられる。
以上のことから,現時点において高リスクを含むMDSにおいてG-CSFによる腫瘍進展リスクを明確に示した報告はなく,MDSに対してG-CSFの投与を過度に避ける必要はないと考えられる。ただ,G-CSFは顆粒球系細胞機能にも影響し,炎症の増悪等に関わる可能性も考えられ,またG-CSF単独投与による生存期間の延長は証明されていないことから,G-CSFの漫然とした投与は推奨されない。G-CSFは著明な好中球減少症例や感染症発症時などに,炎症増悪など全身病態への影響を観察しながら抗菌薬と併用し,短期間用いるのが妥当と考えられる。
また,複数の臨床試験で,G-CSFの併用でESA製剤への反応性が増強することが報告されているが8,16-19),この目的でのG-CSFの使用は本邦では保険適用外である。EPO+G-CSFにおけるコストとQOLをプラセボと比較したランダム割り付け試験では,EPO+G-CSF群では有意に有効性が高かったが(10/24例vs. 0/24例),医療コストは高値であり(26,723ユーロvs. 8,746ユーロ),FACT-Anを用いたQOLでは両者に有意差が認められていない20)。
3.ルスパテルセプト
ルスパテルセプトはアクチビンⅡB型受容体/免疫グロブリンFc領域の融合タンパクであり,血中でGDF11などのTGF-β /BMPファミリー分子を捕獲することにより,標的細胞のSMADシグナルを抑制する。ルスパテルセプトは後期赤芽球分化を促進し,貧血を改善することが報告されており,特にSF3B1遺伝子変異を持つMDS-RSでは有効性が高い21,22)。ESA製剤に抵抗性あるいは不耐容の赤血球輸血依存低リスクMDS-RS 229例を対象とした,プラセボ対照二重盲検第Ⅲ相試験(MEDALIST試験)では,ルスパテルセプト群で38%に輸血依存からの離脱を認めており(プラセボ群では13%,p<0.001),ルスパテルセプトの有効性が報告されている22)。また,低リスクMDSのESA投与歴のない輸血依存例(血清EPO濃度<500 IU)の貧血に対して対照群(エポエチンα)とのランダム化比較試験(COMMANDS試験)では,ルスパテルセプト群はHb 1.5 g/dL以上の改善を伴う12週間以上の輸血非依存を達した割合で有意に対照群を上回った(ルスパテルセプト群59%,対照群31%、p<0.0001)27)。
4.トロンボポエチン受容体作動薬
トロンボポエチン受容体作動薬(TPO-RA)は血小板の増加作用を持ち,MDSにおける血小板減少の改善が期待される。しかし,TPO-RAは造血幹細胞の増殖刺激作用も併せ持つため,腫瘍クローンの増殖を介したAMLへの移行リスクが懸念されている。2014年までに発表されたランダム化臨床試験[ロミプロスチム(ROMI)4試験,エルトロンボパグ(EPAG)1試験,348例]の系統的レビューおよび統合解析では,ROMI群における出血発生率(補正値)および血小板輸血発生率はプラセボと比較してそれぞれ0.92,0.69と有意に低下していた23)。AMLの進展はバイアスのため評価不十分だが,両者に差を認めていない。ROMIとプラセボによる重篤な出血の発生率を比較したランダム化第Ⅲ相試験では,ROMI群で末梢血芽球の増加を認めたため途中で試験薬投与が中止となったが,投与された範囲での解析では,ROMI群では重篤な出血が少ない傾向にあった(HR 0.83,p=0.13)24)。本試験では長期追跡結果が解析されており,5年間の観察でAMLに進行した症例はROMI 12% vs. プラセボ11%(p=0.88)と有意差を認めず,死亡例もROMI 56% vs. プラセボ54%(p=0.89)と有意差を認めていない25)。EPAGとプラセボを比較したイタリアGFMグループによるランダム化第Ⅱ相試験でも,EPAG群で有意な血小板数の上昇[47% vs. 3%(プラセボ)]と重篤な出血率の低下[14% vs. 42%(プラセボ)]を認めており,血小板数増加と出血リスクの低下が確認されている。AMLへの移行は24週時点でEPAG 12% vs. プラセボ16%で有意差を認めていない26)。有効性を含め長期的な安全性についての評価が現在進行中である。
以上の結果より,TPO-RAは血小板減少を伴う低リスクMDSに対して,血小板数増加と重篤な出血の低減が期待されるが,本邦ではROMI,EPAGともに保険適用外である。AMLへの移行リスクについては現時点では証明されておらず,エビデンスの確立が望まれる。
参考文献
1) Italian Cooperative Study Group for rHuEpo in Myelodysplastic Syndromes.; Ferrini PR, et al. A randomized double-blind placebo-controlled study with subcutaneous recombinant human erythropoietin in patients with low-risk myelodysplastic syndromes. Br J Haematol. 1998;103(4): 1070-4.(1iDiv)
2) Fenaux P, et al. A phase 3 randomized, placebo-controlled study assessing the efficacy and safety of epoetin-α in anemic patients with low-risk MDS. Leukemia. 2018; 32(12): 2648-58.(1iDi, iv)
3) Park S, et al. Outcome of Lower-Risk Patients With Myelodysplastic Syndromes Without 5q Deletion After Failure of Erythropoiesis-Stimulating Agents. J Clin Oncol 2017; 35(14): 1591-7.(3iiiA)
4) Ross SD, et al. Efficacy and safety of erythropoiesis-stimulating proteins in myelodysplastic syndrome: a systematic review and meta-analysis. Oncologist. 2007; 12(10): 1264-73.(1iiDiv)
5) Kelaidi C, et al. High response rate and improved exercise capacity and quality of life with a new regimen of darbepoetin alfa with or without filgrastim in lower-risk myelodysplastic syndromes : a phase II study by the GFM. Ann Hematol. 2013; 92(5): 621-31.(3iiiC, Div)
6) Moyo V, et al. Erythropoiesis-stimulating agents in the treatment of anemia in myelodysplastic syndromes: a meta-analysis. Ann Hematol. 2008; 87(7): 527-36.(1iiDiv)
7) Hellström-Lindberg E, et al. Erythroid response to treatment with G-CSF plus erythropoietin for the anaemia of patients with myelodysplastic syndromes: proposal for a predictive model. Br J Haematol. 1997; 99(2): 344-51.(3iiiDiv)
8) Hellström-Lindberg E, et al. A validated decision model for treating the anaemia of myelodysplastic syndromes with erythropoietin + granulocyte colony-stimulating factor: significant effects on quality of life. Br J Haematol. 2003; 120(6): 1037-46.(3iiiDiv)
9) Park S, et al. Efficacy and safety of darbepoetin alpha in patients with myelodysplastic syndromes: a systematic review and meta-analysis. Br J Haematol. 2016; 174(5): 730-47.(1iiDiv)
10)Platzbecker U, et al. A phase 3 randomized placebo-controlled trial of darbepoetin alfa in patients with anemia and lower-risk myelodysplastic syndromes. Leukemia. 2017; 31(9): 1944-50.(1iDiv)
11)Jang JH, et al. A randomized controlled trial comparing darbepoetin alfa doses in red blood cell transfusion-dependent patients with low- or intermediate-1 risk myelodysplastic syndromes. Int J Hematol. 2015; 102(4): 401-12.(3iiiDiv)
12)Nakazaki K, et al. Distribution of serum erythropoietin levels in lower risk myelodysplastic syndrome cases with anemia. Int J Hematol. 2014; 99(1): 53-6.(3iiiDiv)
13)Suzuki T, et al. Distribution of serum erythropoietin levels in Japanese patients with myelodysplastic syndromes. Int J Hematol. 2015;101(1): 32-6.(3iiiDiv)
14)Negrin RS, et al. Maintenance treatment of patients with myelodysplastic syndromes using recombinant human granulocyte colony-stimulating factor. Blood. 1990; 76(1): 36-43.(3iiiDiv)
15)Bernasconi C, et al. Randomized clinical study comparing aggressive chemotherapy with or without G-CSF support for high-risk myelodysplastic syndromes or secondary acute myeloid leukaemia evolving from MDS. Br J Haematol. 1998; 102(3): 678-83.(1iiDiv)
16)Jädersten M, et al. Erythropoietin and granulocyte-colony stimulating factor treatment associated with improved survival in myelodysplastic syndrome. J Clin Oncol. 2008; 26(21): 3607-13.(3iiiA)
17)Balleari E, et al. Erythropoietin plus granulocyte colony-stimulating factor is better than erythropoietin alone to treat anemia in low-risk myelodysplastic syndromes: results from a randomized single-centre study. Ann Hematol. 2006; 85(3): 174-80.(3iiiC, Div)
18)Greenberg PL, et al. Treatment of myelodysplastic syndrome patients with erythropoietin with or without granulocyte colony-stimulating factor: results of a prospective randomized phase 3 trial by the Eastern Cooperative Oncology Group(E1996). Blood. 2009; 114(12): 2393-400.(1iiA, Div)
19)Hellström-Lindberg E, et al. Treatment of anemia in myelodysplastic syndromes with granulocyte colony-stimulating factor plus erythropoietin: results from a randomized phase II study and long-term follow-up of 71 patients. Blood. 1998; 92(1): 68-75.(3iiiDiv)
20)Casadevall N, et al. Health, economic, and quality-of-life effects of erythropoietin and granulocyte colony-stimulating factor for the treatment of myelodysplastic syndromes: a randomized, controlled trial. Blood. 2004; 104(2): 321-7.(1iiB, Div)
21)Platzbecker U, et al. Luspatercept for the treatment of anaemia in patients with lower-risk myelodysplastic syndromes(PACE-MDS): a multicentre, open-label phase 2 dose-finding study with long-term extension study. Lancet Oncol. 2017; 18(10): 1338-47.(3iiiDiv)
22)Fenaux P, et al. Luspatercept in Patients with Lower-Risk Myelodysplastic Syndromes. N Engl J Med. 2020; 382(2): 140-51.(1iDiv)
23)Prica A, et al. Safety and efficacy of thrombopoietin-receptor agonists in myelodysplastic syndromes: a systematic review and meta-analysis of randomized controlled trials. Br J Haematol. 2014; 167(5): 626-38.(1iiB)
24)Giagounidis A, et al. Results of a randomized, double-blind study of romiplostim versus placebo in patients with low/intermediate-1-risk myelodysplastic syndrome and thrombocytopenia. Cancer. 2014; 120(12): 1838-46.(3iiiDiv)
25)Kantarjian HM, et al. Long-term follow-up for up to 5 years on the risk of leukaemic progression in thrombocytopenic patients with lower-risk myelodysplastic syndromes treated with romiplostim or placebo in a randomised double-blind trial. Lancet Haematol. 2018; 5(3): e117-26.(3iiiA)
26)Oliva EN, et al. Eltrombopag versus placebo for low-risk myelodysplastic syndromes with thrombocytopenia(EQoL-MDS): phase 1 results of a single-blind, randomised, controlled, phase 2 superiority trial. Lancet Haematol. 2017; 4(3): e127-36.(3iiiDiv)
27)Platzbecker U, et al. Efficacy and safety of luspatercept versus epoetin alfa in erythropoiesis-stimulating agent-naive, transfusion-dependent, lower-risk myelodysplastic syndromes (COMMANDS): interim analysis of a phase 3, open-label, randomised controlled trial. Lancet. 2023 Jul 29;402(10399):373-385.(1iiDiv)
CQ5 低リスクMDSの貧血に対して蛋白同化ステロイド,ビタミンD,ビタミンKは勧められるか
- 推奨グレード
- カテゴリー2B
低リスクMDSの貧血に対する蛋白同化ステロイドの有効性は一部の症例に限られており,標準治療としての使用は推奨されない(国内保険適用外)。ビタミンD,ビタミンKの効果はいずれも少数例での検討の報告であるが,サイトカイン不応あるいは不耐容の場合,ビタミンD,ビタミンKの使用を考慮しても良い(国内保険適用外)。
解説
1989年にメキシコのグループが報告した,50例のMDSを対象とした二重盲検比較試験において,ダナゾール(DNZ)600mg/日を投与した23例のうち6例にCR(Hb>12g/dL,顆粒球数>1,500/μL,血小板数>150,000/μL)が得られたと報告されている1)。その後,フランスのグループからDNZ 600mg/日を投与したMDS 76例を対象とした後方視的解析の結果が報告されているが,担当医によって有効と判定された9例の患者を含めて有意な血球回復が認められなかったと報告されている2)。Mayoクリニックからの46例の芽球増加のないMDSを対象としたDNZ 800mg/日と13-cis-レチノイン酸の比較試験では,有効例は34例中2例(6%)にすぎなかったと報告されている3)。国内からの報告では,単施設における少数例の後方視的検討ではあるものの,1975年からの14年間に蛋白同化ステロイドの投与を受けた不応性貧血(RA)27例のうち11例(40.7%)に反応がみられたとの報告がある4)。なお,米国の単一施設におけるDNZの後方視的検討では,DNZ 600mg/日を投与した33例中25例(76%)に血小板増加を認め,9例中7例は血小板輸血非依存を達成し,奏効期間中央値は10カ月(2~68カ月)であり,血小板増加はFAB分類,IPSSに非依存であったと報告されている5)。
1998年にスペインのバルセロナ大学が報告した,6例のCMMLを含む19例のMDSを対象としたビタミンD3の前方視的試験において,11例に奏効が認められたが,ビタミンD代謝産物のベースラインレベルと反応との間に相関は認められなかったと報告されている6)。2000年に本邦の厚生労働省「特発性造血障害に関する調査研究班」が報告した,ビタミンK2に関する全国アンケート調査による症例集積研究では,11施設のビタミンK2の投与を受けたMDS 50例のうちRAの20%で血球改善がみられ,RAEB-tの50%およびMDSから移行したAMLの71.7%で骨髄および末梢血芽球の減少を認めたことが報告されている7)。その後,金沢大学からMDS(RA)18例を対象としたランダム化比較試験において支持療法群の血球回復例は11%に対して,ビタミンK2を投与した9例中3例でHb,3例で好中球,2例で血小板の上昇を認めて全体の有効性が56%であったと報告されている8)。九州大学における前方視的試験では,ビタミンK2を投与されたMDSのうちHb値が2g/dL以上の増加を示した例が6例(MDS:RAの有効率46%)認められたことが報告された9)。国内の多施設における38例のMDS(RA 27例,RCMD 11例)を対象とした前方視的研究では,ビタミンK2単剤(45mg/日)で貧血と血小板減少の両方が改善した症例が4例,血小板減少が改善した症例が1例で奏効率は13%(5/38例)であり,ビタミンK2単剤で非奏効であった20例に対するビタミンD3(0.75μg/日)の併用投与では赤血球反応は55%(11例中6例)で認め,血小板反応は27%(11例中3例)で奏効率は30%(20例中6例)であったと報告されている10)。いずれも国内を中心とした少数例での検討の報告であり,多数例での検証の必要性がある。しかし,低リスクMDSへの一定の効果を考えると,ビタミンD,ビタミンKの使用も考慮可能と考えられる。
参考文献
1) Avilés A, et al. Randomized study of danazol vs. placebo in myelodysplastic syndromes. Arch Invest Med(Mex). 1989; 20(2): 183-8.(1iDiv)
2) Chabannon C, et al. A review of 76 patients with myelodysplastic syndromes treated with danazol. Cancer. 1994; 73(12): 3073-80.(3iiiDiv)
3) Letendre L, et al. Myelodysplastic syndrome treatment with danazol and cis-retinoic acid. Am J Hematol. 1995; 48(4): 233-6.(3iiiDiv)
4) Kobaba R, et al. Androgen in the treatment of refractory anemia. Int J Hematol. 1991; 54(2): 103-7.(3iiiDiv)
5) Chan G, et al. Danazol for the treatment of thrombocytopenia in patients with myelodysplastic syndrome. Am J Hematol. 2002; 71(3): 166-71.(3iDiv)
6) Mellibovsky L, et al. Vitamin D treatment in myelodysplastic syndromes. Br J Haematol.1998; 100(3): 516-20.(2iiDiv)
7) Miyazawa K, et al. Vitamin K2 therapy for myelodysplastic syndromes(MDS)and post-MDS acute myeloid leukemia: information through a questionnaire survey of multi-center pilot studies in Japan. Leukemia 2000; 14(6): 1156-7.(3iiiDiv)
8) Takami A, et al. Menatetrenone, a vitamin K2 analog, ameliorates cytopenia in patients with refractory anemia of myelodysplastic syndrome. Ann Hematol 2002; 81(1): 16-9.(1iiDiv)
9) 安部康信ほか.骨髄異形成症候群におけるビタミン K2 の使用経験.臨床血液.2002;43(2): 117-21.(2iiDiv)
10)Akiyama N, et al. Multicenter phase II trial of vitamin K(2)monotherapy and vitamin K(2)plus 1alpha-hydroxyvitamin D(3)combination therapy for low-risk myelodysplastic syndromes. Leuk Res. 2010; 34(9): 1151-7.(2Div)
CQ6 低リスクMDSに対してレナリドミドは勧められるか
- 推奨グレード
- カテゴリー1
5番染色体長腕の欠失[del(5q)]を伴う低リスクMDSで赤血球輸血依存例に対してはレナリドミドが赤血球造血促進効果を示し,レナリドミドによる治療が推奨される。10mg/日の21日間投与を28日サイクルで実施する。
- 推奨グレード
- カテゴリー2B
del(5q)を伴わない赤血球輸血依存低リスクMDSに対しては,赤血球輸血非依存が達成される例がみられるが,現時点では第一選択薬としては推奨されない(国内保険適用外)。
解説
レナリドミド(LEN)はサリドマイド(THAL)の誘導体で,免疫調節をはじめとして生体に対して多彩な効果を発揮する。5番染色体長腕の欠失を伴うMDSで赤血球輸血依存例を対象とした第Ⅱ相試験1),第Ⅲ相試験2)において赤血球輸血量の減少効果が明らかに認められている。また,国内でも少数例ながら第Ⅱ相試験が実施され,その結果を受けて本邦での承認・保険適用に至った3)。
米国を中心とした第Ⅱ相試験においては148例が登録され,赤血球系改善が67%にみられ,さらに45例で細胞遺伝学的寛解(CyR)が得られた1)。
欧州で行われたLEN 10mg/日,5mg/日,プラセボによる二重盲検試験では26週を超える輸血非依存達成はそれぞれ56.1%,42.6%,5.9%であり,有意にLEN治療が優っていた(p<0.001)。細胞遺伝学的反応性もLEN 10mg/日,5mg/日群でそれぞれ50.0%,25.0%に観察された。白血病への移行は3群間で差はなかった。有害事象も重篤なものはなかった。本試験では16週での試験治療群クロスオーバーが一部で認められていたが,OSでは3群間に有意差を認めなかった2)。
国内の試験では低リスク11例が登録され,赤血球系改善は全例に,CyRは3例にみられた3)。同様にdel(5q)を有するMDSに対するLENの有効性を示す試験としては,欧州での輸血依存を呈する低リスクMDSを対象とした第Ⅲ相試験4),ドイツ国内における第Ⅱ相試験5),イタリア国内での登録データベースを用いた後方視的・前方視的観察研究6)などが報告されている。また,del(5q)を伴う症例に対するLENは赤血球造血改善率のみでなく,QOLおよび健康関連QOL(HRQOL)改善をもたらすとする報告7,8)もある。
del(5q)を伴う低リスクMDSに対するLENの効果予測因子としては,血小板数および好中球数の減少が赤血球輸血依存性の改善と有意な相関を示す9),TP53強発現例でAMLへの進展率が有意に高くOSも低下傾向である10)などの報告がある。LENの投与に対して赤血球造血改善が認められない症例においてはエリスロポエチン(EPO)製剤の併用が有効であるとする報告(MDSCQ6-3)11)がある。
del(5q)の有無を問わない貧血または赤血球輸血依存性を有するMDSに対して米国で行われたLEN(25mg連日,10mg連日,28日サイクルで10mgを21日間)による赤血球造血改善率の有効性を検証する第Ⅰ/Ⅱ相試験では,del(5q)を伴う例の83%,正常核型の57%,その他の染色体異常の12%で赤血球造血改善がみられ12),これを受けてdel(5q)を伴う例を対象とした試験が行われた1)。del(5q)を伴わない輸血依存低リスクMDSに対しては米国で第Ⅱ相試験が実施され,LEN 28日サイクルで10mg/日を21日間の効果が検証された。214例のうち,赤血球輸血非依存達成率は26%で,これらの症例におけるHb上昇中央値は3.2g/dL,その持続期間の中央値は41週であった13)。この結果をもとに米国を中心とし日本を含む多施設共同研究において第Ⅲ相試験が実施され,赤血球輸血非依存達成率は26.9%,その持続期間の中央値が8.2カ月と同様の結果が報告されている14)。同研究における安全性についての解析において,Grade 3/4の治療に起因する有害事象の発生率はプラセボと比較して治療群において高かった(86% vs. 44%)が,感染・出血性事象とのリスクとの相関は示されず,AMLや二次がんの発生率は両群間で類似しており,Grade 3/4の非血液毒性は稀であった15)。また,QOLの改善もLEN治療群で示されている16)。欧州においても赤血球造血刺激因子(ESA)製剤に抵抗性のdel(5q)を伴わない低リスクMDSを対象とした第Ⅱ相試験17)が行われ,ESA抵抗例に対する二次治療としてのLENの有効性が示唆された。この結果を受け,フランスにおける第Ⅲ相試験において,del(5q)を伴わないEPO製剤抵抗性の低リスクMDSに対してLENとEPO製剤の併用の有効性が示された18)。米国においてもdel(5q)を伴わないEPO製剤抵抗性の低リスクMDSに対するLENとEPO製剤の併用の有無を比較する第Ⅲ相試験が行われ,LENとEPO製剤併用療法はLEN単剤より優れた赤血球造血改善率が得られる(28.3% vs. 11.5%)ことが示された19)。その他の併用薬としてはプレドニゾロン併用の有効性を示す第Ⅱ相試験の結果が報告されている20)。これらの結果から,LENがdel(5q)を伴わないMDSに対して一定の有効性を示すことが期待されるが,国内ではdel(5q)を伴わない低リスクMDSに対してはLENは承認されていない(国内保険適用外)。
参考文献
1) List A, et al. Lenalidomide in the myelodysplastic syndrome with chromosome 5q deletion. N Engl J Med. 2006; 355(14): 1456-65.(2Div)
2) Fenaux P, et al. A randomized phase 3 study of lenalidomide versus placebo in RBC transfusion-dependent patients with Low-/Intermediate-1-risk myelodysplastic syndromes with del5q. Blood. 2011; 118(14): 3765-76.(1iDiv)
3) Harada H, et al. Lenalidomide is active in Japanese patients with symptomatic anemia in low- or intermediate-1 risk myelodysplastic syndromes with a deletion 5q abnormality. Int J Hematol. 2009; 90(3): 353-60.(2Div)
4) Giagounidis A, et al. Outcomes in RBC transfusion-dependent patients with Low-/Intermediate-1-risk myelodysplastic syndromes with isolated deletion 5q treated with lenalidomide: a subset analysis from the MDS-004 study. Eur J Haematol. 2014; 93(5): 429-38.(1iDiv/1iA)
5) Schuler E, et al. Results of a multicenter prospective phase II trial investigating the safety and efficacy of lenalidomide in patients with myelodysplastic syndromes with isolated del(5q)(LE-MON 5). Leukemia. 2016; 30(7): 1580-2.(3iiiDiv)
6) Arcioni F, et al. Lenalidomide treatment of myelodysplastic syndromes with chromosome 5q deletion: Results from the National Registry of the Italian Drug Agency. Eur J Haematol. 2018; 101(1): 78-85. (3iiDiv)
7) Oliva EN, et al. Lenalidomide in International Prognostic Scoring System Low and Intermediate-1 risk myelodysplastic syndromes with del(5q): an Italian phase II trial of health-related quality of life, safety and efficacy. Leuk Lymphoma. 2013; 54(11): 2458-65.(2Div)
8) Revicki DA, et al. Health-related quality of life outcomes of lenalidomide in transfusion-dependent patients with Low- or Intermediate-1-risk myelodysplastic syndromes with a chromosome 5q deletion: results from a randomized clinical trial. Leuk Res. 2013; 37(3): 259-65.(1iC)
9) Sekeres MA, et al. Relationship of treatment-related cytopenias and response to lenalidomide in patients with lower-risk myelodysplastic syndromes. J Clin Oncol. 2008; 26(36): 5943-9.(2Div)
10)Saft L, et al. p53 protein expression independently predicts outcome in patients with lower-risk myelodysplastic syndromes with del(5q). Haematologica. 2014; 99(6): 1041-9.(1iDiv)
11)Komrokji RS, et al. Combined treatment with lenalidomide and epoetin alfa in lower-risk patients with myelodysplastic syndrome. Blood. 2012;1 20(17): 3419-24.(2Div)
12)List A, et al. Efficacy of lenalidomide in myelodysplastic syndromes. N Engl J Med. 2005; 352(6): 549-57.(2Div)
13)Raza A, et al. Phase 2 study of lenalidomide in transfusion-dependent, low-risk, and intermediate-1 risk myelodysplastic syndromes with karyotypes other than deletion 5q. Blood. 2008; 111(1): 86-93.(2Div)
14)Santini V, et al. Randomized Phase III Study of Lenalidomide Versus Placebo in RBC Transfusion-Dependent Patients With Lower-Risk Non-del(5q)Myelodysplastic Syndromes and Ineligible for or Refractory to Erythropoiesis-Stimulating Agents. J Clin Oncol. 2016; 34(25): 2988-96.(1iDiv)
15)Almeida A, et al. Safety profile of lenalidomide in patients with lower-risk myelodysplastic syndromes without del(5q): results of a phase 3 trial. Leuk Lymphoma. 2018; 5(9): 2135-43.(1iDiv)
16)Santini V, et al. The Effect of Lenalidomide on Health-Related Quality of Life in Patients With Lower-Risk Non-del(5q)Myelodysplastic Syndromes: Results From the MDS-005 Study. Clin Lymphoma Myeloma Leuk. 2018; 18(2): 136-44.e7.(1iDiv)
17)Sibon D, et al. Lenalidomide in lower-risk myelodysplastic syndromes with karyotypes other than deletion 5q and refractory to erythropoiesis-stimulating agents. Br J Haematol. 2012; 156(5): 619-25.(3iiiDiv)
18)Toma A, et al. Lenalidomide with or without erythropoietin in transfusion-dependent erythropoiesis-stimulating agent-refractory lower-risk MDS without 5q deletion. Leukemia. 2016; 30(4): 897-905.(1iiDiv)
19)List AF, et al. Lenalidomide-Epoetin Alfa Versus Lenalidomide Monotherapy in Myelodysplastic Syndromes Refractory to Recombinant Erythropoietin. J Clin Oncol. 2021; 39(9): 1001-9.(1iiDiv)
20)Komrokji RS, et al. Lenalidomide and Prednisone in Low and Intermediate-1 IPSS Risk, Non-Del(5q)Patients With Myelodysplastic Syndromes: Phase 2 Clinical Trial. Clin Lymphoma Myeloma Leuk. 2019; 19(4): 251-4.(2Div)
CQ7 低リスクMDSにアザシチジンは勧められるか
- 推奨グレード
- カテゴリー2B
生存期間延長を目的とした第一選択薬としてのアザシチジンの使用は推奨されない。予後不良と予想される低リスクMDSの一部でアザシチジンによる造血の回復が認められる。しかし,これが生存期間の延長につながるかは明らかではない。
解説
低リスクMDSに対するアザシチジン(AZA)の有効性,安全性はさまざまな対象,投与法での検討がなされているが,複数の前方視的試験において一定の血液学的反応が報告されている。しかし,初回治療としての生存期間延長効果を検証するランダム化比較試験は実施されておらず,後方視的な検討を含めて生存期間を延長するという明確なデータはない1,2)。高リスクMDSではAZAによる生存延長効果が示されているものの(CQ10参照),現時点で低リスクMDSの生存期間延長を目的とした第一選択薬としての使用は推奨されない。
エリスロポエチン(EPO)製剤不応,輸血依存の低リスクMDSに対するAZA(5日間投与)と最良支持療法とのランダム化比較試験では主要評価項目である赤血球系反応はAZA群が有意に良好であったが,副次評価項目の一つである生存期間については差がなかった1)。輸血依存,EPO製剤不応,リスクが高いと考えられる例などに対して前方視的にAZAが投与され,その結果が報告されているが,赤血球輸血非依存達成は試験によって16.3%程度から47.4%程度までさまざまである1,3-11)。AZAの安全性についてはほとんどの試験で許容されると結論されている。AZA投与を受けた低リスクMDS 438例の後方視的解析では,全奏効割合36%,治療コース数中央値6(1~64コース),奏効期間中央値7カ月と報告されており12),他の報告でもほぼ同様である。実臨床の場面での解析においても,低リスクMDSにおいてAZAによる血液学的改善,輸血依存離脱が得られる例があることを示唆する報告がある13)。低リスクMDSに対するAZA投与スケジュールについても投与量,投与日数,さらにdecitabineとの比較などが前方視的試験,後方視的試験で検討されているが,全奏効,血液学的反応に関して最良の投与法は明らかになっておらず,decitabineとの優劣も明らかではない4,5,11,14-18)。高リスクMDSへの標準的投与法(75mg/m2,7日間,4週サイクル)に加えて,何らかの減量スケジュールも試みられているが,減量スケジュールの優位性は明らかではない。EPO製剤不応例へのAZA追加はAZA単剤と同等であり,AZAの著しい減量投与法(50mg/m2,3日/週,2週投与/4週)が推奨されないことは示されている19)一方で,低リスクMDSであってもAZA治療不成功例の予後は不良とされている12,20)。
参考文献
1) Sanchez-Garcia J, et al. Prospective randomized trial of 5 days azacitidine versus supportive care in patients with lower-risk myelodysplastic syndromes without 5q deletion and transfusion-dependent anemia. Leuk Lymphoma. 2018; 59(5): 1095-104.(1iiDiv)
2) Toriyama E, et al. No clear survival benefit of azacitidine for lower-risk myelodysplastic syndromes: A retrospective study of Nagasaki. Cancer Sci. 2020; 111(12): 4490-9.(3iiiA)
3) Zeidan AM, et al. RBC transfusion independence among lower risk MDS patients receiving hypomethylating agents: a population-level analysis. Leuk Lymphoma. 2019; 60(13): 3181-7.(3iiiDiv)
4) Morita Y, et al. Five-day regimen of azacitidine for lower-risk myelodysplastic syndromes(refractory anemia or refractory anemia with ringed sideroblasts): A prospective single-arm phase 2 trial. Cancer Sci. 2018; 109(10): 3209-15.(3iiiDiv)
5) Jabbour E, et al. Randomized phase 2 study of low-dose decitabine vs low-dose azacitidine in lower-risk MDS and MDS/MPN. Blood. 2017; 130(13): 1514-22.(3iiiDiv)
6) Park S, et al. Outcome of Lower-Risk Patients With Myelodysplastic Syndromes Without 5q Deletion After Failure of Erythropoiesis-Stimulating Agents. J Clin Oncol. 2017; 35(14): 1591-7.(3iiiA)
7) Thépot S, et al. A randomized phase II trial of azacitidine +/- epoetin-β in lower-risk myelodysplastic syndromes resistant to erythropoietic stimulating agents. Haematologica. 2016; 101(8): 918-25.(3iiiDiv)
8) Falantes J, et al. Multivariable time-dependent analysis of the impact of azacitidine in patients with lower-risk myelodysplastic syndrome and unfavorable specific lower-risk score. Leuk Res. 2015; 39(1): 52-7.(3iiiA)
9) Tobiasson M, et al. Limited clinical efficacy of azacitidine in transfusion-dependent, growth factor-resistant, low- and Int-1-risk MDS: Results from the nordic NMDSG08A phase II trial. Blood Cancer J. 2014; 4: e189.(3iiiDiv)
10)Filì C, et al. Prospective phase II Study on 5-days azacitidine for treatment of symptomatic and/or erythropoietin unresponsive patients with low/INT-1-risk myelodysplastic syndromes. Clin Cancer Res. 2013; 19(12): 3297-308.(3iiiDiv)
11)Lyons RM, et al. Hematologic response to three alternative dosing schedules of azacitidine in patients with myelodysplastic syndromes. J Clin Oncol. 2009; 27(11): 1850-6.(3iiiDiv)
12)Jabbour EJ, et al. Outcome of patients with low-risk and intermediate-1-risk myelodysplastic syndrome after hypomethylating agent failure: a report on behalf of the MDS Clinical Research Consortium. Cancer. 2015; 121(6): 876-82.(3iiiA)
13)Grinblatt DL, et al. Patients with myelodysplastic syndromes treated with azacitidine in clinical practice: the AVIDA registry. Leuk Lymphoma. 2015; 56(4): 887-95.(3iiiDiv)
14)Lee BH, et al. Comparison between 5-day decitabine and 7-day azacitidine for lower-risk myelodysplastic syndromes with poor prognostic features: a retrospective multicentre cohort study. Sci Rep. 2020; 10(1): 39.(3iiiA/3iiiDiv/3iiiDiii)
15)Baek DW, et al. Response to hypomethylating agents improves long-term outcomes for lower-risk patients with myelodysplastic syndrome in case-matched cohorts. Ann Hematol. 2018; 97(12): 2309-17.(3iiiA)
16)Lee JH, et al. Benefits of hypomethylating therapy in IPSS lower-risk myelodysplastic syndrome patients: A retrospective multicenter case series study. Leuk Res. 2017; 60: 135-44.(3iiiDiv/3iiiA/3iiiDiii)
17)Cogle CR, et al. Early treatment initiation in lower-risk myelodysplastic syndromes produces an earlier and higher rate of transfusion independence. Leuk Res. 2017; 60: 123-8.(3iiiDiv)
18)Musto P, et al. Azacitidine for the treatment of lower risk myelodysplastic syndromes: a retrospective study of 74 patients enrolled in an Italian named patient program. Cancer. 2010; 116(6): 1485-94.(3iiiDiv)
19)Sayar H, et al. Thrice weekly azacitidine does not improve hematological responses in lower-risk myelodysplastic syndromes: a study of the Hoosier Oncology Group. Leuk Res. 2011; 35(8): 1108-10.(3iiiDiv)
20)Prébet T, et al. Outcome of patients with low-risk myelodysplasia after azacitidine treatment failure. Haematologica. 2013; 98(2): e18-9.(3iiiA)
CQ8 MDSに対する同種造血細胞移植の適応基準は何か,また適切な実施時期はいつか
- 推奨グレード
- カテゴリー2A
高リスクMDSでは速やかに同種造血細胞移植を行う。HLA適合血縁者または非血縁者間移植が望ましいが,HLA適合ドナーが得られない場合は,HLA不適合の血縁者または非血縁者間移植や臍帯血移植,HLA半合致移植も考慮する。
- 推奨グレード
- カテゴリー2A
低リスクMDSでは同種造血細胞移植は推奨されないが,高リスクへの進行がみられた場合には考慮する。
解説
MDSに対する有効な薬物療法は現時点では限られており,治癒が期待できる治療は同種造血細胞移植(移植)のみである。しかし,MDSは病勢や合併症の有無等が多様であるため,まずは予後予測に頻用されるIPSS等によりリスク分類を行い,適応を判断する必要がある。特に高リスクMDSは予後不良であるため,HLAが適合した血縁または非血縁ドナーが得られる場合には速やかに移植を実施すべきである。これまでに報告されている前方視的臨床試験における高リスクMDSの定義は,IPSSのHighおよびInt-2とした試験や,左記に加えInt-1で予後不良核型または血小板輸血依存性等を含む試験がある1-3)。低リスクMDSはその他の治療法でも比較的長期の生存が期待できるため,移植の適応は慎重に考慮すべきである。血球減少が高度で輸血依存性の強い症例,重症感染症や出血の高リスク例で他の治療が無効の場合には移植を検討する。不応性貧血(RA)および環状鉄芽球を伴うRA(RARS)症例で,かつ移植前にRA/RARSから芽球増加を伴うRA(RAEB)に進行した症例は除外した群を対象とした解析において,診断から移植までの期間が12カ月以上の群はそれ未満の群に比べOSが有意に低かったことから,移植適応がある症例において移植実施時期をむやみに遅らせることは好ましくない4)。
Markov modelを用いた移植時期の解析では,IPSSでLowまたはInt-1では移植を遅らせることで生存期間が延長し,Int-2またはHighでは速やかに移植することで生存期間が延長したとの結果が報告されている5)。一方で類似の解析により,移植を遅らせることでIPSSのLowおよびWPSSのLowでは推定余命が延長し,IPSSのInt-1以上およびWPSSのIntermediate以上では推定余命が短縮することを示した報告もある6)。IPSS-Rを用いた解析では,Very lowまたはLowの症例はIntermediateに進行するまで移植を遅らせることで余命が延長すること,それよりも高いリスクにおいては移植の遅れが余命を短縮すること,またIPSS-RとIPSSとの比較では29%の症例で移植の方針が変わり約2年間の余命延長につながることが報告された7)。
MDSは高齢者に多い疾患であるため,移植適応の年齢上限を規定することは重要であるが,高齢者は個人差が大きいことから,暦年齢で一律に上限を規定することは困難である。先に挙げた前方視的試験1-3)では年齢上限を70~75歳としているが,年齢がOSに影響を与えるかどうかは1試験で有意差なしと記載されているだけで,明らかにはされていない。後方視的研究では症例選択バイアスの影響を考慮する必要はあるが,年齢とOSには相関がないという報告が多い8)。
代替移植片からの移植,特にHLA適合度に関する検討は現時点では後方視的研究に限られ,解析対象症例はあまり多くはないが,米国Center for International Blood and Marrow Transplant Research(CIBMTR)からは,移植後シクロホスファミド投与(PT-Cy)を併用したHLA半合致血縁者間移植はHLA適合非血縁ドナーからの移植に劣らないと報告されている9)。わが国のTransplant Registry Unified Management Program(TRUMP)データ解析では,PT-Cyを用いたHLA半合致血縁者間移植は,HLA一致血縁者間移植,非血縁骨髄移植,非血縁者間末梢血幹細胞移植に劣らない治療成績であった10,11)。臍帯血移植は欧米ではあまり行われておらず多数例での検討は本邦の研究結果に限られるが,TRUMPデータの解析から許容可能な代替移植片と報告されている12)。日本造血細胞移植データセンターの全国調査報告書(2020年度)によると,16歳以上の高リスクMDSに対し直近10年間(2010~2019年)に行われた移植の5年OSは,HLA合致同胞からの移植が43.6%,非血縁者間骨髄移植が43.0%,臍帯血移植が38.4%と報告されており,代替移植片を用いた移植であっても一定の長期生存が認められている13)。
これらの結果から,移植適応は70歳前後まで考慮すべきであり,移植耐容能があると判断される高リスクMDSでは速やかに移植を行い,一方,低リスクMDSでは高リスクへ進行した際に移植を検討するのが妥当と考えられる。
参考文献
1) Robin M, et al. HLA-matched allogeneic stem cell transplantation improves outcome of higher risk myelodysplastic syndrome A prospective study on behalf of SFGM-TC and GFM. Leukemia. 2015; 29(7): 1496-501.(2A)
2) Nakamura R, et al. Biologic Assignment Trial of Reduced-Intensity Hematopoietic Cell Transplantation Based on Donor Availability in Patients 50-75 Years of Age With Advanced Myelodysplastic Syndrome. J Clin Oncol. 2021; 39(30): 3328-39.(2A)
3) Kröger N, et al. Comparison Between 5-Azacytidine Treatment and Allogeneic Stem-Cell Transplantation in Elderly Patients With Advanced MDS According to Donor Availability(VidazaAllo Study). J Clin Oncol. 2021; 39(30): 3318-27.(2A)
4) de Witte T, et al. Allogeneic stem cell transplantation for patients with refractory anaemia with matched related and unrelated donors: delay of the transplant is associated with inferior survival. Br J Haematol. 2009; 146(6): 627-36.(3iiiA)
5) Cutler CS, et al. A decision analysis of allogeneic bone marrow transplantation for the myelodysplastic syndromes: delayed transplantation for low-risk myelodysplasia is associated with improved outcome. Blood. 2004; 104(2): 579-85.(3iiiA)
6) Alessandrino EP, et al. Optimal timing of allogeneic hematopoietic stem cell transplantation in patients with myelodysplastic syndrome. Am J Hematol. 2013; 88(7): 581-8.(3iiiA)
7) Della Porta MG, et al. Decision analysis of allogeneic hematopoietic stem cell transplantation for patients with myelodysplastic syndrome stratified according to the revised International Prognostic Scoring System. Leukemia. 2017; 31(11): 2449-57.(3iiiA)
8) Aoki K, et al. Allogeneic haematopoietic cell transplantation with reduced-intensity conditioning for elderly patients with advanced myelodysplastic syndromes: a nationwide study. Br J Haematol. 2015; 168(3): 463-6.(3iiiA)
9)Grunwald MR, et al. Alternative donor transplantation for myelodysplastic syndromes: haploidentical relative and matched unrelated donors. Blood Adv. 2021; 5(4): 975-83.(3iiA)
10)Nakaya Y, et al. HLA-Haploidentical Peripheral Blood Stem Cell Transplantation with Post-Transplantation Cyclophosphamide versus HLA-Matched Unrelated Donor Transplantation for Myelodysplastic Syndrome. Transplant Cell Ther. 2024;30(3):316.e1-316.e12.(3iiiA)
11)Shimomura Y, et al. Hematopoietic stem cell transplantation from haploidentical offspring donors using post-transplant cyclophosphamide versus human leukocyte antigen-matched siblings in older patients with myelodysplastic syndrome. Am J Hematol. 2024;99(2):E42-E45.(3iiiA)
12)Ishiyama K, et al. Graft-versus-MDS effect after unrelated cord blood transplantation: a retrospective analysis of 752 patients registered at the Japanese Data Center for Hematopoietic Cell Transplantation. Blood Cancer J. 2019; 9(3): 31.(3iiiA)
13)日本における造血幹細胞移植.2020年度 全国調査報告書 別冊(summary slide). 2021. (Accessed 2nd February, 2022, at https://www.jdchct.or.jp/data/slide/2020/Nationwide_Survey_fy2020_sep_vol_20210331_jpn_pic.pptx)
CQ9 MDSに対して減弱した前処置による同種移植は勧められるか
- 推奨グレード
- カテゴリー2A
高年齢や合併症を持つために強力前処置がリスクと考えられる患者に対しては,減弱した前処置による同種移植を考慮する。
解説
造血器腫瘍に対する同種造血細胞移植は,最大の治療効果を得るために骨髄破壊的前処置(myeloablative conditioning:MAC)を行うことが基本である。しかし,高齢発症が多いMDSでは合併症を持つ患者も多く,強力な前処置による治療関連毒性が問題となるため,減弱した前処置(reduced intensity conditioning:RIC)が考慮される。MDSに対しMACとRICの治療成績を前方視的に比較した臨床試験はこれまでに2つ報告されている。European Blood and Marrow Transplantation Group(EBMT)が行ったMDS 129例における比較試験では,2年時点での再発率(relapse:Rel),NRM,OSがMAC群で14.8%,58.3%,63.2%,RIC群で17.0%,62.4%,76.3%であり,いずれも有意差を認めなかった1)。ただし,本試験では低リスクMDSを4割強含んでおり,Relを過小評価している可能性がある。また,AMLとMDSを対象とした米国の多施設共同試験(BMT CTN 0901)では,RelはMAC群で低いもののNRMは高く,4年OSはMAC群62.0%,RIC群49.0%であり有意にMAC群が上回っていた2)。本試験はMDSの占める割合が約2割であり,対象をMDSに絞ったサブグループ解析では,18カ月でのRelがMAC群で3.7%,RIC群で37.0%と差がみられる一方で,4年OSはMAC群で70.2%,RIC群で58.3%であり有意差は認められなかった3)。また,同コホートに含まれる48例の冷凍保存検体を用いて特定の遺伝子変異を検出して再発のリスクが高い患者群を抽出し,その中でMACとRICの治療成績を比較したところ,MACにより再発リスクを低減できる可能性が示唆された4)。
後方視的解析では,EBMTから多数症例を対象とした結果が報告されている。MAC群621例,RIC群215例の年齢中央値はそれぞれ45歳,56歳とMAC群が有意に若いコホートにおいて,3年時点でのRel,NRM,OSはMAC群で27%,32%,45%,RIC群で45%,22%,41%であり,米国の前方視的試験と同様にMAC群においてRelは低く,NRMは高く,OSでは差がなかった5)。このコホートにおける長期フォローの結果もほぼ同様であり,前処置強度と生存率との間に明らかな相関は認められなかった6)。50~69歳のMDSを対象としたわが国のTRUMPデータの解析も類似した結果であり,MACではNRMが高いもののRelが低く,3年OSはMAC 42.7%,RIC 44.1%と差を認めていない7)。
これらの結果から,MACを選択できる患者であればRICよりもMACを選択すること,高年齢や合併症を持つために強力な前処置がリスクと考えられる患者に対しRICを行うことは妥当な判断と考えられるが,特定の遺伝子変異を持つ症例においてはMACが有益な可能性がある。
参考文献
1) Kröger N, et al. Dose-Reduced Versus Standard Conditioning Followed by Allogeneic Stem-Cell Transplantation for Patients With Myelodysplastic Syndrome: A Prospective Randomized Phase III Study of the EBMT(RICMAC Trial). J Clin Oncol. 2017; 35(19): 2157-64.(1iiA)
2) Scott BL, et al. Myeloablative versus Reduced-Intensity Conditioning for Hematopoietic Cell Transplantation in Acute Myelogenous Leukemia and Myelodysplastic Syndromes-Long-Term Follow-Up of the BMT CTN 0901 Clinical Trial. Transplant Cell Ther. 2021; 27(6): 483.e1-6.(1iiA)
3) Scott BL, et al. Myeloablative Versus Reduced-Intensity Hematopoietic Cell Transplantation for Acute Myeloid Leukemia and Myelodysplastic Syndromes. J Clin Oncol. 2017; 35(11): 1154-61.(1iiA)
4) Dillon LW, et al. Impact of Conditioning Intensity and Genomics on Relapse After Allogeneic Transplantation for Patients With Myelodysplastic Syndrome. JCO Precis Oncol. 2021; 5: PO.20.00355.(3iiiA)
5) Martino R, et al. Retrospective comparison of reduced-intensity conditioning and conventional high-dose conditioning for allogeneic hematopoietic stem cell transplantation using HLA-identical sibling donors in myelodysplastic syndromes. Blood. 2006; 108(3): 836-46.(3iiA)
6) Martino R, et al. Long-term follow-up of a retrospective comparison of reduced-intensity conditioning and conventional high-dose conditioning for allogeneic transplantation from matched related donors in myelodysplastic syndromes. Bone Marrow Transplant. 2017; 52(8): 1107-12.(3iiA)
7) Aoki K, et al. Allogeneic haematopoietic cell transplantation with reduced-intensity conditioning for elderly patients with advanced myelodysplastic syndromes: a nationwide study. Br J Haematol. 2015; 168(3): 463-6.(3iiiA)
CQ10 高リスクMDSに対してアザシチジンは勧められるか
- 推奨グレード
- カテゴリー1
同種造血幹細胞移植が施行されない患者では,アザシチジンが第一選択薬剤である。
- 推奨グレード
- カテゴリー2A
同種造血幹細胞移植への橋渡し治療としてのアザシチジンの有効性は確立していないが,患者状態,移植までの期間などによっては施行を考慮しても良い。
- 推奨グレード
- カテゴリー2B
同種造血幹細胞移植後の維持療法としてのアザシチジンの有効性はこれまで明確に示されてない。
解説
すべてのリスク群を含むMDSに対するアザシチジン(AZA)と最良支持療法のランダム割り付け比較試験ではAZA投与群に血液学的反応,白血病移行期間の有意な延長(中央値21カ月 vs. 12カ月,p=0.007)とOSの延長(中央値20カ月 vs. 14カ月,p=0.10)がみられた1,2)。同種造血幹細胞移植の適応のない高リスクMDSを対象としたAZAと従来治療群(最良支持療法,低用量化学療法,標準量化学療法)とのランダム化比較試験(AZA-001)では,AZA群で有意な生存期間の延長が得られた(中央値24.5カ月 vs. 15カ月,p=0.0001)3)。本剤の有効性は投与4コースまでに現れることが多いが,それ以降に効果がみられる例も25%程度あるため,明らかな疾患増悪や有害事象による中止を除き,4~6コース施行後に有効性を判断する必要がある3)。AZA-001試験の探索的解析では,低用量化学療法との比較4),高齢者(75歳以上)5)においてもAZAの有用性が示され,AZA投与例では血液学的反応がみられた例に加えて安定の例でも有用性が示唆されている6)。別の後方視的研究では7番染色体モノソミーを伴う例へも有効性が観察された7)。こうしたAZAの有用性は前方視的観察試験,後方視的試験でも支持されている8,9)。日本人に対する投与でも同様の効果と安全性が観察されており10),投与経路についても静脈内投与と皮下投与で同等と考えられている10,11)。4週間おきに75mg/m2,7日投与が標準投与法であるが1,2,10),最良の投与法は詳細には検討されていない11,12)。
同種造血幹細胞移植への橋渡しとしてのAZA投与について試みられており,実施可能性は示されているが有効性は明らかではない13)。同種移植後のAZA投与についてAMLとMDS(25%程度)が含まれる181例を対象にランダム化比較試験が実施されたが,RFSはAZA投与の有無にかかわらず差はみられなかった14)。複数の第Ⅱ相試験においても移植後のAZA投与の有効性は明確ではない15-17)。
なお,AZAの高リスクMDSに対する有効性を検証した試験では慢性骨髄単球性白血病(CMML)も対象の一部として含まれていたが,全体の3%(11例)と少数であった3)。新たにCMMLを対象にデシタビン(DEC)とヒロドキシウレア(HU)との第Ⅲ相ランダム化比較試験が実施され,主要評価項目である無イベント生存について両者に差はみられなかった(無イベント生存期間中央値 DEC群12.1カ月,HU群10.3カ月,p=0.27)18)。
参考文献
1) Silverman LR, et al. Randomized controlled trial of azacitidine in patients with the myelodysplastic syndrome: a study of the cancer and leukemia group B. J Clin Oncol. 2002; 20(10): 2429-40.(1iiA)
2) Silverman LR, et al. Further analysis of trials with azacitidine in patients with myelodysplastic syndrome: studies 8421, 8921, and 9221 by the Cancer and Leukemia Group B. J Clin Oncol. 2006; 24(24): 3895-903.(3iiiDiv)
3) Fenaux P, et al. Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk myelodysplastic syndromes: a randomised, open-label, phase III study. Lancet Oncol. 2009; 10(3): 223-32.(1iiA)
4) Fenaux P, et al. Prolonged survival with improved tolerability in higher-risk myelodysplastic syndromes: azacitidine compared with low dose ara-C. Br J Haematol. 2010; 149(2): 244-9.(1iiA/1iiA)
5) Seymour JF, et al. Effects of azacitidine compared with conventional care regimens in elderly(≥ 75 years)patients with higher-risk myelodysplastic syndromes. Crit Rev Oncol Hematol. 2010; 76(3): 218-27.(1iiA/2Div)
6) Gore SD, et al. A multivariate analysis of the relationship between response and survival among patients with higher-risk myelodysplastic syndromes treated within azacitidine or conventional care regimens in the randomized AZA-001 trial. Haematologica. 2013; 98(7): 1067-72.(1iiA/2Div)
7) Díez-Campelo M, et al. Azacitidine improves outcome in higher-risk MDS patients with chromosome 7 abnormalities: a retrospective comparison of GESMD and GFM registries. Br J Haematol. 2018; 181(3): 350-9.(3iiA)
8) Grinblatt DL, et al. Patients with myelodysplastic syndromes treated with azacitidine in clinical practice: the AVIDA registry. Leuk Lymphoma. 2015; 56(4): 887-95.(3iiiDiv)
9) Dinmohamed AG, et al. Effectiveness of azacitidine for the treatment of higher-risk myelodysplastic syndromes in daily practice: results from the Dutch population-based PHAROS MDS registry. Leukemia. 2015; 29(12): 2449-51.(3iA)
10)Uchida T, et al. Phase I and II study of azacitidine in Japanese patients with myelodysplastic syndromes. Cancer Sci. 2011; 102(9): 1680-6.(2Div)
11)Martin MG, et al. A phase II study of 5-day intravenous azacitidine in patients with myelodysplastic syndromes. Am J Hematol. 2009; 84(9): 560-4.(3iiiDiv)
12)Ades L, et al. A phase II study of the efficacy and safety of an intensified schedule of azacytidine in intermediate-2 and high-risk patients with myelodysplastic syndromes: a study by the Groupe Francophone des Myelodysplasies(GFM). Haematologica. 2019; 104(4): e131-3.(3iiiDiv)
13)Voso MT, et al. Feasibility of allogeneic stem-cell transplantation after azacitidine bridge in higher-risk myelodysplastic syndromes and low blast count acute myeloid leukemia: results of the BMT-AZA prospective study. Ann Oncol. 2017; 28(7): 1547-53.(3iiiDiv)
14)Oran B, et al. A phase 3 randomized study of 5-azacitidine maintenance vs observation after transplant in high-risk AML and MDS patients. Blood Adv. 2020; 4(21): 5580-8. 4(1iiDi)
15)de Lima M, et al. Maintenance therapy with low-dose azacitidine after allogeneic hematopoietic stem cell transplantation for recurrent acute myelogenous leukemia or myelodysplastic syndrome: a dose and schedule finding study. Cancer. 2010; 116(23): 5420-31.(3iiiDiv)
16)Nishihori T, et al. Pretransplantation 5-azacitidine in high-risk myelodysplastic syndrome. Biol Blood Marrow Transplant. 2014; 20(6): 776-80.(3iiiDiv)
17)Vij R, et al. A Phase II Multicenter Study of the Addition of Azacitidine to Reduced-Intensity Conditioning Allogeneic Transplant for High-Risk Myelodysplasia(and Older Patients with Acute Myeloid Leukemia): Results of CALGB 100801(Alliance). Biol Blood Marrow Transplant. 2019; 25(10): 1984-92.(3iiiDiii)
18)Itzykson R, et al. Decitabine Versus Hydroxyurea for Advanced Proliferative Chronic Myelomonocytic Leukemia: Results of a Randomized Phase III Trial Within the EMSCO Network. J Clin Oncol. 2023;41(10): 1888-97.(1iiDi)
CQ11 高リスクMDSに対してレナリドミドは勧められるか
- 推奨グレード
- カテゴリー2B
del(5q)を有する高リスクMDSにおいては,アザシチジン不応あるいは不耐容の場合,レナリドミドの使用を考慮しても良い。
- 推奨グレード
- カテゴリー2A
高リスクMDSにおいて,レナリドミドにアザシチジンあるいは化学療法の標準治療としての併用は,推奨されない。
解説
高リスクMDSを対象としたレナリドミド(LEN)の臨床研究は少ない。del(5q)を有する高リスクMDS47例を対象とした第Ⅱ相臨床試験では,13例(27%)に血液学的改善が認められ,7例(15%)はCRであった。そして,5q単独欠損症例では付加染色体異常を持つ症例と比較して有意に多くのCR例が認められた[単独欠損例9例中6例(67%),付加染色体異常例38例中1例(2.6%)]1)。また,del(5q)を有する高リスクMDS/AMLを対象とした,LEN単独増量投与(最大30mg)研究では,MDS症例の36%(11例中4例)に奏効が認められている2)。Johns Hopkins大学における複雑核型の一部にdel(5q)を有する2例を含む27例の高リスクMDS/AMLを対象とした,LEN単独投与(15mgあるいは50mg)の第Ⅱ相臨床試験では,15mg投与では効果がなく,50mg投与された18例のうち11%で奏効が認められたが,全例でGrade 3/4の発熱性好中球減少症もしくは感染症を認め,明らかな臨床的有効性が認められずに本試験は中止されている3)。
このようにdel(5q)を有する高リスクMDSにおいてLENは一定の血液学的効果を示すが,生存期間への影響等は評価されておらず,高リスクMDS治療におけるLENの優位性,有用性は確立していない。したがって現時点では,高リスクMDSに対するLENの使用は推奨されず,薬物療法を行う場合はアザシチジン(AZA)をまず選択すべきと考えられる。なお,現時点ではAZA不応例に対するLENの効果について十分に検討された報告はない。しかし,del(5q)を有する高リスク例への一定の効果を考えると,AZA不応あるいは不耐容の高リスクdel(5q)例では,LENの使用も考慮可能と考えられる。
なお,LENと他剤との併用に関しては,高リスクMDS例を対象に,AZA(75mg/m2/日,5日間)とLEN(10mg/日,21日間,28日サイクル)の併用療法の第Ⅰ/Ⅱ相試験(第I相18例,第Ⅱ相18例)では,奏効率が72%で,16例(44%)がCR,10例(28%)が血液学的改善を示した4)。AZAとLENを併用投与したAML,MDS,CMMLの10研究の406例のメタアナリシスでは,奏効率は49.9%,CR率は33.0%と報告されている5)。しかし,高リスクMDSとCMMLを対象としたAZA単独あるいはAZA+LENあるいはAZA+vorinostatを比較するSWOGの第Ⅱ相ランダム化比較試験では,CMMLでLEN併用群の奏効率の改善(AZA+LEN 68% vs. AZA 28%)がみられたもののMDSでは奏効率に差が認められず,生存期間の改善は認められていない6)。5q欠失を有する82例のMDS/AML(MDS RAEB-2 21例,AML 61例)を対象とした,ダウノルビシン(DNR)3日間+シタラビン(AraC)7日間にLENを併用する第Ⅱ相臨床試験では,全奏効率は58.5%で38例(46%)がCRを達成したと報告された7)。33例の高リスクMDS/再発・難治性AMLを対象とする,AraC/イダルビシン(IDR)に併用するLENの用量を漸増する第Ⅰ相試験では,CR 14例,CRi 4例で,CR/CRi率は56%であった8)。高リスクMDS/AML(MDS 22例,AML 200例)の高齢者を対象とし,DNR 3日間+AraC 7日間にLEN 20mg 21日間投与の併用の有無をランダムに割り付けるランダム化比較第Ⅱ相臨床試験では,両群のCR/CRi率に差は認めず,標準的な寛解導入化学療法にLENを追加しても治療成績は改善しないことが示されている9)。このように,高リスクMDSにおいてLENにAZAや化学療法を併用しても治療成績の改善は認められず,推奨されない。
参考文献
1) Adès L, et al. Efficacy and safety of lenalidomide in intermediate-2 or high-risk myelodysplastic syndromes with 5q deletion: results of a phase 2 study. Blood. 2009; 113(17): 3947-52.(3iiiDiv)
2) Möllgård L, et al. Clinical effect of increasing doses of lenalidomide in high-risk myelodysplastic syndrome and acute myeloid leukemia with chromosome 5 abnormalities. Haematologica. 2011; 96(7): 963-71.(3iiiDiv)
3) Zeidan AM, et al. A phase 2 trial of high dose lenalidomide in patients with relapsed/refractory higher-risk myelodysplastic syndromes and acute myeloid leukaemia with trilineage dysplasia. Br. J. Haematol. 2017; 176(2): 241-7.(2Div)
4) Sekeres MA, et al. Phase 2 study of the lenalidomide and azacitidine combination in patients with higher-risk myelodysplastic syndromes. Blood. 2012; 120(25): 4945-51.(2Div)
5) Kunacheewa C, et al. A systematic review and meta-analysis of the efficacy and adverse events of azacitidine-plus-lenalidomide treatment for patients with acute myeloid leukemia, myelodysplastic syndromes and chronic myelomonocytic leukemia. Hematology. 2019; 24(1): 498-506.(3iiiDiv)
6) Sekeres MA, et al. Randomized Phase II Study of Azacitidine Alone or in Combination With Lenalidomide or With Vorinostat in Higher-Risk Myelodysplastic Syndromes and Chronic Myelomonocytic Leukemia: North American Intergroup Study SWOG S1117. J Clin Oncol 2017; 35(24): 2745-53.(3iiiDiv)
7) Ades L, et al. Lenalidomide combined with intensive chemotherapy in acute myeloid leukemia and higher-risk myelodysplastic syndrome with 5q deletion. Results of a phase II study by the Groupe Francophone Des Myélodysplasies. Haematologica. 2017; 102(4): 728-35.(2Div)
8) Saygin C, et al. A phase I study of lenalidomide plus chemotherapy with idarubicin and cytarabine in patients with relapsed or refractory acute myeloid leukemia and high-risk myelodysplastic syndrome. Am. J. Hematol. 2020; 95(12): 1457-65.(2Div)
9) Ossenkoppele GJ, et al. Lenalidomide added to standard intensive treatment for older patients with AML and high-risk MDS. Leukemia. 2020; 34(7): 1751-9.(2Div)
CQ12 高リスクMDSに対して化学療法は勧められるか
- 推奨グレード
- カテゴリー2A
生存期間,白血病化までの期間を延長する化学療法の報告はなく,第一選択としては推奨されない(アザシチジンが推奨される)。
- 推奨グレード
- カテゴリー2B
同種造血細胞移植が実施されない若年者で染色体異常,全身状態(PS),罹病期間などの予後不良因子のない症例では強力化学療法も候補となるが,化学療法はアザシチジンが使用できない場合に適応が考慮される。
- 推奨グレード
- カテゴリー2B
強力化学療法と低用量化学療法の生存期間への影響はほぼ同等であり,その適応は症例ごとに判断する。
- 推奨グレード
- カテゴリー2A
同種造血細胞移植への橋渡し治療として強力化学療法とアザシチジンの生存期間への影響はほぼ同等であり,その適応は症例ごとに判断する。
解説
従来,高リスクMDSに対しては化学療法が行われてきた。しかし,一部の若年者で,染色体異常・全身状態(PS)・罹病期間など予後不良因子のない症例では強力化学療法の有用性が示されているものの1),それ以外の症例では生存期間や白血病化までの期間延長を明確に示したレジメンは存在しない。このため,化学療法の適応はアザシチジン(AZA)が使用できない症例(不応・不耐容)に考慮される。移植適応を問わず登録されたMDS(RAEB-tおよび白血化症例を含む)における強力化学療法と低用量化学療法を比較したわが国の臨床試験(JALSG MDS200試験)では,登録症例数が不十分で統計学的な比較がなされていないものの,寛解率では強力化学療法群が高かったにもかかわらず(強力化学療法64.7% vs 低用量化学療法43.9%),2年DFSおよび2年OSはほぼ同等であり(DFS:強力化学療法26.0% vs. 低用量化学療法24.8%,OS:強力化学療法28.1% vs. 低用量化学療法32.1%),MDSでは寛解導入率が必ずしも予後を反映せず,強力化学療法と低用量化学療法はほぼ同等の成績であった2)。
臨床試験でAZAが投与された症例のうちAZAに不応となった高リスクMDS 435例(移植適応の有無を問わない)の後方視的解析で,AZA不応後に何らかの治療が行われた270例の生存率について,強力化学療法群は,支持療法群と比較して生存率は良好だったが,同種移植群や治験治療群と比較して不良で,低用量化学療法群との差はみられなかったことが報告されている3)。
高リスクMDSの同種移植までの橋渡し治療について,AZAと化学療法を比較する後方視的研究がこれまでにいくつか報告されているが,いずれにおいても同等の成績と報告されている4-6)。同種移植を受けたMDSを対象としたフランスのグループの後方視的解析では,同種移植前にAZAを受けたのは48例,強力化学療法98例,強力化学療法とAZAの両方は17例で,それぞれの3年OSは55%,48%,32%(p=0.07),3年EFSは42%,44%,29%(p=0.14),再発割合は40%,37%,36%(p=0.86),NRM 19%,20%,35%(p=0.24)であり,ほぼ同等の成績であった4)。Duesseldorf大学で同種移植を受けた165例のMDS(RAEB1,RAEB2),CMML,MDS/MPN,AML-MRCの後方視的解析では,同種移植前に化学療法を受けたのは64例,メチル化阻害薬34例,未治療は67例で,5年OS,RFS,再発率,NRMはいずれも3群間で差はみられなかったと報告されている5)。同種移植の前に通常化学療法が施行された132例およびメチル化阻害薬が投与された77例を対象とした,EBMTによる高リスクMDS(RAEB,RAEB-t)の後方視的解析では,通常化学療法群では若年(<55歳)が多く,移植前にCRが得られた例が多く,primary refractory例が少なかったにもかかわらず,移植後3年における各種予後(OS,RFS,再発/NRM)に,通常化学療法群とメチル化阻害薬群との間に有意差はみられなかったと報告されている6)。
参考文献
1) Kantarjian H, et al. Long-term follow-up results of the combination of topotecan and cytarabine and other intensive chemotherapy regimens in myelodysplastic syndrome. Cancer. 2006; 106(5): 1099-109.(3iiiDiv)
2) Morita Y, et al. Comparative analysis of remission induction therapy for high-risk MDS and AML progressed from MDS in the MDS200 study of Japan Adult Leukemia Study Group. Int J Hematol. 2010; 91(1): 97-103.(1iiDi)
3) Prébet T, et al. Outcome of high-risk myelodysplastic syndrome after azacitidine treatment failure. J Clin Oncol. 2011; 29(24): 3322-7.(3iiiA)
4) Damaj G, et al. Impact of azacitidine before allogeneic stem-cell transplantation for myelodysplastic syndromes: a study by the Société Française de Greffe de Moelle et de Thérapie-Cellulaire and the Groupe-Francophone des Myélodysplasies. J Clin Oncol. 2012; 30(36): 4533-40.(3iiiA)
5) Schroeder T, et al. Comparison between Upfront Transplantation and different Pretransplant Cytoreductive Treatment Approaches in Patients with High-Risk Myelodysplastic Syndrome and Secondary Acute Myelogenous Leukemia. Biol Blood Marrow Transplant. 2019; 25(8): 1550-9.(3iiiA)
6) Potter VT, et al. Comparison of Intensive Chemotherapy and Hypomethylating Agents before Allogeneic Stem Cell Transplantation for Advanced Myelodysplastic Syndromes: A Study of the Myelodysplastic Syndrome Subcommittee of the Chronic Malignancies Working Party of the European Society for Blood and Marrow Transplant Research. Biol Blood Marrow Transplant. 2016; 22(9): 1615-20.(3iiiA)

