第Ⅰ章 白血病
Ⅰ 白血病
4 慢性骨髄性白血病 / 骨髄増殖性腫瘍
(chronic myeloid leukemia/myeloproliferative neoplasms:CML/MPN)
総論
骨髄増殖性腫瘍(myeloproliferative neoplasms:MPN)は,造血幹細胞レベルでの腫瘍化によって発症する疾患であり,骨髄系細胞(顆粒球,赤芽球,骨髄巨核球)の著しい増殖を特徴とする1)。MPNには,慢性骨髄性白血病(chronic myeloid leukemia:CML),慢性好中球性白血病(chronic neutrophilic leukemia:CNL),真性赤血球増加症または真性多血症(polycythemia vera:PV),原発性骨髄線維症(primary myelofibrosis:PMF),本態性血小板血症(essential thrombocythemia:ET),慢性好酸球性白血病(chronic eosinophilic leukemia:CEL),分類不能骨髄増殖性腫瘍(MPN,unclassifiable)が含まれる。発症初期のMPNは,分化能を有する骨髄細胞の過形成と,末梢血における顆粒球,赤血球,血小板の増加を示す。理学的には脾腫や肝腫大を認める。MPNは,発症初期には自覚症状に乏しいが,全身症状を伴い段階的に増悪し,最終的には骨髄の線維化,あるいは,形質転換して成熟能喪失(急性転化)へ至る疾患である。MPNの治療については,CMLとそれ以外のMPNでは方針が異なる。本ガイドラインではCML,PV,ET,PMFの治療を提示する。
1.慢性骨髄性白血病(CML)
1)CMLの病期分類
CMLは,多能性造血幹細胞の異常により惹起される白血病で,t(9;22)(q34;q11)により形成されるPhiladelphia(Ph)染色体を特徴とする。Ph染色体上のBCR::ABL1融合遺伝子にコードされて産生されるBCR::ABL1チロシンキナーゼ(tyrosine kinase:TK)が恒常的に活性化し,白血病細胞の増殖に関与し,3つの病期を経て進行する2)。CMLは白血球や血小板の増加を認めるが,自覚症状の乏しい慢性期(chronic phase:CP,診断後約3~5年間)で多くの患者(85%)が診断され,顆粒球の分化異常が進行する移行期(accelerated phase:AP,3~9カ月間持続)を経て,未分化な芽球が増加して急性白血病に類似する急性転化期(blast phase:BP,約3~6カ月間持続)へ進展し致死的となる。European LeukemiaNet(ELN)3)の規準に従いAP,BP期が定義される(表1)。
表1 CMLの病期分類(ELN分類)
| 移行期(accelerated phase) |
|---|
|
以下のいずれか1つに該当するもの ・末梢血あるいは骨髄における芽球割合15~29%,または芽球と前骨髄球が30%以上 ・末梢血における好塩基球割合≧20% ・治療に無関係の血小板減少(<10万/μL) ・染色体異常 治療中の付加的な染色体異常の出現(major route:second Ph,trisomy 8,isochromosome 17q,trisomy 19) |
| 急性転化期(blast phase) |
|
下記のいずれか1つに該当するもの ・末梢血あるいは骨髄における芽球割合≧30% ・髄外浸潤 髄外病変の出現(脾臓を除く) |
(文献3)より引用)
2)CMLの予後分類
表2に診断時に評価すべき予後スコアの計算式とリスクグループによる予後を示す。初診時の年齢,脾腫(肋骨弓下cm),血小板数,末梢血芽球(%)の4因子を用いて計算されるSokalスコア4)が用いられていた。最近はEUTOS long-term survival(ELTS)スコア5)が多数例の検討で白血病関連死亡や長期のOSに相関することが知られている6)。(http://www.leukemia-net.org/content/leukemias/cml/elts_score/index_eng.html)
表2 診断時の予後スコア
| Score計算式 | リスクグループ | |||||||
|---|---|---|---|---|---|---|---|---|
| Sokal 4) |
Exp 0.0116 ×(age−43.4) +0.0345 ×(spleen−7.51) +0.188×[(platelet count/700)2−0.563] +0.0887×(blood blasts−2.10) |
Low risk:<0.8 Intermediate-risk:0.80~1.2 High-risk:>1.2 |
||||||
| ELTS 5) |
0.0025×(age/10)3 +0.0615×spleen size +0.1052×peripheral blood blasts +0.4104×(platelet count/1000)−0.5 |
Low risk:<1.5680 Intermediate risk:1.5680~2.2185 High-risk:>2.2185 |
||||||
| 予後6) | Low risk | Intermediate risk | High risk | |||||
| n=5,154 | Sokal | ELTS | Sokal | ELTS | Sokal | ELTS | ||
| % | 38 | 55 | 38 | 28 | 23 | 13 | ||
| 10年全生存率 | 89% | 88% | 81% | 79% | 75% | 68% | ||
| 6年白血病関連死 | 3% | 2% | 4% | 5% | 8% | 12% | ||
(文献4-6)より作成)
3)CMLの治療効果判定
CML治療のコンセプトはPh陽性(BCR::ABL1陽性)白血病細胞のコントロールと病期進行の回避にあり,治療効果はELN(2020)の判定規準に従う7)。
CP期の治療効果は,血液学的奏効(hematologic response:HR),細胞遺伝学的奏効(cytogenetic response:CyR),分子遺伝学的奏効(molecular response:MR)の3つのレベルで判定する(表3)。HRは末梢血所見の改善,CyRは骨髄細胞中のPh染色体割合で,MRはポリメラーゼ連鎖反応(polymerase chain reaction:PCR)により血液細胞中のBCR::ABL1遺伝子発現量を国際標準法(International Scale:IS)に基づいた評価法で判定する。
表3 CMLに対する治療効果の判定規準
| 血液学的奏効(Hematologic Response:HR) | 血液・骨髄検査所見および臨床所見 |
|---|---|
| 完全(complete)HR:CHR |
1.WBC<10,000/μL 2.PLT<450,000/μL 3.末梢血液中の幼若な細胞(芽球,前骨髄球,骨髄球)を認めない 4.脾臓の腫大なし |
| 細胞遺伝学的奏効(Cytogenetic Response:CyR) | 骨髄有核細胞中のPh染色体(BCR::ABL1)陽性率 |
| 細胞遺伝学的完全(complete)奏効:CCyR | 0% |
| 細胞遺伝学的大(major)奏効:MCyR | 0~35% |
| 細胞遺伝学的部分(partial)奏効:PCyR | 1~35% |
| 細胞遺伝学的小(minor)奏効:Minor CyR | 36~65% |
| 分子遺伝学的奏効(Molecular Response:MR) | BCR::ABL1IS*遺伝子レベル(RT-PCR法) |
| 分子遺伝学的早期(early)奏効:EMR |
BCR::ABL1IS≦10% 治療3カ月時点 BCR::ABL1IS≦1% 治療6カ月時点 |
| 分子遺伝学的大(major)奏効:MMR | BCR::ABL1IS≦0.1% |
|
分子遺伝学的に深い(deep)奏効:DMR MR4.0 MR4.5 MR5.0 |
BCR::ABL1IS≦0.01% BCR::ABL1IS≦0.0032% BCR::ABL1IS≦0.001% |
*BCR::ABL1IS:国際指標で補正された値
(文献7)より作成)
4)CML治療効果のモニタリング
ELN(2020)に従い,TKI療法によるCML治療効果のモニタリングを行う。治療効果の判定方法は,CyRは,骨髄細胞の染色体検査を実施し判定するが,末梢血好中球の蛍光in situハイブリダイゼーション(fluorescence in situ hybridization:FISH)でも代用できる。MRは,末梢血を用いて定量(quantitative)逆転写ポリメラーゼ連鎖反応(RT-PCR)で測定したBCR::ABL1遺伝子レベルで評価する。BCR::ABL1遺伝子の定量的評価はABL1あるいは対象となる遺伝子レベルに対する比を,国際指標で補正してBCR::ABL1ISと表した値で判定する。初回治療では,治療後3カ月までにBCR::ABL1IS≦10%または部分CyR(partial CyR:PCyR),6カ月までにBCR::ABL1IS≦1%または完全CyR(complete CyR:CCyR),12カ月までにBCR::ABL1IS≦0.1%すなわちmajor MR(MMR),それ以後はBCR::ABL1IS≦0.1%を維持するOptimal(至適奏効)な効果を得ることを目指す(表4)。そして,Warning(要注意)ではモニタリングを頻回に行い,Failure(不成功)では,治療の変更を考慮する。初回TKIに抵抗性あるいは不耐容を示し別のTKIへ切り替えた場合も,治療効果は同じ規準で評価する(表4)。CML-CP治療においては,少なくともMMRの治療効果を得ることが大切であり,定量RT-PCRの検索はELN7)やNCCN8)など海外のCML治療ガイドラインでも必須検査である。分子遺伝学的に深い奏効(deep molecular response:DMR)としてBCR::ABL1IS 0.01%以下をMR4.0,BCR::ABL1IS 0.0032%以下をMR4.5,BCR::ABL1IS 0.001%以下をMR5.0と定義されるが,本ガイドラインではDMRを保険診療で測定可能であるMR4.5とする。
表4 CMLに対するTKI治療の効果
| 評価時点 | 効果 | ||
|---|---|---|---|
| 至適奏効 Optimal | 要注意 Warning | 不成功 Failure | |
| 治療前 | 指摘なし | 高リスク ELTS スコア,高リスク CCA/Ph+ | 指摘なし |
| 3カ月 | BCR::ABL1IS≦10% | BCR::ABL1IS>10% | BCR::ABL1IS>10% if confirmed within 1-3 months |
| 6カ月 | BCR::ABL1IS≦1% | BCR::ABL1IS>1~10% | BCR::ABL1IS>10% |
| 12カ月 | BCR::ABL1IS≦0.1% | BCR::ABL1IS>0.1~1% | BCR::ABL1IS>1% |
|
その後 どの時点でも |
BCR::ABL1IS≦0.1%* |
BCR::ABL1IS>0.1~1%, Loss of ≦0.1%(MMR) |
BCR::ABL1IS>1%, 治療抵抗性ABL1変異, 高リスク CCA/Ph+ |
ELTS : EUTOS long-term survival
CCA/Ph+:Ph染色体の付加的染色体異常
*TFR(treatment free remission)を目指している場合,より深い奏効(DMR)を目標とする。本ガイドラインではBCR::ABL1IS≦0.0032%(MR4.5)を至適奏効のDMRとする。
(文献7)より引用)
具体的なTKIの治療効果判定のタイミングは以下の通りである。
①治療開始前は,血算と血液像,骨髄の染色体検査(G-band法)を施行し,Ph陽性率と付加的染色体異常の有無を確認する。また,BCR::ABL1 mRNAを定量し治療前の定量値の確認を行う。骨髄染色体検査でPh陽性またはFISH法でBCR::ABL1融合遺伝子陽性であるにもかかわらず,BCR::ABL1ISの定量RT-PCR検査でBCR::ABL1が検出できない場合はBCRの切断点が通常と異なっていることが考えられるため,ダイレクトシーケンス法などで確認する必要がある。
②治療開始直後は,血算と血液像を毎週~2週ごとに検査する。
③BCR::ABL1ISの定量RT-PCR検査は末梢血で行い,初診時に加え,MMRが得られるまでは3カ月ごとに行う。MMR到達後は3~6カ月ごとに行う。
④BCR::ABL1ISの著しい増加やELN(2020)規準でFailureの場合は,骨髄検査で病期の再確認と骨髄染色体検査で付加的染色体異常の有無を検討する。また,BCR::ABL1点突然変異解析(保険適用外)は治療方針を決める参考になる。
5)CMLの治療目標
これまでのCMLの治療目標は,急性転化への移行を阻止することであった。一方,TKIにより多くの症例で長期間持続するDMRを得ることができるようになった結果,現在の治療目標は,長期間の無治療寛解(treatment free remission:TFR)を得ることに変わりつつある。イマチニブ(IMA)中止試験では,長期間IMA治療後,少なくとも2年のDMRを得た症例の一部に長期TFRが確認されている9)。一方,IMA中止後にDMRを喪失した場合は,IMAの再開によりすべての症例がDMRに再到達している。TKIによりDMRに達した症例に対する治療中止の可能性に関しては,引き続き臨床試験による検証の積み重ねが必要であるものの,本ガイドラインにおいては,日常診療におけるTKI中止は,専門医による注意深い監督のもとに行うことができるとした。その参考として,ELN(2020)7)およびNCCNガイドライン8)と同様に臨床試験以外でTKIを中止する場合の必要条件と中止後の定期的モニタリングの重要性について言及した。
2.Ph陰性の骨髄増殖性腫瘍(MPN)
PV,ET,PMFでは,JAK-STATシグナル伝達系を恒常的に活性化する遺伝子変異が共通してみられる。JAK2変異がPVの95%以上,ET,PMFの約半数に,トロンボポエチンレセプターであるMPL変異がET,PMFの3~8%に,calreticulin(CALR)変異がET,PMFの20~30%に生じており,血球の無秩序な増殖の原因となっている10)。
PV,ET,PMFの3疾患においては,発熱,体重減少,倦怠感,掻痒,骨痛などの全身症状が共通してみられるのに加え,血栓症を合併しやすい。100人・年あたり,血栓症がPVでは5.3回,ETでは4~8回,PMFでは2.23回生じると報告されており,特にPV,ETでは血栓症は主要死因となっている。また,一部の症例はAMLに移行する。一般人口と比較したPV,ETの8年生存割合は0.84(0.77~0.90),0.91(0.84~0.97)11)と比較的良好であるのに対し,PMFの50%生存期間は3.8年と不良である12)。そのため,PVとETでは血栓症の予防を目的とした治療が,PMFでは予後を考慮した治療法の選択が求められる。
3.真性赤血球増加症または真性多血症(PV)
1)PVの予後分類13)
PVの生命予後は比較的良好であり,治療により10年以上の50%生存期間が期待できる。そのため,合併する血栓症の予防が治療の主眼となる。年齢60歳以上または血栓症の既往がある患者は,血栓症の高リスク患者である(表5)13,14)。
表5 PVにおける血栓症のリスク分類
| 報告者 | 予後因子 | リスク分類 |
|---|---|---|
| Barbui T, et al. 14) | 年齢<60歳,かつ血栓症の既往なし | 低リスク |
| 年齢≧60歳,または血栓症の既往がある | 高リスク | |
|
Tefferi A, et al. 13) |
年齢<60歳 血栓症の既往なし 血小板数<150万/μL 心血管病変のリスク因子(喫煙,高血圧,うっ血性心不全)がない 以上のすべての項目を満たす |
低リスク |
| 低リスク群にも高リスク群にも属さない | 中間リスク | |
| 年齢≧60歳,または血栓症の既往がある | 高リスク |
2)PVの治療概略
①高血圧,脂質異常症,肥満,糖尿病などの,いわゆる血栓症の一般的なリスク因子がある場合は,これらの治療を行う。
②血栓症の低リスク群(年齢<60歳,かつ血栓症の既往がない)に対しては,瀉血+低用量アスピリンの投与を行う。
③高リスク群に対しては,瀉血療法,アスピリン療法に加え細胞減少療法を行う。
4.本態性血小板血症(ET)
1)ETの予後分類
ETの生命予後は良好であり,健常者とほぼ同等の生命予後が期待される。そのため,合併する血栓症の予防が治療の主眼となる。年齢60歳以上または血栓症の既往がある患者は,血栓症の高リスク患者である15)。なお,最近JAK2変異を組み入れたリスク分類も提唱された(表6)14-16)。白血球数,血小板数および高血圧,脂質異常症,糖尿病,喫煙などの心血管病変のリスク因子の有無を血栓症のリスク因子として扱うかは報告により異なっており,結論は得られていない。
表6 ETにおける血栓症のリスク分類
| 報告者 | 予後因子 | リスク分類 | |
|---|---|---|---|
| Barbui T, et al. 14) | 年齢<60歳,かつ血栓症の既往なし | 低リスク | |
| 年齢≧60歳,または血栓症の既往あり | 高リスク | ||
| Ruggeri M, et al.15) |
年齢<60歳,かつ血栓症の既往なし, かつ血小板数<150万/μL |
低リスク | |
| 年齢≧60歳,または血栓症の既往あり,または血小板数≧150万/μL | 高リスク | ||
|
Barbui T, et al.16) |
年齢<60歳,かつ血栓症の既往なし | JAK2変異なし | 超低リスク |
| JAK2変異あり | 低リスク | ||
|
年齢≧60歳,かつ血栓症の既往なし, かつJAK2変異なし |
中間リスク | ||
| 年齢≧60歳,かつJAK2変異あり | 高リスク | ||
| 血栓症の既往あり | |||
生命予後は基本的には良好であるが,年齢,初診時白血球数,血栓症の既往などにより3つのリスクに分類することが提唱されている(表7)17,18)。
表7 ETにおける生命予後のリスク分類
| 報告者 | 予後因子 | リスク分類 | 50%生存期間(年) |
|---|---|---|---|
| Wolanskyj, et al.17) |
年齢<60歳, かつ白血球数<15,000/μL |
低リスク | 25.3 |
|
年齢≧60歳, または白血球数≧15,000/μL |
中間リスク | 16.9 | |
|
年齢≧60歳, かつ白血球数≧15,000/μL |
高リスク | 10.3 | |
|
Passamonti, et al.18) |
年齢≧60歳(2) WBC≧11,000/μL(1) 血栓症の既往(1) |
低リスク(0) 中間リスク(1,2) 高リスク(3,4) |
到達せず 24.5 13.8 |
2)ETの治療概略
①血栓症低リスク群に対しては,定期的な経過観察を行う。
②血栓症高リスク群に対しては,合併する血栓症の予防を目的として低用量アスピリン投与と細胞減少療法の併用療法を行う19)。
5.原発性骨髄線維症(PMF),真性多血症または本態性血小板血症に続発する二次性骨髄線維症(post polycythemia vera/essential thrombocythemiamyelofibrosis:post PV/ET-MF)
1)骨髄線維症(myelofibrosis:MF)の予後分類
PMFでは臨床情報に基づく3種類の国際的予後分類(International Prognostic Scoring System:IPSS)と,染色体異常と遺伝子変異情報,あるいは臨床情報を統合した予後分類が報告されている。このなかで,年齢>65歳,体重減少・夜間盗汗・発熱などの臨床症状,Hb<10g/dL,診断時WBC>25,000/μL,末梢血液中の芽球割合≧1%の5つを予後因子とするIPSS20),前述の5因子に異なった重み付けをしたDynamic IPSS(DIPSS)21),DIPSSに染色体異常,血小板数,輸血依存性を付加したDIPSS plus22)は,スコアの合計により,低リスク,中間-Ⅰリスク,中間-Ⅱリスク,高リスクの4つのリスクグループに分類するものであり,本邦のPMF患者の予後予測に有用である(表8)20-23)。Post PV/ET-MFの予後予測には,年齢,Hb<11g/dL,末梢血芽球≧3%,血小板<15万/μL,持続する全身症状,CALR変異がないこと,の6つの独立した予後不良因子のスコアで4群に層別化するMyelofibrosis Secondary to PV and ET Prognostic Model(MYSEC-PM)の有用性が報告されている23)。
表8 PMF,post PV/ET-MFの予後予測モデル
| 予後予測モデル | 予後不良因子(スコア) | 予後評価 | ||
|---|---|---|---|---|
| スコアの合計 | リスク分類 | 50%生存期間(年) | ||
| IPSS20) |
年齢>65歳(1) 発熱・夜間盗汗・体重減少の持続(1) Hb<10g/dL(1) WBC>25,000/μL(1) 末梢血芽球≧1%(1) |
0 1 2 ≧3 |
低リスク 中間-Ⅰリスク 中間-Ⅱリスク 高リスク |
11.3 7.9 4.0 2.3 |
| DIPSS/aaDIPSS21) |
DIPSS: 年齢>65歳(1) 発熱・夜間盗汗・体重減少の持続(1) Hb<10g/dL(2) WBC>25,000/μL(1) 末梢血芽球≧1%(1) |
0 1~2 3~4 5~6 |
低リスク 中間-Ⅰリスク 中間-Ⅱリスク 高リスク |
到達せず 14.2 4.0 1.5 |
|
Age-adjusted DIPSS(65歳未満): 発熱・夜間盗汗・体重減少の維持(2) Hb<10g/dL(2) WBC>25,000/μL(1) 末梢血芽球≧1%(2) |
0 1~2 3~4 ≧5 |
低リスク 中間-Ⅰリスク 中間-Ⅱリスク 高リスク |
到達せず 9.8 4.8 2.3 |
|
| DIPSS plus22) |
予後不良核型[複雑核型(3種類以上の異常),+8,-7/7q-,i(17q),-5/5q-,12p-, Inv(3),11q23異常](1) 血小板<100,000/μL(1) 輸血の必要性(1) DIPSS Intermediate-Ⅰリスク(1) DIPSS Intermediate-Ⅱリスク(2) DIPSS Highリスク(3) |
0 1 2~3 4~6 |
低リスク 中間-Ⅰリスク 中間-Ⅱリスク 高リスク |
15.4 6.5 2.9 1.3 |
| MYSEC-PM23) |
年齢(0.15/year) 発熱・夜間盗汗・体重減少の持続(1) Hb<11g/dL(2) 血小板<150,000/μL(1) 末梢血芽球≧3%(2) CALR変異がない(2) |
<11 11≦<14 14≦<16 ≧16 |
低リスク 中間-Ⅰリスク 中間-Ⅱリスク 高リスク |
到達せず |
2)PMF,post PV/ET-MFの治療概略
①低リスクおよび中間-Ⅰリスクの治療:臨床症状,貧血症状を欠く患者の生存期間は10年を超えるため,経過観察を行う。脾腫や全身症状を有する場合には,ルキソリチニブ(RUX)投与を行う。
②中間-Ⅱリスクおよび高リスクの治療:現時点での治癒的治療法は同種造血幹細胞移植(allo-HSCT)であり,合併症がなく適切なドナーが得られる場合はallo-HSCTが推奨される。allo-HSCTの適応とならない場合は,RUX投与を行う。
③貧血に対しては,赤血球輸血や蛋白同化ホルモンが用いられる。
参考文献
1) Arber DA, et al. Introduction and overview of the classification of myeloid neoplasms. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, Lyon, IARC; 2017: pp16-27.(テキストブック)
2) Vardiman JW, et al. Chronic myeloid leukaema, BCR-ABL1-positive. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, Lyon, IARC; 2017: pp30-6.(テキストブック)
3) Baccarani M, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood. 2013; 122(6): 872-84. (レビュー)
4) Sokal JE, et al. Prognostic discrimination in “good-risk” chronic granulocytic leukemia. Blood. 1984; 6(3 4): 789-99.(3iA)
5) Pfirrmann M, et al. Prognosis of long-term survival considering disease-specific death in patients with chronic myeloid leukemia. Leukemia. 2016; 30(1): 48-56.(3iA)
6) Geelen IGP, et al. Validation of the EUTOS long-term survival score in a recent independent cohort of “real world”CML patients. Leukemia. 2018; 32(10): 2299-303.(3iA)
7) Hochhaus A, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020; 34(4): 966-84.(レビュー)
8) Deininger MW, et al. Chronic Myeloid Leukemia, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2020; 18(10): 1385-415.(レビュー)
9) Etienne G, et al. Long-Term Follow-Up of the French Stop Imatinib(STIM1)Study in Patients With Chronic Myeloid Leukemia. J Clin Oncol. 2017; 35(3): 298-305. (3iiiDiv)
10)Vainchenker W, et al. Genetic basis and molecular pathophysiology of classical myeloproliferative neoplasms. Blood. 2017; 129(6): 667-79.(レビュー)
11)Hultcrantz M, et al. Patterns of survival among patients with myeloproliferative neoplasms diagnosed in Sweden from 1973 to 2008: a population-based study. J Clin Oncol. 2012; 30(24): 2995-3001.(3iA)
12)Takenaka K, et al. Clinical features and outcomes of patients with primary myelofibrosis in Japan: report of a 17-year nationwide survey by the Idiopathic Disorders of Hematopoietic Organs Research Committee of Japan. Int J Hematol. 2017; 105(1): 59-69.(3iA)
13)Tefferi A, et al. Polycythemia vera: scientific advances and current practice. Semin Hematol. 2005; 42(4): 206-20.(レビュー)
14)Barbui T, et al. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European LeukemiaNet. J Clin Oncol. 2011; 29(6): 761-70.(レビュー)
15)Ruggeri M, et al. No treatment for low-risk thrombocythaemia: results from a prospective study. Br J Haematol. 1998; 103(3): 772-7.(2C)
16)Barbui T, et al. Practice-relevant revision of IPSET-thrombosis based on 1019 patients with WHO-defined essential thrombocythemia. Blood Cancer J. 2015; 5(11): e369.(3iiDi)
17)Wolanskyj AP, et al. Essential thrombocythemia beyond the first decade: life expectancy, long-term complication rates, and prognostic factors. Mayo Clin Proc. 2006; 81(2): 159-66.(3iiA)
18)Passamonti F, et al. A prognostic model to predict survival in 867 World Health Organization-defined essential thrombocythemia at diagnosis: a study by the International Working Group on Myelofibrosis Research and Treatment. Blood. 2012; 120(6): 1197-201.(3iiA)
19)Palandri F, et al. Long-term follow-up of 386 consecutive patients with essential thrombocythemia: safety of cytoreductive therapy. Am J Hematol. 2009; 84(4): 215-20.(3iiA)
20)Cervantes F, et al. New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibrosis Research and Treatment. Blood. 2009; 113(13): 2895-901.(3iiA)
21)Passamonti F, et al. A dynamic prognostic model to predict survival in primary myelofibrosis: a study by the IWG-MRT(International Working Group for Myeloproliferative Neoplasms Research and Treatment). Blood. 2010; 115(9): 1703-8.(3iiA)
22)Gangat N, et al. DIPSS plus: a refined Dynamic International Prognostic Scoring System for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count, and transfusion status. J Clin Oncol. 2011; 29(4): 392-7.(3iiA)
23)Passamonti F, et al. A clinical-molecular prognostic model to predict survival in patients with post polycythemia vera and post essential thrombocythemia myelofibrosis. Leukemia. 2017; 31(12): 2726-31.(3iiA)
アルゴリズム
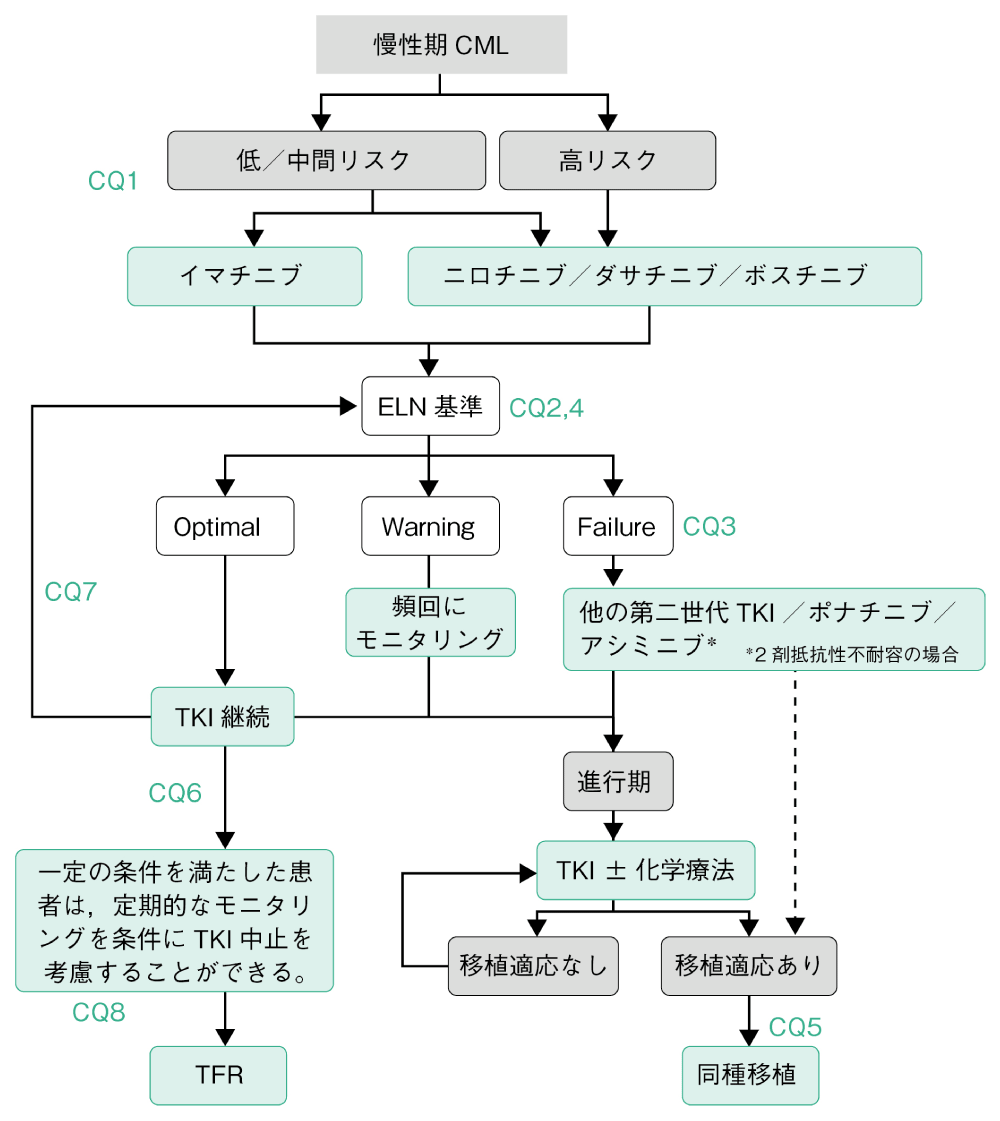
1.CMLのアルゴリズム
現在のCML治療のキードラッグはTKIである。CML-CP期にはリスクと患者背景を考慮しTKI[イマチニブ(IMA),ニロチニブ(NIL),ダサチニブ(DAS),ボスチニブ(BOS)]のいずれかを投与する(CQ1)。治療開始後,至適奏効(Optimal)の場合は治療を継続,Warning(要注意)の場合はモニタリング(CQ2)を頻回にして,Failure(不成功)の場合は,他の第二世代TKIまたはポナチニブ(PON),2剤抵抗性不耐容の場合はアシミニブ(ASC)への治療薬の変更を行う(CQ3)。また,長期TKI投与による心血管系の副作用を避けるため,高リスク群の同定と定期的な検査を行う(CQ4)。CML-CPから進展した進行期にはTKI単独もしくは急性白血病に準じた化学療法を併用する。移植適応であれば,同種移植を推奨する(CQ5)。TFRはCML治療の新しい目標であり一定の条件を満たした患者は,定期的なモニタリングを条件にTKI中止を考慮することができる(CQ6)。TKIの減量は有害事象,年齢などの患者背景を理由に行うことができる。DMRを維持している症例ではTKIに関連した有害事象を避けるためTKIの減量を行っても良い。(CQ7)
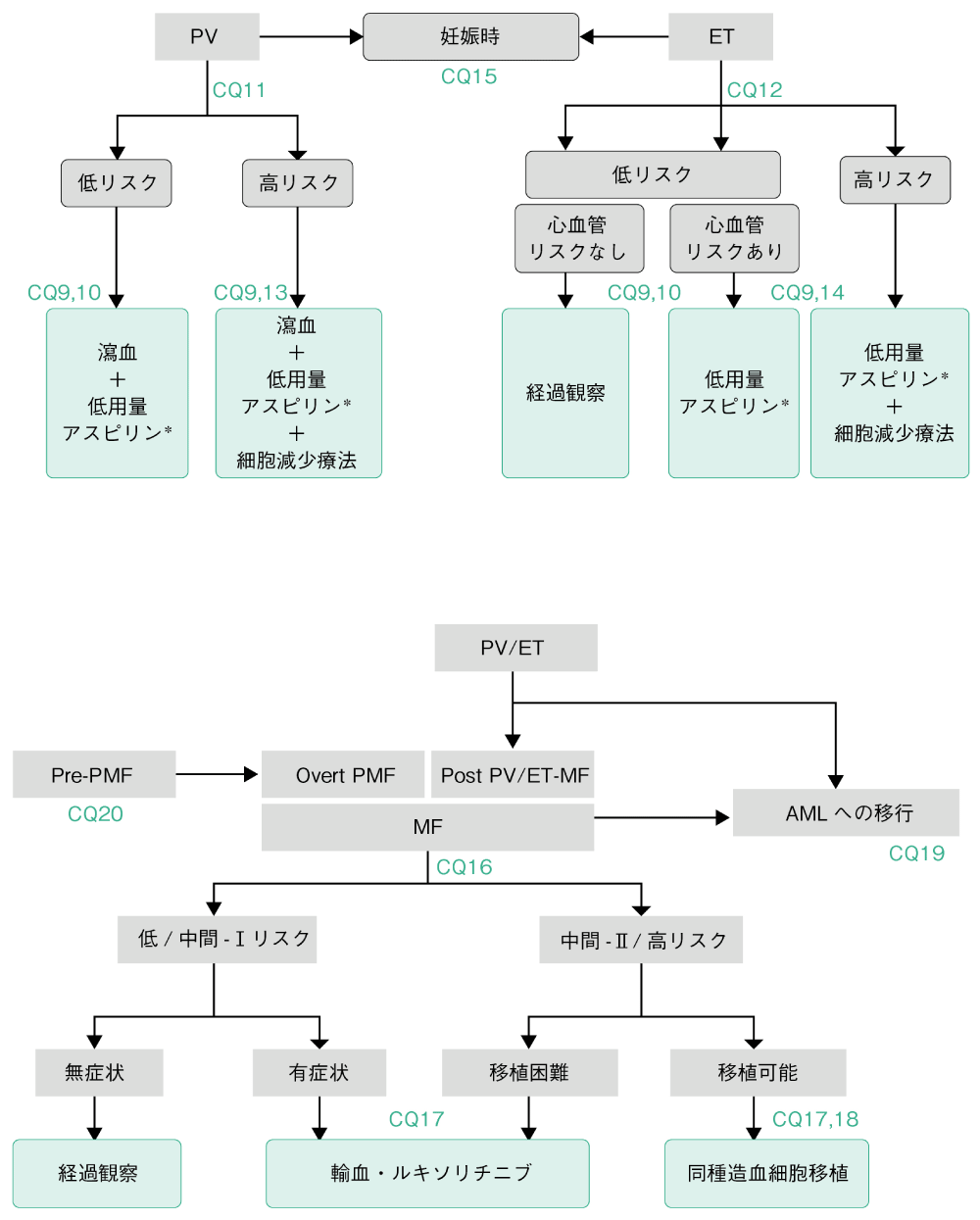
2.MPNのアルゴリズム
PV,ET,PMFの治療に際しては,リスク評価に基づき治療方針を立てることが基本となる。
PVとETの治療目標は,血栓症や出血を予防することである。すべてのリスクカテゴリーに属するPV患者に対して低用量アスピリン投与と瀉血が有効である(CQ9)。低リスクPVに対する細胞減少療法は推奨されないが,血球増加や脾腫などが著明な場合,瀉血継続が困難な場合は考慮しても良い(CQ10)。高リスクPVには,これに加えてヒドロキシウレア(HU),あるいはロペグインターフェロン-α2bを用いてHt<45%を目指す(CQ11, 13)。HU不応例,不耐容例にはRUXが有用である。低リスクPV/ETに対する細胞減少療法は推奨されない(CQ10)。低リスクET(<60歳,かつ血栓症の既往がない)は経過観察が原則であるが,その中で心血管リスク因子(喫煙,高血圧,脂質異常症,糖尿病)のある症例,JAK2変異のある症例では,血栓症発症リスクを低下させるため抗血小板療法(アスピリン投与)を推奨する(CQ9)。血球増加が著明な場合は,細胞減少療法も考慮される(CQ10)。高リスクのET症例(60歳以上または血栓症の既往あり)には,低用量アスピリン投与と細胞減少療法を行う。細胞減少療法にはHUとアナグレリド(ANA)がある(CQ14)。ETにおける血小板の治療目標値は明確ではないが,臨床試験では40万~60万/μLを目標にされることが多い(CQ12)。妊娠合併PV/ETに対して低用量アスピリンによる治療介入を推奨する。高リスク妊娠の場合は,低分子量ヘパリン(保険適用外)の併用を検討する(CQ15)。
MFはPMFと,PV/ETから進展した二次性MFに大別される。それぞれのリスク分類に則り治療方針を選択する(CQ16)。MFの低リスク群,中間-Ⅰリスク群の生命予後は比較的良好である。貧血,全身倦怠感,脾腫に伴う腹部膨満感などがある場合は,症状緩和を目的とした治療を行う(CQ17)。症状のない場合は無治療経過観察の方針が望ましい。中間-Ⅱリスク群,高リスク群の生命予後は不良であり,合併症がなく適切なドナーが得られる場合は同種造血幹細胞移植を考慮する(CQ18)。同種造血幹細胞移植はPMFに対する根治的治療法である。移植適応とならない場合は,RUX投与により,脾腫,全身症状の改善に加え,生命予後の改善も期待できる(CQ17)。MFから進展した白血病に対しては通常の急性骨髄性白血病の治療に準じて寛解導入を行い,移植適応症例については,同種移植を検討することを推奨する(CQ19)。
PMFの初期(pre-PMF)は線維化を認めず,進展すると線維化が著明なovert-PMFとなる。pre-PMFの治療に関するエビデンスは少ないが,overt-PMFの予後予測に基づいて治療方針を選択することを推奨する(CQ20)。血栓既往を有する場合や心血管リスクのある場合などでは,血栓予防を考慮する(CQ9)。
CQ1 初発CML-CPに対する治療として何が勧められるか
- 推奨グレード
- カテゴリー1
初発CML-CPに対しては,第一世代TKIイマチニブ400mg QD(1回/日),または第二世代TKIニロチニブ300mg BID(2回/日),ダサチニブ100mg QD, ボスチニブ400mg QDのいずれかの投与を推奨する。
- 推奨グレード
- カテゴリー2A
治療前のSokalスコアなどで高リスク群の場合は,第二世代TKIが望ましい。また,4剤の副作用プロファイルが異なることから,合併症などの患者背景を考慮して治療薬を選択することを推奨する。
解説
初発CML-CPに対しては,第一世代TKIであるイマチニブ(IMA)と化学療法+インターフェロンα(IFN-α)の併用療法との比較試験(IRIS試験)の結果,IMAの優位性が示された1)。IMA投与によるOSは8年で85%(CML関連死による死亡のみを対象とした8年OSは93%),10年で83.3%と長期間の有効性と安全性も示された2, 3)。同様の結果は日本人患者を対象とした臨床試験(JALSG CML202 study)でも確認された(7年OSが93%)4)。その後,高用量(600~800 mg QD)IMAと通常用量(400mg QD)IMAの比較試験が実施されたが,有効性と安全性の面から高用量の有益性は明らかでない5)。
IMAを対照薬として第二世代TKIであるニロチニブ(NIL),ダサチニブ(DAS),ボスチニブ(BOS)の第Ⅲ相試験が発表されている。NIL 300 mg BID(ENESTnd試験)6),DAS 100 mg QD(DASISION試験)7),BOS 400 mg QD(BFORE試験)8)は,いずれも細胞遺伝学的完全奏効(CCyR),分子遺伝学的大奏効(MMR)達成率について12カ月時点でIMA 400 mg QDより優れていた。さらに,OSに有意差はないものの,AP/BPへの移行も少なく,ENESTnd試験ではCMLに関連した死亡は有意に低下していた9-11)。以上より,有効性において,第二世代TKIはIMAに比べて優位性が示されている。これらの結果から,特に治療前のSokalスコアなどで高リスク群の場合は,第二世代TKIが望ましいと考えられる。しかし,第二世代TKI同士を直接比較した検討もないため,どの第二世代TKIを最初に投与すべきか断定できない12)。一方,長期観察の中でIMAに比べ第二世代TKIの心血管系事象の発生頻度が高い9,10)。TKI4剤の副作用プロファイルが異なることから,合併症など患者背景を考慮し,一次治療薬を選択することが推奨される。
参考文献
1)O’Brien SG, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med. 2003; 348(11): 994-1004.(1iiDiv)
2)Deininger M, et al. International Randomized Study of Interferon vs STI571(IRIS)8-Year Follow-up: Sustained Survival and Low Risk for Progression or Events in Patients with Newly Diagnosed Chronic Myeloid Leukemia in Chronic Phase(CML-CP)Treated with Imatinib. Blood. 2009; 114(22): 1126.(2Diii)
3)Hochhaus A, et al. Long-Term Outcomes of Imatinib Treatment for Chronic Myeloid Leukemia. N Engl J Med. 2017; 376(10): 917-27.(2A)
4)Ohnishi K, et al. Long-term outcome following imatinib therapy for chronic myelogenous leukemia, with assessment of dosage and blood levels: the JALSG CML202 study. Cancer Sci. 2012; 103 (6): 1071-8.(2Div)
5)Gafter-Gvili A, et al. High-dose imatinib for newly diagnosed chronic phase chronic myeloid leukemia patients--systematic review and meta-analysis. Am J Hematol. 2011; 86(8): 657-62.(1iiA,D)
6)Saglio G, et al. Nilotinib versus imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med. 2010; 362(24): 2251-9.(1iiDiv)
7)Kantarjian H, et al. Dasatinib versus imatinib in newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med. 2010; 362(24): 2260-70.(1iiDiv)
8)Cortes JE, et al. Bosutinib Versus Imatinib for Newly Diagnosed Chronic Myeloid Leukemia: Results From the Randomized BFORE Trial. J Clin Oncol. 2018; 36(3): 231-37.(1iiDiv)
9)Hochhaus A, et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase: 5-year update of the randomized ENESTnd trial. Leukemia. 2016; 30(5): 1044-54.(1iiDiv)
10)Cortes JE, et al. Final 5-Year Study Results of DASISION: The Dasatinib Versus Imatinib Study in Treatment-Naïve Chronic Myeloid Leukemia Patients Trial. J Clin Oncol. 2016; 34(20): 2333-40.(1iiDiv)
11)Brümmendorf TH, et al. Bosutinib versus imatinib for newly diagnosed chronic phase chronic myeloid leukemia: final results from the BFORE trial. Leukemia. 2022; 36(7): 1825-33.(1iiDiv)
12)Hochhaus A, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020; 34(4): 966-84.(レビュー)
CQ2 TKI治療開始後の効果判定のモニタリングはどのような方法が勧められるか
- 推奨グレード
- カテゴリー1
国際指標(IS)で補正したBCR::ABL1IS定量RT-PCRによるTKI治療前と治療後3カ月ごとのモニタリングが推奨される。
解説
CMLの治療効果判定のモニタリングには骨髄染色体検査G-banding法によるPh染色体の割合,FISH法によるBCR::ABL1陽性細胞の割合,RT-PCR法によるBCR::ABL1mRNAコピー数が用いられてきた。イマチニブ(IMA)などのTKI療法によりほとんどの症例がMRを達成するため,ELN(2013)以降の治療効果判定方法の中心は末梢血を用いた定量RT-PCR法である1)。標準化された定量RT-PCR法が施行できない地域のためELN(2013)では定量RT-PCR法と同時に染色体分析による評価も併記されていたが1),ELN(2020)では定量RT-PCR法のみとなっている2)。ここで推奨する定量RT-PCR法は,BCR::ABL1 mRNAコピー数とABLなどの内部標準遺伝子のmRNAコピー数の比をISで補正したものであり,BCR::ABL1ISと記載する。わが国においてもISで補正されたBCR::ABL1ISの定量RT-PCR検査が2015年4月から保険診療可能となっており,TKI治療前と治療開始後3カ月ごとのBCR::ABL1IS測定が推奨される2)。ただし,e13a2(b2a2)やe14a2(b3a2)と切断点が異なる稀なBCR::ABL1バリアントの場合は,同検査で検出できないことがあるので注意が必要である。
IRIS試験のサブセット解析では,IMA投与後18カ月でMMR(BCR::ABL1IS≦0.1%)達成例の7年EFS95%,PFS99%と極めて良好であること,IMA投与後12カ月でMMR達成例はCML-AP/BPへの移行が8年時点まで報告されていないこと3-5)から,定量RT-PCR法で評価されたMMRが長期生存を予測するサロゲートマーカーに位置づけられている。さらにIMAを対照薬として第二世代TKIであるニロチニブ(NIL)またはダサチニブ(DAS)の第Ⅲ相試験であるENESTnd試験6,7)またはDASISION試験8,9)において治療後3カ月でBCR::ABL1IS≦10%で定義されるearly molecular response(EMR)がTKIの種類にかかわらず5年PFSまたは5年OSを予測するサロゲートマーカーであると報告されている。同様に,日本人の慢性期CMLを対象とした新TARGET観察研究でも,TKIの種類にかかわらず治療開始後3カ月時点でのEMR到達が,5年目の良好なPFSの予測因子であることが示された10)。
参考文献
1) Baccarani M, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood. 2013; 122(6): 872-84.(レビュー)
2) Hochhaus A, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020; 34(4): 966-84.(レビュー)
3) Druker BJ, et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med. 2006; 355(23): 2408-17.(2Diii)
4) Huges TP, et al. Long-term prognostic significance of early molecular response to imatinib in newly diagnosed chronic myeloid leukemia: an analysis from the International Randomized Study of Interferon and STI571(IRIS). Blood. 2010; 116(19): 3758-65.(2Diii)
5) Deininger M, et al. International Randomized Study of Interferon vs STI571(IRIS)8-Year Follow-up: Sustained Survival and Low Risk for Progression or Events in Patients with Newly Diagnosed Chronic Myeloid Leukemia in Chronic Phase(CML-CP)Treated with Imatinib. Blood. 2009; 114(22): 1126.(2Diii)
6) Saglio G, et al. Nilotinib versus imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med. 2010; 362(24): 2251-9.(1iiDiv)
7) Hochhaus A, et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase: 5-year update of the randomized ENESTnd trial. Leukemia. 2016; 30(5): 1044- 54.(1iiDiv)
8) Kantarjian H, et al. Dasatinib versus imatinib in newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med. 2010; 362(24): 2260-70.(1iiDiv)
9) Cortes JE, et al. Final 5-Year Study Results of DASISION: The Dasatinib Versus Imatinib Study in Treatment-Naïve Chronic Myeloid Leukemia Patients Trial. J Clin Oncol. 2016; 34(20): 2333-40.(1iiDiv)
10)Kizaki M, et al.; New TARGET investigators. Efficacy and safety of tyrosine kinase inhibitors for newly diagnosed chronic-phase chronic myeloid leukemia over a 5-year period: results from the Japanese registry obtained by the New TARGET system. Int J Hematol. 2019; 109(4): 426-39.(3iiiA)
CQ3 ELNの効果判定規準によりWarningやFailureとされた症例に対する二次治療,三次治療以降は何が勧められるか
- 推奨グレード
- カテゴリー2A
・CML-CPの二次治療には,ABL1点突然変異解析を参考としつつ未投与の第二世代TKI(ニロチニブ,ダサチニブ,ボスチニブ)が推奨される。
・CML-CPの三次治療以降には,ABL1 点突然変異解析を参考としつつ未投与の第二世代TKI, 第三世代TKI(ポナチニブ),STAMP阻害薬(アシミニブ)のいずれかが推奨される。
・ABL1点突然変異解析でT315I変異を認めた場合はポナチニブが推奨される。
解説
1.二次治療
一次治療の治療効果は,ELN(2020)の判定規準に従い判断する1)。Warningに対してはモニタリングを頻回に行い,3カ月後の次の評価ポイントまでにはOptimalかFailureかはっきりさせる。その際,アドヒアランスの低下や副作用による休薬がないこと,トラフ濃度測定などによる薬物動態学的検討も治療抵抗性の参考となる。WarningでのTKI変更は任意であり,患者の年齢,併存疾患,忍容性,TFRを検討しているかなどを考慮する。一方,Failureと判定された場合はTKI変更が必須である。まずABL1キナーゼ部位の点突然変異解析や付加的染色体異常の有無を確認し,変異の種類によって,適切な二次治療としての第二世代TKI[ニロチニブ(NIL),ダサチニブ(DAS)またはボスチニブ(BOS)]を選択する2)。二次治療の治療効果判定も,一次治療と同じ効果判定規準を用いる1)。
イマチニブ(IMA)抵抗性・不耐容に対してNIL 400mg BIDに変更した第Ⅱ相試験の48カ月フォローアップデータではCCyR達成率は45%であり,4年OSは78%と良好であった3)。またIMA抵抗性・不耐容に対してDASを100mg QD,50mg BID,140mg QD,70mg BIDにランダム化した第Ⅲ相試験の7年最終データでは,7年までの100mg QD群のMMR達成率は46%,PFSは42%,OSは65%と良好であり,他の投与群も同様であった4)。一方,IMA抵抗性・不耐容286例に対してBOSに変更した第Ⅰ/Ⅱ相試験の4年フォローアップデータでは,累積CCyR達成率は49%,2年OSは91%と良好であった5)。
2.三次治療以降
2種類もしくはそれ以上のTKIに抵抗性・不耐容のCMLに対するポナチニブ(PON),アシミニブ(ASC)の有用性が報告されている。第二世代TKIで濃厚に治療されているTKI抵抗性・不耐容CMLまたはT315Iが検出されているCMLに対してPON 45mg QDに変更した第Ⅱ相試験(PACE試験)では,治療開始後1年以内に46%がCCyR,34%がMMRを達成し6),5年の最終報告ではMMR,MR4.5達成率がそれぞれ40%,24%,OSは73%であった7)。
2022年に上市されたASCは,従来のATP競合性TKIと異なり,ABL1のミリストイルポケットに結合してキナーゼ阻害作用を発揮するファースト・イン・クラスのSTAMP(specifically targeting the ABL myristoyl pocket)阻害薬である。2種類以上のTKI抵抗性・不耐容CML-CPに対するASC 40mg BID vs. BOS 500mg QDのランダム化第Ⅲ相試験(ASCEMBL試験)が実施され,治療効果や安全性に関してASCの優位性が示された(24週のMMR達成率25.5% vs. 13.2%;有害事象による治療中止5.8% vs. 21.1%)8)。
3.T315I変異
ABL1キナーゼ部位の点突然変異解析でT315I変異を認めた場合は,第二世代TKIはすべて無効であり,PONを選択する。上記のPONによるPACE試験では,ベースラインのT315I変異患者に限っても,5年のMMR達成率は58%,OSは66%と,長期治療効果は劣っていなかった7)。一方,ASCに関しては,第I相試験の少なくとも1種類のTKI治療後にT315Iを有するCML-CPを対象とした群において患者18例中5例(28%)が1年以内にMMRを達成した9)。この結果をもとにT315I陽性患者に対しては高用量ASC(200mg BID)が選択され,米国ではT315I陽性患者への適応が追加されたが,本邦では未承認である。上記のASCEMBL試験ではT315I変異を認める症例は除外されているため,ASC 40mg BIDのT315I陽性患者に対しての有効性は不明である。
参考文献
1)Hochhaus A, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020; 34(4): 966-84.(レビュー)
2)Gambacorti-Passerini C, et al. Chronic myeloid leukemia: Second-line drugs of choice. Am J Hematol. 2016; 91(1): 67-75.(レビュー)
3)Giles FJ, et al. Nilotinib in imatinib-resistant or imatinib-intolerant patients with chronic myeloid leukemia in chronic phase: 48-month follow-up results of phase II study. Leukemia. 2013; 27(1): 107-12.(3iiiDiv)
4)Shah NP, et al. Dasatinib in imatinib-resistant or -intolerant chronic-phase, chronic myeloid leukemia patients: 7-year follow-up of study CA180-034. Am J Hematol. 2016; 91(9): 869-74.(3iiiDiv)
5)Brümmendorf TH, et al. Factors influencing long-term efficacy and tolerability of bosutinib in chronic phase chronic myeloid leukaemia resistant or intolerant to imatinib. Br J Haematol. 2016; 172(1): 97-110.(3iiiDiv)
6)Cortes JE, et al. A phase 2 trial of ponatinib in Philadelphia chromosome-positive leukemias. N Engl J Med. 2013; 369(19): 1783-96.(3iiiDiv)
7)Cortes JE, et al. Ponatinib efficacy and safety in Philadelphia chromosome-positive leukemia: final 5-year results of the phase 2 PACE trial. Blood. 2018; 132(4): 393-404.(3iiiDiv)
8)Réa D, et al. A phase 3, open-label, randomized study of asciminib, a STAMP inhibitor, vs bosutinib in CML after 2 or more prior TKIs. Blood. 2021; 138(21): 2031-41.(1iiDiv)
9)Hughes TP, et al. Asciminib in Chronic Myeloid Leukemia after ABL Kinase Inhibitor Failure. N Engl J Med. 2019; 381(24): 2315-26.(3iiiDiv)
CQ4 TKIの注意すべき晩期副作用のモニタリングとして何が勧められるか
- 推奨グレード
- カテゴリー2B
TKI治療前および治療中には心血管イベントに関するリスク因子(年齢,性別,血圧,脂質,糖尿病,喫煙歴)を評価し,動脈硬化や肺高血圧に対する定期的な検査が必要である。また慢性腎臓病(CKD)に対する定期的な検査も必要である。
解説
TKI長期投与により,重篤な心血管イベント[虚血性心疾患,肺動脈性肺高血圧症(pulmonary arterial hypertension:PAH),末梢動脈疾患(peripheral arterial disease:PAD),脳梗塞]や慢性腎臓病(chronic kidney disease:CKD)の合併が認められることがある。
ENESTnd試験の10年とDASISION試験の5年の長期観察では,対照群のイマチニブ(IMA)に比べ第二世代TKI[ニロチニブ(NIL),ダサチニブ(DAS)]の心血管系副作用の頻度が高かった(全Gradeの虚血性心血管イベント:NIL 300mg BID 46例/279例 vs. IMA 400mg QD 10例/280例,DAS 100mg QD 12例/258例 vs. IMA 400mg QD 6例/258例)1, 2)。期間はやや短いが,BFRORE試験の14カ月の観察では,対照群のIMAとボスチニブ(BOS)の心血管系副作用の頻度はほぼ同等であった(BOS 400mg QD 14例/268例 vs. IMA 400mg QD 14例/268例)3)。また,第三世代TKIポナチニブ(PON)とIMAの比較試験であるEPIC試験はPONに高発現した心血管系副作用のために開始14カ月で早期中止されたが,PON投与10例(6%)/154例 vs. IMA 1例(1%)/152例で重篤な動脈閉塞性事象をきたした4)。
これらの合併症は用量に依存するものの,発症に関するoff target効果などの正確なメカニズムはわかっていないため,TKIの中止以外に有効な予防は明らかではない。しかしながら,少なくとも心血管イベントに関わる合併症を有する症例(糖尿病,高血圧,脂質異常症)で有意に心血管イベントが多いことから5),厳格な血糖と血圧コントロール,ストロングスタチンの投与によるLDLコレステロールのコントロールを行い,喫煙者であれば禁煙を指導する6)。
NIPPON DATA 80の長期観察研究によって,年齢,性別,血圧,脂質,糖尿病,喫煙歴からなる心血管病変の死亡リスクが示されている7)。TKI投与前には心血管イベントのリスクをこれらのデータを参照して評価し,高リスク群(糖尿病や脂質異常症を有する喫煙,高齢者)に対しては第二世代TKIのリスクとベネフィットの両者を説明し同意を得た上で投与すべきである。また投与前と投与中は簡便で非侵襲的なABIや頸動脈超音波検査を用いた動脈硬化の定期的なモニタリングが推奨される。一方,TKI関連血管閉塞性事象に対する抗血小板薬投与による一次予防の有効性は現在のところ明らかではない。しかしながら,心血管イベントの高リスク症例やTKI治療前にすでに明らかな動脈硬化が認められる症例では予防を考慮しても良い。
DASでは虚血性心疾患に加え,稀ではあるもののPAHの合併が報告されている8)。PAHの発症はDASISION試験5年まででDAS群258例中6例,IMA群258例中0例である2)。投与中どのような症例にPAH発症のリスクが高いか推測することは困難であるため,DAS投与中は定期的なモニタリングが必要である。PAHのスクリーニングおよびモニタリングとして,定期的なBNP測定とドップラー心超音波検査が有用である8)。PAHに対する治療はDASの中止であり,早期であれば可逆的であることも報告されている9)。
IMA,NILあるいはDASが一次治療として使用された468例中58例(14%)でTKI投与を受けている間にCKDを発症し,そのうち49例(84%)はIMAによる治療を受けている間に発症した(p<0.001)。IMA以外にも,年齢,高血圧の既往,糖尿病もCKDの発症と関連していた。ベースラインでCKDを発症していない患者では,IMAが時間の経過とともにGFRを低下させることが示された10)。TKIの長期使用においては,CKDにも注意を払う必要がある。
参考文献
1)Kantarjian HM, et al. Long-term outcomes with frontline nilotinib versus imatinib in newly diagnosed chronic myeloid leukemia in chronic phase: ENESTnd 10-year analysis. Leukemia. 2021; 35(2): 440-53.(1iiDiv)
2)Cortes JE, et al. Final 5-Year Study Results of DASISION: The Dasatinib Versus Imatinib Study in Treatment-Naïve Chronic Myeloid Leukemia Patients Trial. J Clin Oncol. 2016; 34(20): 2333-40.(1iiDiv)
3)Cortes JE, et al. Bosutinib Versus Imatinib for Newly Diagnosed Chronic Myeloid Leukemia: Results From the Randomized BFORE Trial. J Clin Oncol. 2018; 36(3): 231-7.(1iiDiv)
4)Lipton JH, et al. Ponatinib versus imatinib for newly diagnosed chronic myeloid leukaemia: an international, randomised, open-label, phase 3 trial. Lancet Oncol. 2016; 17(5): 612-21.(1iiDiv)
5)Rea D, et al. Usefulness of the 2012 European CVD risk assessment model to identify patients at high risk of cardiovascular events during nilotinib therapy in chronic myeloid leukemia. Leukemia. 2015; 29(5): 1206-9.(レビュー)
6)Valent P, et al. Vascular safety iss es in CML patients treated with BCR/ABL1 kinase inhibitors. Blood. 2015; 125(6): 901-6.(レビュー)
7)NIPPON DATA80 Research Group. Risk assessment chart for death from cardiovascular disease based on a 19-year follow-up study of a Japanese representative population. Circ J. 2006; 70(10): 1249-55.(3iA)
8)Montani D, et al. Pulmonary arterial hypertension in patients treated by dasatinib. Circulation. 2012; 125(17): 2128-37.(3iC)
9)Shah NP, et al. Clinical features of pulmonary arterial hypertension in patients receiving dasatinib. Am J Hematol. 2015; 90(11): 1060-4.(3iiiDiv)
10)Yilmaz M, et al. Estimated glomerular filtration rate changes in patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors. Cancer. 2015; 121(21): 3894-904.(3iiiDiv)
CQ5 同種造血幹細胞移植はCMLの治療中どのようなときに考慮すべきか
- 推奨グレード
- カテゴリー2A
・初発CML-BPやTKI治療中のAP/BPに対しては,TKIや追加薬剤を用いて慢性期の再構築を目指した後に同種造血幹細胞移植を行うべきである。
・初発CML-APに対しては,最初に第二世代TKIを投与する。TKIの効果が不十分な場合は,未投与のTKIを推奨するが,これにも効果不十分な場合は同種造血幹細胞移植の準備を開始する。
・複数のTKIおよびアシミニブを投与しても耐性や不耐容を示すCML-CPに対しては,同種造血幹細胞移植を考慮する。
解説
CML患者が治癒可能な唯一の治療法は同種造血幹細胞移植(allo-HSCT)であり,2002年まではHLAが一致した適切なドナーを持つすべてのCML患者がallo-HSCTの候補者であった。TKIによってCMLの予後が格段に改善され,さらに複数の選択的TKIが利用できるようになったことで,CML-CPに対して,一次治療としてallo-HSCTは基本的に行わなくなったが1,2),CML-AP/BPでは未だallo-HSCTは治療上重要な選択肢である。
初発CML-BPやTKI治療中のCML-AP/BPに対しては,TKIや追加薬剤を用いて慢性期の再構築を目指した後にallo-HSCTを行うべきである。AP/BPはたとえCPに戻ったとしても,CP期はしばしば短いため,AP/BP患者では,ドナー探索を含め治療最初からallo-HSCTを念頭に置いて治療にあたるべきである3)。特にCML-BPに対しては感受性のあるTKIを選択し,さらに化学療法を併用することで治療効果の向上が期待できる4)。Lymphoid BPであればビンクリスチン(VCR)とステロイドが含まれるALL型の化学療法5),Myeloid BPであればシタラビン(AraC)が含まれるAML型の化学療法6)を併用する。2回目のCPを達成したCML-AP/BP患者の長期生存率は,骨髄破壊的allo-HSCTを受けた患者で30~40%程度である7)。本邦におけるCML-BPに対する血縁者間および非血縁者間allo-HSCTの生存割合は移植後1年で46.2%,43.9%,移植後5年で24.6%,24.1%である8)。
初発CML-AP対して用いるTKIについては,未だ前方視的ランダム化比較試験はないが,最初により効果の高い第二世代TKIを投与するのが望ましいと考えられる9)。AP患者の約20~40%はTKI単独でCCyRを達成するが,効果はしばしば持続的ではない。対照的に,allo-HSCTを受けた患者の5年PFSは50~80%と良好な成績が報告されている10)。CML診断後12カ月以上,Hb 10g/dL以下,および末梢血芽球5%以上などのリスク因子がない低リスクCML-AP患者では,allo-HSCTを急ぐ必要がないとされる。これらのリスク因子のいずれか1つを有する患者では,allo-HSCTでより優れた予後が期待でき,2つ以上のリスク因子を有する患者は,TKIのみで治療した場合に特に不良な予後であった10)。
TKIに耐性や不耐容を示すCML-CP患者でもallo-HSCTの適応は残っている。二次使用したTKIでの治療が失敗した患者は,特に切り替えの理由が先に使用したTKI療法に対する不耐容ではなく抵抗性である場合,三次で使用されたTKIによる治療後のCCyR達成は可能であるが,奏効率は変動し,奏効の持続性もより不確かなものになる11)。したがって,2種類以上のTKIやアシミニブ(ASC)による治療後に持続するCCyRを達成できないすべてのCML-CP患者では,allo-HSCTの適応を考慮する必要がある。
初回TKI治療後に持続的なCCyRを達成できない患者の約20%で,ゲートキーパー部位の変異であるT315I変異が検出される。このような患者は,ポナチニブ(PON)出現以前は移植適応であったが,T315Iにも有効なPONの出現後は,移植の適応が変わった12)。しかし,PONに対して初期または獲得耐性を示すT315I変異を有する患者は,可能であればallo-HSCTの準備を進めるべきである13)。
稀ではあるがTKI使用患者で,適切なTKIの減量とサイトカインなどのサポートにもかかわらず,重篤な血球減少をきたすことがある。これにより,治療が頻繁に中断され,TKIの効果的な持続的投与が妨げられることがある。これらの患者は骨髄を再増殖させるのに十分な残存正常造血がない可能性が高いため,allo-HSCTは優れた長期生存を提供できる唯一の効果的な治療法である。
CML-CPでは特にallo-HSCTの適応に悩むことが多いが,移植の遅れは必ずしも予後の悪化と関連しないという報告もある10,14)。
参考文献
1) Baccarani M, et al.; European LeukemiaNet. Chronic myeloid leukemia: an update of concepts and management recommendations of European LeukemiaNet. J Clin Oncol. 2009; 27(35): 6041-51.(レビュー)
2) Jabbour E, et al. Chronic myeloid leukemia: 2012 update on diagnosis, monitoring, and management. Am J Hematol. 2012; 87(11): 1037-45.(レビュー)
3) Hehlmann R, et al. Management of CML-blast crisis. Best Pract Res Clin Haematol. 2016; 29(3): 295-307.(レビュー)
4) Jain P, et al. Prognostic factors and survival outcomes in patients with chronic myeloid leukemia in blast phase in the tyrosine kinase inhibitor era: Cohort study of 477 patients. Cancer. 2017; 123(22): 4391-402.(3iiiDiv)
5) Yanada M, et al. High complete remission rate and promising outcome by combination of imatinib and chemotherapy for newly diagnosed BCR-ABL-positive acute lymphoblastic leukemia: a phase II study by the Japan Adult Leukemia Study Group. J Clin Oncol. 2006; 24(3): 460-6.(3iiiDiv)
6) Fruehauf S, et al. Imatinib combined with mitoxantrone/etoposide and cytarabine is an effective induction therapy for patients with chronic myeloid leukemia in myeloid blast crisis. Cancer. 2007; 109(8): 1543-49.(3iiiDiv)
7) Crawley C, et al.; Chronic Leukemia Working Party of the EBMT. Outcomes of reduced-intensity transplantation for chronic myeloid leukemia: an analysis of prognostic factors from the Chronic Leukemia Working Party of the EBMT. Blood. 2005; 106(9): 2969-76.(3iiiA)
8) 日本における造血細胞移植.平成25年度 全国調査報告書.日本造血細胞移植データセンター/ 日本造血細胞移植学会 http://www.jdchct.or.jp/data/report/2013/3-3-4.pdf(レビュー)
9) Ohanian M, et al. Tyrosine kinase inhibitors as initial therapy for patients with chronic myeloid leukemia in accelerated phase. Clin Lymphoma Myeloma Leuk. 2014, 14(2): 155-62.e1.(3iiiA)
10)Jiang Q, et al. Imatinib mesylate versus allogeneic hematopoietic stem cell transplantation for patients with chronic myelogenous leukemia in the accelerated phase. Blood. 2011; 117(11): 3032-40.(3iiiDiv)
11)Khoury HJ, et al. Bosutinib is active in chronic phase chronic myeloid leukemia after imatinib and dasatinib and/or nilotinib therapy failure. Blood. 2012; 119(15): 3403-12.(2iiiDiv)
12)Cortes JE, et al. Ponatinib efficacy and safety in Philadelphia chromosome-positive leukemia: final 5-year results of the phase 2 PACE trial. Blood. 2018; 132(4): 393-404.(3iiiDiv)
13)Nicolini FE, et al. Overall survival with ponatinib versus allogeneic stem cell transplantation in Philadelphia chromosome-positive leukemias with the T315I mutation. Cancer. 2017; 123(15): 2875-80.(3iA)
14)Hehlmann R, et al. Drug treatment is superior to allografting as first-line therapy in chronic myeloid leukemia. Blood. 2007; 109(11): 4686-92.(2A)
CQ6 DMRを達成しMRDが検出されなければTKI中止は勧められるか
- 推奨グレード
- カテゴリー2A
妊娠を望む若い女性や晩期副作用のためにTKI継続が困難などの理由がある場合,あるいはDMRが得られた患者の中で一定の条件を満たした場合は,定期的なモニタリングを条件にTKI中止を考慮することができる。臨床試験外で中止を試みる場合は,血液専門医による日本血液学会のJ-SKIに登録を推奨する。
解説
無治療寛解(TFR)はCML-CP治療の新しい目標である。CML-CPと診断され,一次治療のイマチニブ(IMA)(STIM試験,JALSG STIM213試験)1,2),ニロチニブ(NIL)(ENESTfreedom試験,JALSG N-STOP試験)3,4)およびダサチニブ(DAS)(first-line DADI試験,JALSG D-STOP試験)5,6)などによってDMRが一定期間(1~2年以上)維持できた患者の約半数は,TKIを中止しても分子遺伝学的再発のないTFRを維持できることが報告された。また,前TKIに耐性あるいは不耐容を示し,二次治療のNIL(ENESTop試験)7)やDAS(DADI試験)8)も一定期間DMRが維持できた患者の約半数は,TKIを中止してもTFRを維持できることが報告された。注意すべきは,前TKI耐性のためにTKIが変更になった患者ではTFR率は極めて低く,このような患者では現時点ではTKIを中止すべきではない。
長期投与に伴う過剰な治療と晩期毒性を避け,医療経済の見地からもTFRはCML-CP治療の目標であることは間違いない。欧米ではEURO-SKIをはじめとする大規模な臨床試験により安全にTKI治療が終了できる基準が確立され,日常診療で専門医によるTKIの中止が行われている。特に,妊娠を望む女性や重篤な副作用の合併など特別な事情の場合は,厳重な定量PCRによるMRDのモニタリングを行う条件で,TKI中止を考慮することができる。現在まで本邦で行われたTKI中止試験(JALSG STIM213,DADI,1st DADI,NIL-Stop,STAT2,JALSG N-STOP,JALSG D-STOPなど)の中でTKI中止の可能性が追試され,病期進行は認めていない。そこで,日本血液学会の事業として,新規レジストリ研究「慢性骨髄性白血病患者に対するTKI中止後の無治療寛解維持を検討する日本国内多施設共同観察研究:J-SKI(the Japanese Stop Kinase Inhibitor)」が開始された9)。J-SKIに登録することで血液専門医によるTKI中止を試みることは許容される。
NCCNガイドラインでは,臨床試験外でのTKI中止に必要な条件として以下を挙げている10)。
1) 18歳以上
2) CML-AP/BPの既往のないCML-CP
3) 最低3年以上のTKI治療歴
4) 3カ月以上の間隔をおいて,少なくとも4回以上の検査を実施し,最低2年以上安定したMR4.0を維持している。
5) MR4.5が確実に検出できる検査を利用でき,結果を2週間以内に知ることができる。
6) 中止後最初の6カ月間は,毎月1回 IS,7~12カ月は2カ月に1回,MMRを維持している患者には,その後,継続して3カ月ごとにBCR::ABL1 mRNA(IS)の測定ができる。
7) MMRが失われた後にTKI治療を再開した患者には,MMRが再び確立されるまで毎月BCR::ABL1 mRNA(IS)を行い,MMRに再度達成した後は継続して3カ月ごとにBCR::ABL1 mRNA(IS)を測定できる。TKI再開後3カ月経過してもMMRが達成できない患者に対しては,BCR::ABL1キナーゼドメイン変異検査を実施し,毎月1回のBCR::ABL1 mRNA(IS)測定をさらに6カ月間継続する必要がある。
また,発症機序は不明であるが,TKI中止後,筋骨格痛を主体とする離脱症候群を20~30%の症例で認めることがあるので中止時に説明と同意が必要である。一過性であり対症療法にて軽快することが多い11)。
1回目のTKI中止でTFRが維持できず,TKIを再開し再度DMRを一定期間維持できた患者において2回目のTKI中止の可能性が示されている。2回目のTKI中止から24カ月後のTFR率は,1回目のTKI中止時に最初の3カ月間DMRを維持できていた患者で高かった(72% vs. その他の患者で32%)12)。現時点で2回目のTKI中止に関する情報は少なく,基本的には臨床試験下で行うべきである。なお,10年以上の長期観察がなく晩期分子遺伝学的再発は完全に否定されないため,TFR中のMRDモニタリングは今のところ生涯行うべきである。
参考文献
1) Mahon FX, et al. Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib(STIM)trial. Lancet Oncol. 2010; 11(11): 1029-35.(3iiiDiv)
2) Takahashi N, et al. Deeper molecular response is a predictive factor for treatment-free remission after imatinib discontinuation in patients with chronic phase chronic myeloid leukemia: the JALSG-STIM213 study. Int J Hematol. 2018 Feb; 107(2): 185-93.(3iiiDiv)
3) Hochhaus A, et al. Treatment-free remission following frontline nilotinib in patients with chronic myeloid leukemia in chronic phase: results from the ENESTfreedom study. Leukemia. 2017; 31(7): 1525-31.(3iiiDiv)
4) Takahashi N, et al. Treatment-free remission in patients with chronic myeloid leukemia in chronic phase following frontline nilotinib: results from JALSG N-STOP216. EHA Library. 2021: 325427; EP667.(3iiiDiv)
5) Kimura S, et al. Treatment-free remission after first-line dasatinib discontinuation in patients with chronic myeloid leukaemia(first-line DADI trial): a single-arm, multicentre, phase 2 trial. Lancet Haematol. 2020; 7(3): e218-25.(3iiiCiv)
6) Minami Y, et al. Treatment-free remission in patients with chronic myeloid leukemia in chronic phase following frontline dasatinib: results from JALSG D-STOP216. EHA Library. 2021: 325428; EP668.(3iiiDiv)
7) Hughes TP, et al. Long-term treatment-free remission in patients with chronic myeloid leukemia after second-line nilotinib: ENESTop 5-year update. Leukemia. 2021;35(6): 1631-42.(3iiiCiv)
8) Imagawa J, et al. Discontinuation of dasatinib in patients with chronic myeloid leukaemia who have maintained deep molecular response for longer than 1 year(DADI trial): a multicentre phase 2 trial. Lancet Haematol. 2015;2(12): e528-35.(3iiiDiv)
9) 慢性骨髄性白血病患者に対するチロシンキナーゼ阻害薬中止後の無治療寛解維持を検討する日本国内多施設共同観察研究:J-SKI(the Japanese Stop Kinase Inhibitor)http://www.jshem.or.jp/modules/research/index. php?content_id=13
10)Deininger MW, et al. Chronic Myeloid Leukemia, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2020; 18(10): 1385-415.(レビュー)
11)Lee SE, et al. Imatinib withdrawal syndrome and longer duration of imatinib have a close association with a lower molecular relapse after treatment discontinuation: the KID study. Haematologica. 2016; 101(6): 717-23.(3iiiCiv)
12)Legros L, et al. Second tyrosine kinase inhibitor discontinuation attempt in patients with chronic myeloid leukemia. Cancer. 2017; 123(22): 4403-10.(3iiiCiv)
CQ7 CMLに対するTKI治療中にTKIの減量は勧められるか
- 推奨グレード
- カテゴリー1
TKIに関連した有害事象に対する減量基準に基づき用量調整を行う必要がある。ポナチニブに関しては長期の安全性を確保するため,治療効果を指標(IS≦1%)に15mgに減量する必要がある。
- 推奨グレード
- カテゴリー2A
高齢者などでは有害事象を避けるため,TKIの減量を行うことができる。
- 推奨グレード
- カテゴリー2B
DMRを維持している症例ではTKIに関連した有害事象を避けるため,TKIの減量を行っても良い。
解説
1.TKIの減量基準に基づく用量調整
新規慢性期CMLに対するTKIの開発臨床治験(IRIS1),BFORE2),DASISION3),ENESTnd4))によってTKIの標準投与量[イマチニブ(IMA)400mg 1日1回,ボスチニブ(BOS)400mg 1日1回,ダサチニブ(DAS)100mg 1日1回,ニロチニブ(NIL)300mg 1日2回]が示されているが,TKIに関連した有害事象の中止減量基準に基づき用量調整を行う必要がある。添付文書などでは,用量用法は患者の状態により適宜減量すると記載されており,有害事象の程度にて休薬や減量基準が示されている。
一方,ポナチニブ(PON)のCMLに対する標準投与量は2010年に開始されたPACE試験5)で45mg 1日1回と規定され,2012年米国,2013年欧州,2016年本邦でT315I変異を含む治療抵抗性CMLに対して認可された。しかしながら,心血管リスクの高い症例で予期せぬ血管閉塞性事象が発生し,有害事象が用量に依存することが推測されたことから,2013年よりMCyR達成症例には15mg,未達成症例または進行期移行期症例には30mgに減量することが推奨された。本邦においてはPONの初回治療の用量用法は45mg 1日1回と規定されているが,リスクとベネフィットを考え,国内の臨床医は15mgまたは30mg 1日1回を初回投与量として採用し,安全に投与が行われている。前治療抵抗性CMLに対するPON初期投与量15mg,30mg,45mgのランダム化比較試験(OPTIC試験)6)が行われ,15mgや30mgでは血管閉塞性事象を減らしつつ,T315I変異のない患者やTKI抵抗性の低い患者で十分な治療効果が得られることが明らかとなった。長期の安全性を確保するために治療効果を指標(IS≦1%)にPONは15mgに減量する必要がある。
2.高齢者などに対するTKIの減量
前述のOPTIC試験6)はTKIの用量変更戦略を明らかとした初めての大規模比較試験であり,この試験はその他のTKIについても同様の用量変更戦略を検討し得る根拠となるかもしれない。治療開始時より減量したTKI(IMA,BOS,DAS,NIL)を投与する治療戦略に関しては限られたエビデンスしかないものの,TKI関連有害事象に関する高リスク症例や高齢者に対しては有用であると考えられる。
IMAの新規発症CMLに対する標準投与量はIRIS試験1)の結果400mg 1日1回であるが,国内の新規発症CMLに対する前方視的試験JALSG CMLで300mg 1日1回でも同様の治療効果が示された(JALSG CML202)7)。JALSG CML202試験では300mg群と400mg群の間でIMAのトラフ濃度に有意差は認められなかった7)。IMAの血中濃度は用量に依存するものの濃度の分布に日本人特有のABCG2などの薬物トランスポーターの一塩基多型などによる個人差が大きい8)。MMRを達成している症例ではMMR未達成症例に比べ,IMAの血中濃度がターゲット濃度の1,000 ng/mL以上を認める症例が有意に多いことからも,MMR未達成の症例ではアドヒアランスを確認する目的も兼ねて血中濃度測定も有用である9)。
新規発症CMLに対するBOSの標準投与量はBFORE試験2)の結果400mg 1日1回であるが,国内CMLエキスパートは200mg 1日1回から開始し400mgまで漸増する投与方法を多くの症例に対して採用している10)。下痢などの消化管障害に対する支持療法に加え,日本人に多い肝障害の早期対応が可能である。一方,認容性が認められる場合は標準投与量まで増量することが重要であり,開発臨床試験では300mg 1日1回までの減量は規定されているがそれより少ない用量の長期投与における有効性を示すエビデンスはない。なお,現在本邦ではCMLに対するBOSの漸増方法を検証する前方視的臨床試験が行われている。
新規発症CMLに対するDASの標準投与量はDASISION試験3)の結果100mg 1日1回である。しかし,小規模の限られたコホートであるが50mg 1日1回でも同様の治療効果が期待され,胸水貯留や血球減少などの有害事象を避けることができた11-13)。特に有害事象が危惧される高齢者では,治療開始時から少量投与を行う必要があるかもしれない。一方,高リスク症例に対してのDAS少量投与のエビデンスはない。また,若年者に対してはDAS少量投与がDMR後のTFRの成功に影響を及ぼす可能性があるかもしれないので注意が必要である。
新規発症CMLに対するNILの標準投与量はENESTnd試験4)の結果300mg 1日2回である。ENESTnd試験の10年の長期観察14)において400mg 1日2回と比較し300mg 1日2回投与の方が血管閉塞性事象は少なく,血管閉塞性事象の発症はPONと同様に用量依存性である可能性が示された。小規模の限られたコホートではあるが,二次治療においても400mg 1日2回に代えて300mg 1日2回の有用性と安全性が示されている15)。開発臨床試験では400mg 1日1回までの減量は規定されているが,それより少ない用量の有効性を示すエビデンスはない。
3.DMR維持症例に対するTKIの減量
3年以上の長期TKI治療歴を持つCML患者で12カ月以上のDMR(IS≦0.0032%)を維持している場合は,TKIに関連した晩期有害事象を避ける目的でTKIの減量を検討しても良いと考える。減量後も定期的なISモニタリングを行い深い治療効果が維持されていることを確認する必要がある。独立した前方視的臨床試験を用いた数理モデルによると,既に深い奏効を維持している患者であれば50%のTKI減量では長期の治療効果を失うことはないと結論付けている16)。
参考文献
1)O’Brien SG, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med. 2003; 348(11): 994-1004.(1iiDiv)
2)Cortes JE, et al. Bosutinib Versus Imatinib for Newly Diagnosed Chronic Myeloid Leukemia: Results From the Randomized BFORE Trial. J Clin Oncol. 2018; 36(3): 231-7.(1iiDiv)
3)Kantarjian HM, et al. Dasatinib or imatinib in newly diagnosed chronic-phase chronic myeloid leukemia: 2-year follow-up from a randomized phase 3 trial (DASISION). Blood. 2012; 119(5): 1123-9.(1iiDiv)
4)Kantarjian HM, et al. Nilotinib versus imatinib for the treatment of patients with newly diagnosed chronic phase, Philadelphia chromosome-positive, chronic myeloid leukaemia: 24-month minimum follow-up of the phase 3 randomised ENESTnd trial. Lancet Oncol. 2011; 12(9): 841-51.(1iiDiv)
5)Cortes JE, et al. Ponatinib efficacy and safety in Philadelphia chromosome-positive leukemia: final 5-year results of the phase 2 PACE trial. Blood. 2018; 132(4): 393-404.(3iiiDiv)
6)Cortes J, et al. Ponatinib dose-ranging study in chronic-phase chronic myeloid leukemia: a randomized, open-label phase 2 clinical trial. Blood. 2021; 138(21): 2042-50.(1iiDiv)
7)Ohnishi K, et al. Long-term outcome following imatinib therapy for chronic myelogenous leukemia, with assessment of dosage and blood levels: the JALSG CML202 study. Cancer Sci. 2012; 103(6): 1071-8.(2Div)
8)Takahashi N, et al. Influence of CYP3A5 and drug transporter polymorphisms on imatinib trough concentration and clinical response among patients with chronic phase chronic myeloid leukemia. J Hum Genet. 2010; 55(11): 731-7.(3iiDiv)
9)Takahashi N, et al. Correlation between imatinib pharmacokinetics and clinical response in Japanese patients with chronic-phase chronic myeloid leukemia. Clin Pharmacol Ther. 2010; 88(6): 809-13.(3iiDiv)
10)Mita A, et al. Correlation of plasma concentration and adverse effects of bosutinib: standard dose or doseescalation regimens of bosutinib treatment for patients with chronic myeloid leukemia. Exp Hematol Oncol. 2018; 7: 9.(3iiDiv)
11)Naqvi K, et al. Early results of lower dose dasatinib (50 mg daily)as frontline therapy for newly diagnosed chronic-phase chronic myeloid leukemia. Cancer. 2018; 124(13): 2740-7.(2Div)
12)Naqvi K, et al. Long-term follow-up of lower dose dasatinib (50 mg daily)as frontline therapy in newly diagnosed chronic-phase chronic myeloid leukemia. Cancer. 2020; 126(1): 67-75.(2Div)
13)Murai K, et al. Low-dose dasatinib in older patients with chronic myeloid leukaemia in chronic phase (DAVLEC): a single-arm, multicentre, phase 2 trial. Lancet Haematol. 2021; 8(12): e902-11.(2Div)
14)Kantarjian HM, et al. Long-term outcomes with frontline nilotinib versus imatinib in newly diagnosed chronic myeloid leukemia in chronic phase: ENESTnd 10-year analysis. Leukemia. 2021; 35(2): 440-53.(1iiDiv)
15)Hiwase D, et al. Efficacy and safety of nilotinib 300 mg twice daily in patients with chronic myeloid leukemia in chronic phase who are intolerant to prior tyrosine kinase inhibitors: Results from the Phase IIIb ENESTswift study. Leuk Res. 2018; 67: 109-15.(2Div)
16)Fassoni AC, et al. Reduced tyrosine kinase inhibitor dose is predicted to be as effective as standard dose in chronic myeloid leukemia: a simulation study based on phase III trial data. Haematologica. 2018; 103(11): 1825-34.(1iiDiv)
CQ8 CML患者もしくはそのパートナーの妊娠にはどのような対応が勧められるか
- 推奨グレード
- カテゴリー2B
妊娠中および授乳中の女性CML患者に対してTKI治療は推奨されない。妊娠中はIFN-α治療,もしくはTKI治療中止が推奨される。一方,男性患者に対してTKI治療中止を推奨する根拠はない。
解説
妊娠を希望する患者とそのパートナーには,本ガイドラインが経験則に基づいて策定されたものであることを説明の上,患者の意思とリスクを考慮し慎重に治療方針を決定する。
1.TKI治療中のCML患者もしくはそのパートナーが妊娠を希望した場合
男性患者がパートナーの妊娠を計画した場合,イマチニブ(IMA)または第二世代TKI[ダサチニブ(DAS),ニロチニブ(NIL),およびボスチニブ(BOS)を含む]による治療は中止する必要はない。これらの治療を受けていた男性患者において,児の先天性異常は増加しないと複数の報告がなされている1-3)。しかし,ポナチニブ(PON)およびアシミニブ(ASC)の男性患者に起因する催奇形性リスクについては不明である3)。また,TKIの妊孕性への影響については検討が十分ではないが,IMAについては投与後に精子の質と形態の変化は認めないと報告されている3)。TKI治療前に精子保存を行うことは可能であるが,無治療の男性CML患者における精子の質についてはデータがない。催奇形性の一般的リスクについて十分に議論し,患者希望を考慮しTKI治療を中止する必要はない。
女性患者が妊娠を希望した場合は,TKI治療の中止もしくは変更を積極的に検討する3)。TKIは胎盤や胎児に移行し,流産と胎児異常の頻度をいずれも増加させるためである1-5)。深い奏効を獲得維持できている患者ではTFRが期待できるため,TKI治療を中止し妊娠を試みることができる(CQ6参照)3)。したがって,個々の患者において治療背景と効果を評価し,TKI治療中止の可能性について慎重に検討する。TKI治療中止が適切でない患者,および中止後に再発を認めた患者はINF-αの治療に切り替える3,6)。しかし,TKIを用いない治療は疾患進展のリスクを伴うため,疾患状態と患者希望を考慮した上で十分に議論し意思決定を行う。なお,TKI中止後再発リスクが低下する6カ月のTFR観察期間を経た上での妊娠が理想的である7)。妊娠が成功した場合はハイリスク妊娠を専門とする産科医との緊密な連携,および定期的な胎児超音波検査が推奨される3)。また,TKIは母乳に移行するため,TKI内服中の授乳は禁忌である3,8)。授乳を行う場合はTKI治療を中止し,児のTKI曝露を回避する3,8)。TKIの薬物動態の検討から,TKIが体内から消失するためには少なくともTKI中止から数日間は必要であると考えられている9)。
2.TKI治療中のCML患者もしくはそのパートナーが妊娠した場合
CMLに対するTKI治療中に予期せぬ妊娠をした場合の管理は,TKI治療の継続・中止・変更および妊娠の継続・非継続の選択肢があり,患者の希望に応じ個々に検討する必要がある。TKIはオフターゲット作用に起因する催奇形性があり,特に器官形成時のTKI曝露は避ける必要がある1-4)。そのため,CML治療中に妊娠が疑われた場合は直ちにTKI治療を中止し妊娠状態を確認する。正常妊娠が確認されたらTKIをIFN-α治療に切り替える3,6)。しかし,TFR維持が期待できる状態の患者については,妊娠を契機にTKI治療を中止し,厳格なモニタリング下に無治療経過観察を行うこともできる(CQ6参照)3)。IMAは妊娠中期(16~27週)および後期(28~39週)で安全に使用できるとする報告はあるが,症例集積が不十分であり現時点では推奨されない3,4)。その他のTKIについても同様に推奨されない1-4)。病勢が進行している,あるいはIFN-α治療に不応性の場合には,妊娠中期から後期でTKIを投与するか妊娠22週未満で中絶を行うかについて,リスクとベネフィットを説明した上で患者の意思を尊重し慎重に選択する。いずれの場合もハイリスク妊娠を専門とする産科医と密に連携を行う。
3.妊娠中にCMLと診断された場合
妊娠中にCMLと診断された女性患者の初期治療はIFN-αを用いる3,6)。ヒドロキシウレア(HU)およびTKIの投与は推奨されない。白血球増多が顕著な患者に対する白血球アフェレーシスは妊娠中でも実施可能である3)。白血球増多が軽微な患者については出産後まで治療開始を待てる可能性があり,慎重に無治療経過観察することもできる3)。病勢が進行している,あるいはIFN-α治療に不応性の場合には,妊娠中期から後期でTKIを投与するか妊娠22週未満で中絶を行うかについて,リスクとベネフィットを説明した上で患者の意思を尊重し慎重に選択する。いずれの場合もハイリスク妊娠を専門とする産科医と密に連携を行う。
参考文献
1) Cortes JE, et al. The impact of dasatinib on pregnancy outcomes. Am J Hematol. 2015; 90(12): 1111-5.(3iiiC)
2) Cortes JE, et al. Pregnancy outcomes in patients treated with bosutinib. Int J Hematol Oncol. 2020; 9(2): IJH26.(3iiiC)
3) Hochhaus A, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020; 34(4): 966-84.(レビュー)
4) Pye SM, et al. The effects of imatinib on pregnancy outcome. Blood. 2008; 111(12): 5505-8.(3iiiC)
5) Chelysheva E, et al. Placental transfer of tyrosine kinase inhibitors used for chronic myeloid leukemia treatment. Leuk Lymphoma. 2018; 59(3): 733-8.(3iiiC)
6) Lasica M, et al. The effect of tyrosine kinase inhibitor interruption and interferon use on pregnancy outcomes and long-term disease control in chronic myeloid leukemia. Leuk Lymphoma. 2019; 60(7): 1796-802.(3iiiC)
7) Abruzzese E, et al. Tyrosine kinase inhibitors and pregnancy in chronic myeloid leukemia: opinion, evidence, and recommendations. Ther Adv Hematol. 2020; 11: 2040620720966120.(レビュー)
8) Chelysheva E, et al. Breastfeeding in Patients with Chronic Myeloid Leukaemia: Case Series with Measurements of Drug Concentrations in Maternal Milk and Literature Review. Mediterr J Hematol Infect Dis. 2018; 10(1): e2018027.(3iiiC)
9) Apperley J. CML in pregnancy and childhood. Best Pract Res Clin Haematol. 2009; 22(3): 455-74.(レビュー)
CQ9 すべてのPV/ET/MFに対してアスピリンの投与は勧められるか
- 推奨グレード
- カテゴリー1
PVに対しては,禁忌でない限り,全例でアスピリンの投与が勧められる。
- 推奨グレード
- カテゴリー2A
ETに対しては,全例ではなく血栓症のリスクやドライバー遺伝子のタイプなどに応じて投与を行う。
- 推奨グレード
- カテゴリー2B
MFに対しては,血栓既往を有する場合や心血管リスクのある場合などでは,アスピリンの投与を考慮してもよい。
解説
PVにおいて,アスピリンが血栓・出血の合併症を抑制し得るかについては前方視的ランダム化比較試験により検証されている1)。この試験では,アスピリンに対する禁忌や過去の血栓既往などでアスピリンが明確に適応である症例は除外されている。一方で,年齢による制限は設けられていない。すなわち,現在の基準では低リスク症例と一部の高リスク症例が対象となっている。アスピリン群は,プラセボ群と比較して非致死性心筋梗塞,非致死性脳梗塞,心血管死,肺塞栓および大静脈血栓をあわせたイベントの発症を有意に抑制した(RR 0.4,p=0.03)。出血合併症は両群で相違がなかった。また,前方視的コホート研究により抗血小板薬の使用は心血管イベント(RR 0.77)および死亡率(RR 0.72)を抑制することが示されている2)。この研究では,年齢・血栓既往の有無に関係なくすべてのPV症例が含まれている。この2つの臨床試験より,PV症例では年齢や血栓既往に関係なく,アスピリンを用いることが推奨される。
ETでは抗血小板療法の血栓抑制効果については,後方視的観察研究のみ報告がある。低リスクET症例を対象とした解析では,抗血小板療法はJAK2V617F変異陽性例における静脈血栓リスク,心血管リスクを有する症例における動脈血栓リスクを低下することが確認された3)。一方,血小板数が100万/μLを超える症例では,抗血小板療法により出血リスクが上昇した。ドライバー変異に基づいて低リスクET症例を層別化して解析した後方視的観察研究も報告されている4)。CALR変異陽性例では,抗血小板療法により血栓リスクは低下せず逆に出血リスクが上昇した。一方,JAK2V617F変異陽性症例ではアスピリンにより静脈血栓リスクが低下した4)。以上より,低リスクETにおいては一律のアスピリン投与は推奨されず,ドライバー変異のタイプ,心血管リスクの有無および血小板数に基づいて可否を判断すべきである。血栓症の既往がない高リスクET症例(60歳以上,高度の血小板増加等)を対象に,細胞減少療法に抗血小板療法を加える意義についても後方視的観察研究が行われている5)。その結果,60歳以上の症例では抗血小板療法を追加することにより,血栓リスクが低下した(incidence RR 0.2,p=0.02)5)。さらに,血栓既往のあるPVおよびET症例の血栓再発についての後方視的観察研究では,細胞減少療法に加えて抗凝固療法あるいは抗血小板療法を併用することにより,それぞれ静脈血栓,動脈血栓の抑制に有効であることが確認されている6)。これらの結果より,高リスクET症例では細胞減少療法に加えて抗血小板療法を併用することが推奨される。
PMF症例,特にpre-PMF症例ではET症例と同程度の血栓リスクがあることが報告されている7)。また,pre-PMF症例はET症例と比較し,出血を合併しやすいことも指摘されている8)。しかしながら,PMF症例に対してアスピリンが血栓リスクを軽減するかについて検証した臨床研究は報告されていない。エキスパートオピニオンとして,60歳以上,心血管リスク因子,JAK2V617F変異陽性もしくは白血球数増加を伴う場合に考慮することが示されている9)。また,血栓症の既往がある症例についても,アスピリンもしくは抗凝固療法を行うことが提示されている。
なお,血小板数の著増(一般的には血小板数>100万/μL)に伴いvon Willebrand因子(vWF)が低下すると,後天性von Willebrand syndrome(AvWS)を発症することがある10)。この場合のアスピリンの単独投与は出血を助長する可能性があるため,vWF:RCo(ristocetin cofactor activity)が低下している例では,細胞減少療法後に血小板数が減少していることを確認してからアスピリン投与を行う。加えて,血小板数<100万/μLでもvWFが低下する例もみられるため,出血傾向を示す場合は血小板数にかかわらずvWF:RCoを測定することが望ましい。
参考文献
1) Landolfi R, et al. Efficacy and safety of low-dose aspirin in polycythemia vera. N Engl J Med. 2004; 350(2): 114-24.(1iDi)
2) Marchioli R, et al. Vascular and neoplastic risk in a large cohort of patients with polycythemia vera. J Clin Oncol. 2005; 23(10): 2224-32.(3iiC/2Di)
3) Alvarez-Larrán A, et al. Observation versus antiplatelet therapy as primary prophylaxis for thrombosis in low-risk essential thrombocythemia. Blood. 2010; 116(8): 1205-10.(3iiC)
4) Alvarez-Larrán A, et al. Antiplatelet therapy versus observation in low-risk essential thrombocythemia with a CALR mutation. Haematologica. 2016; 101(8): 926-31.(3iiC)
5) Alvarez-Larrán A, et al. Cytoreduction plus low-dose aspirin versus cytoreduction alone as primary prophylaxis of thrombosis in patients with high-risk essential thrombocythaemia: an observational study. Br J Haematol. 2013; 161(6): 865-71.(3iiC)
6) De Stefano V, et al. Recurrent thrombosis in patients with polycythemia vera and essential thrombocythemia: incidence, risk factors, and effect of treatments. Haematologica. 2008; 93(3): 372-80.(3iiC)
7) Barbui T, et al. Survival and disease progression in essential thrombocythemia are significantly influenced by accurate morphologic diagnosis: an international study. J Clin Oncol. 2011; 29(23): 3179-84.(3iiC)
8) Finazzi G, et al. Incidence and risk factors for bleeding in 1104 patients with essential thrombocythemia or prefibrotic myelofibrosis diagnosed according to the 2008 WHO criteria. Leukemia. 2012; 26(4): 716-9.(3iiC)
9) Finazzi G, et al. Prefibrotic myelofibrosis: treatment algorithm 2018. Blood Cancer J. 2018; 8(11): 104.(レビュー).
10)Rottenstreich A, et al. Factors related to the development of acquired von Willebrand syndrome in patients with essential thrombocythemia and polycythemia vera. Eur J Intern Med. 2017; 41: 49-54.(3iiC)
CQ10 低リスクPV/ETに対して細胞減少療法は勧められるか
- 推奨グレード
- PV:カテゴリー3,ET:カテゴリー4
低リスクPV/ET症例に対して,血栓リスクを低下させる目的で殺細胞薬を用いた細胞減少療法を行うことは一般的には推奨されない。
- 推奨グレード
- PV:カテゴリー2A,ET:カテゴリー3
ただし、瀉血継続が困難な場合(PVのみ),著明な血小板数や白血球数の上昇,脾腫の増大を認める場合は,細胞減少療法を考慮してもよい。
解説
低リスクPV症例に対しての細胞減少療法については,ELNおよびNCCNのガイドラインでも全例には必要ないと判断されている1,2)。一方,瀉血療法が頻回に必要となる場合や瀉血療法に不耐容な症例,全身症候が強い場合や進行性の脾腫を伴う場合、著明な血小板あるいは白血球増加を伴う場合には、細胞減少療法を考慮することが記載されている1,2)。
低リスクPV症例を対象とした細胞減少療法についての臨床試験としては,ロペグインターフェロン-α2b(ropeg-IFN-α)を用いたランダム化前方視的試験(Low-PV試験)がある(本邦の承認用量と異なり、100μg/日の投与が行われている)3,4)。この臨床試験では,低リスクPV症例を瀉血のみの群とropeg-IFN-α投与群にランダムに割り付けられた。主要評価項目は観察期間(12カ月)において,病勢の進行なくHt<45%を維持できた症例の比率とされた。主要評価項目の達成率は、中間解析では瀉血群60%、ropeg-IFN-α群84%(オッズ比3.5),最終解析ではそれぞれ51%、81%(オッズ比4.20)であった。病勢進行は,瀉血群に8例(血小板増加6例,一過性脳虚血発作1例,脾静脈血栓症1例)認められた。主要評価項目を達成した症例を対象とした24カ月時点での評価では,ropeg-IFN-α群の方が触知可能な脾腫の割合(14%vs.37%)や中等症以上の全身症候を示す症例の割合(33%vs.67%)が低かった3,4)。また,これとは異なる低リスクPV症例の後方視的な報告では,全生存率は3群間に差を認めていないものの,瀉血のみの群,ヒドロキシウレア(HU)治療群に比べ,インターフェロン-α群(本邦の適応なし)では骨髄線維症への移行リスクが低かった5)。これより,低リスクPV症例に対し細胞減少療法を行う場合には,ropeg-IFN-αが考慮される1,2)。
ETについては、40~59歳で,治療を要する高血圧や糖尿病の併発がなく,また著明な血小板増加(150万/μL以上)を伴わない低リスクET症例を対象として,アスピリン単独群とアスピリンとHUの併用群にランダムに割り付けた前方視的臨床試験が行われている6)。動静脈血栓,出血および心血管要因による死亡の発症が主要評価項目と定められた。観察期間中央値は73カ月であった。両群での主要評価項目についてのハザード比は0.98であり差を認めなかった。これより,この条件に該当するET症例では,HU治療は行うべきではないと結論付けている6)。また、著明な血小板増加を伴う低リスクET症例を対象としたMayoクリニックの後方視的解析では,細胞減少療法の有無は無血栓生存率に影響しないとの結果であった7)。
参考文献
1)Marchetti M et al. Appropriate management of polycythaemia vera with cytoreductive drug therapy: European LeukemiaNet 2021 recommendations. Lancet Haematol. 2022 9 e301 (レビュー)
2)NCCN Clinical practice Guidelines in Oncology. Myeloproliferative Neoplasms Version1.2024(レビュー)
3)Barbui T, et al. Ropeginterferon alfa-2b versus phlebotomy in low-risk patients with polycythaemia vera (Low-PV study): a multicentre, randomised phase 2 trial. Lancet Haematol. 2021; 8(3): e175-84.(1iiC)
4)Barbui T, et al. Ropeginterferon versus Standard Therapy for Low-Risk Patients with Polycythemia Vera. NEJM Evid. 2023 Jun;2(6): (1iiC)
5)Abu-Zeinah G et al. Interferon-alpha for treating polycythemia vera yields improved myelofibrosis-free and overall survival. Leukemia. 2021 ,35(9):2592-2601.(3iiD)
6)Godfrey AL, et al. Hydroxycarbamide Plus Aspirin Versus Aspirin Alone in Patients With Essential Thrombocythemia Age 40 to 59 Years Without High-Risk Features. J Clin Oncol. 2018; 36(34): 3361-9.(1iiC)
7)Tefferi A, et al. Extreme thrombocytosis in low-risk essential thrombocythemia: Retrospective review of vascular events and treatment strategies. Am J Hematol. 2021; 96(6): E182-4.(3iiiC)
CQ11 PVの治療目標としてHt値45%を勧められるか
- 推奨グレード
- カテゴリー1
Ht値のコントロール目標値として45%未満を目指す。
解説
PVにおけるHt値と血栓発症率との関連については,1978年に最初の発表が行われ,Ht値を45%未満に保つことにより血栓の発症頻度が低下することが示された1)。この研究は比較的少数例(69例)を対象とした後方視的観察研究であるが,マイルストーン的に扱われ,その後のPV診療に大きな影響を与えてきた。Ht値を45%未満に保つことの妥当性については,その後いくつかの後方視的コホート研究により検証が試みられたが支持する結果は得られなかった2,3)。これに対して,2013年に,PV症例をHt値45%未満に維持する群と45~50%を目標とする群にランダムに割り付けた前方視的臨床試験(CYTO-PV試験)にて検証がなされている4)。主要評価項目は心血管系障害による死亡,あるいは梗塞性疾患(脳梗塞,急性冠動脈症候群,一過性の虚血発作,肺塞栓,内臓血栓症,深部静脈血栓症,末梢動脈血栓症)までの期間とされた。365例が登録され,観察期間中央値は31カ月であった。Ht値を45%未満とした群と比較し,Ht値を45~50%とした群の主要評価項目到達のハザード比は3.91(p=0.004)と有意に高い結果であった。この試験の結果に基づき,PV治療におけるHt値の目標は45%未満に保つことが推奨されている。
参考文献
1) Pearson TC, Wetherley-Mein G. Vascular occlusive episodes and venous haematocrit in primary proliferative polycythaemia. Lancet. 1978; 2(8102): 1219-22.(3iiiC)
2) Di Nisio M, et al. The haematocrit and platelet target in polycythemia vera. Br J Haematol. 2007; 136(2): 249-59.(3iC)
3) Crisà E, et al. A retrospective study on 226 polycythemia vera patients: impact of median hematocrit value on clinical outcomes and survival improvement with anti-thrombotic prophylaxis and non-alkylating drugs. Ann Hematol. 2010; 89(7): 691-9.(3iiA)
4) Marchioli R, et al. Cardiovascular events and intensity of treatment in polycythemia vera. N Engl J Med. 2013; 368(1): 22-33.(1iiB)
CQ12 ETの治療目標として血小板数40万/μLを勧められるか
- 推奨グレード
- カテゴリー2B
血小板数の治療目標値は明確ではない。臨床試験では40万~60万/μLを目標にされることが多いが,40万/μL未満に設定する根拠は乏しい。
解説
ELNは,ETの治療効果基準の一つとして血小板数を40万/μLを下回ることをCRおよびPRの要件として提示している1)。しかしながら,この基準はあくまでも臨床試験における効果判定の基準として用いるべきであり,実臨床への応用は想定していないことが明記されている。ETにおいて,血小板数が血栓リスクと関連するかについては,主に細胞減少療法症例の後方視的研究の結果に基づいて解析されている。ブスルファン(BU)で治療を受けているET症例をもとにした解析では,血小板数が60万/μL未満に維持されている期間が全体の70%を超えている症例は血栓発症頻度が有意に低い結果であった2)。また,アナグレリド(ANA)で長期に治療されている35例についての解析では,7件の血栓イベントはすべて血小板数が40万/μL以上の時点で発生していた3)。ANAで治療が行われたET症例については,後方視的解析にて血小板数が57.4万/μLを上回る場合,血栓合併のハザード比が上昇することが報告されている4)。これに対して,657例のET症例を対象としたイタリアでの解析では,血小板数は血栓のリスク因子とは確認できなかった5)。同様にヒドロキシウレア(HU)とANAの血栓抑制効果を比較したPT-1試験の登録症例についての解析でも,血小板数と血栓リスクとの相関は確認できていない6)。さらに,ANAで治療を行ったET症例について,ELNクライテリアのCRを満たした症例と満たさなかった症例では,血栓・出血の合併率に相違がないことが報告されている7)。以上より,通常診療において血小板数の目標値は40~60万/μLに設定されることが多いものの,40万/μL未満に設定する根拠は乏しいと考えられる。
参考文献
1) Barosi G, et al. Revised response criteria for polycythemia vera and essential thrombocythemia: an ELN and IWG-MRT consensus project. Blood. 2013; 121(23): 4778-81.(レビュー)
2) Cortelazzo S, et al. Incidence and risk factors for thrombotic complications in a historical cohort of 100 patients with essential thrombocythemia. J Clin Oncol. 1990; 8(3): 556-62.(3iiiDi)
3) Storen EC, et al. Long-term use of anagrelide in young patients with essential thrombocythemia. Blood. 2001; 97(4): 863-6.(3iiiDi)
4) Buxhofer-Ausch V, et al. Influence of platelet and white blood cell counts on major thrombosis - analysis from a patient registry in essential thrombocythemia. Eur J Haematol. 2016; 97(6): 511-6.(3iiiDi)
5) Carobbio A, et al. Leukocytosis and risk stratification assessment in essential thrombocythemia. J Clin Oncol. 2008; 26(16): 2732-6.(3iiiDi)
6) Campbell PJ, et al. Correlation of blood counts with vascular complications in essential thrombocythemia: analysis of the prospective PT1 cohort. Blood. 2012; 120(7): 1409-11.(3iiiDi)
7) Hernández-Boluda JC, et al. Clinical evaluation of the European LeukemiaNet response criteria in patients with essential thrombocythemia treated with anagrelide. Ann Hematol. 2013; 92(6): 771-5.(3iiiDi)
CQ13 高リスクPVに対する細胞減少療法としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
細胞減少療法の第一選択薬はヒドロキシウレア,ロペグインターフェロン-α2bである。
- 推奨グレード
- カテゴリー1
ヒドロキシウレア不耐容,あるいは抵抗性の場合は,ルキソリチニブ治療が推奨される。
解説
新規に瀉血療法とヒドロキシウレア(HU)の併用が行われた51例のPV治療成績と,過去に瀉血療法のみが行われたhistorical control 134例を比較した報告では,治療開始から795週間における血栓症の発症率は,HU+瀉血群9.8%,瀉血群32.8%であり,PVの治療にHUを併用すると血栓症が減少する1)。その後報告された,瀉血療法のみを受けたPV患者と,HU治療のみを受けたPV患者の背景を一致させた後方視的検討では,血管イベントは100人・年あたり瀉血群で5.8人,HU群で3人,病型移行は瀉血群で1.11人,HU群で0.05人,死亡率は瀉血群で0.32人,HU群で0.11人と,いずれもHU群で少なかった2)。死亡や血管イベントの発症は低リスク群では少なく,HUによるこれらのイベントの減少は,高リスク群で有意にみられており,高リスクPV治療におけるHUの有用性を示している。Ht値<45%達成率もHU群で多く認められ,高リスク群ではHU使用が推奨される。
細胞減少療法が必要な、あるいはHU治療を開始して3年以内のPVを対象に,長時間作用型のインターフェロンであるロペグインターフェロン-α2b(ropeg-IFN-α)とHUを比較する前方視的ランダム化比較試験と,その延長試験の結果が報告されている3)。複合プライマリーエンドポイントである12カ月時点での脾腫を認めない血液学的完全奏効は,ropeg-IFN-α群21%,HU群28%であり,ropeg-IFN-αのHUに対する非劣性は示されなかった。しかし,その後の延長試験では,36カ月時点での脾腫を認めない血液学的完全奏効は,ropeg-IFN-α群71%,HU群51%とropeg-IFN-α群で優れていたこと,JAK2 V617F allele burdenの中央値が,HU群では開始前38.1%,60カ月後44.4%と減少がみられていないのに対し,ropeg-IFN-α群では開始前37.3%,60カ月時点では8.5%と減少していることが示された4)。さらに,6年時点での観察では,無イベント(血栓性合併症、病型移行および死亡)生存は,ropeg-IFN-αが優れていた(ハザード比 0.34,p=0.04)5)。以上を勘案すると,ropeg-IFN-αも高リスクPVに対する第一選択薬と考えられる。
HU不耐容,抵抗例はルキソリチニブ(RUX)への変更が勧められる。HU不耐容,抵抗性の脾腫があるPVを対象に,RUXとbest available treatment(BAT)を比較する前方視的ランダム化比較試験では,Ht値<45%はRUX群60%,BAT群19.6%に,脾腫の35%以上の減少はRUX群38.2%,BAT群0.9%にみられた6)。RUX治療が有効であった75%の例では,5年後も治療効果が継続していた7)。治療開始後80週の解析では,100人・年あたり,RUX群では1.8件,BATからRUXにクロスオーバーした群では4.1件の血栓イベントがみられており(クロスオーバーがないと仮定した場合8.2件),HU不耐容,抵抗例では,早期にRUXへ治療変更するほうが血栓症のリスクを減らせることを示している8)。脾腫がないHU治療不耐容,抵抗性のPVにおいても,RUX群では62%にHt値のコントールがみられており,BAT群の19%に比べ優れていた9)。
HU抵抗性・不耐容PVを対象としたペグ化インターフェロン-α-2a(Pegasys,本邦での保険適応なし)の第Ⅱ相試験の結果によると,12カ月時点での総奏効率60%(完全奏効38%,部分奏効22%)である10)。HU抵抗性・不耐容PVを対象としたropeg-IFN-αの臨床試験は行われていないものの,両者ともにペグ化されたIFNであることを考えると,ropeg-IFN-αもHU抵抗性・不耐容PVに対する治療選択肢のひとつと考えられる。
HU抵抗性・不耐容PV15例およびET21例の後方視的検討では,ブスルファン(BU)もHU不耐容,抵抗例の血液学的寛解に有用であることが報告されているが,AML/MDSへの移行が3例(PVは1例)にみられている11)。高リスクETに対するHUの血栓症予防効果を前方視的に検討した報告の,その後の前方視的観察研究では,BU投与後にHUを使用された例では二次がんのリスクが高くなっていること,スウェーデンのレジストリ研究では,2または3種類の細胞減少療法を受けると,MPNからAML/MDSの発症リスクが2.9倍になることが報告されており,HU使用後のBUの投与には慎重な対応が必要と考えられる12,13)。
参考文献
1)Fruchtman SM, et al. From efficacy to safety: a Polycythemia Vera Study group report on hydroxyurea in patients with polycythemia vera. Semin Hematol. 1997; 34(1): 17-23.(3iiiC)
2)Barbui T, et al. A reappraisal of the benefit-risk profile of hydroxyurea in polycythemia vera: A propensity-matched study. Am J Hematol. 2017; 92(11): 1131-6.(3iiiC)
3)Gisslinger H, et al. Ropeginterferon alfa-2b versus standard therapy for polycythaemia vera (PROUD-PV and CONTINUATION-PV): a randomised, non-inferiority, phase 3 trial and its extension study. Lancet Haematol. 2020; 7(3): e196-208.(1iiDiv)
4)Kiladjian JJ, et al. Long-term outcomes of polycythemia vera patients treated with ropeginterferon Alfa-2b. Leukemia. 2022;36(5):1408-1411 (1iiDiv)
5) Gisslinger H et al. PROUD-PV Study Group. Event-free survival in patients with polycythemia vera treated with ropeginterferon alfa-2b versus best available treatment. Leukemia. 2023 37:2129-2132. (1iiDi)
6)Vannucchi AM, et al. Ruxolitinib versus standard therapy for the treatment of polycythemia vera. N Engl J Med. 2015; 372(5): 426-35.(1iiDiv)
7)Kiladjian JJ. Long-term efficacy and safety of ruxolitinib in polycythaemia vera - Authors’ reply. Lancet Haematol. 2020; 7(7): e506.(1iiDiv)
8)Verstovsek S, et al. Ruxolitinib versus best available therapy in patients with polycythemia vera: 80-week follow up from the RESPONSE trial. Haematologica. 2016; 101(7): 821-9.(1iiDiv)
9)Passamonti F, et al. Ruxolitinib for the treatment of inadequately controlled polycythaemia vera without splenomegaly (RESPONSE-2): a randomised, open-label, phase 3b study. Lancet Oncol. 2017; 18(1): 88-99.(1iiDiv)
10)Yacoub A, et al. Pegylated interferon alfa-2a for polycythemia vera or essential thrombocythemia resistant or intolerant to hydroxyurea. Blood. 2019; 134(18): 1498-509.(3iiiDiv)
11)Alvarez-Larrán A, et al. Busulfan in patients with polycythemia vera or essential thrombocythemia refractory or intolerant to hydroxyurea. Ann Hematol. 2014; 93(12): 2037-43.(3iiiDiv)
12)Finazzi G, et al. Second malignancies in patients with essential thrombocythaemia treated with busulphan and hydroxyurea: long-term follow-up of a randomized clinical trial. Br J Haematol. 2000; 110(3): 577-83.(3iiiC)
13)Björkholm M, et al. Treatment-related risk factors for transformation to acute myeloid leukemia and myelodysplastic syndromes in myeloproliferative neoplasms. J Clin Oncol. 2011; 29(17): 2410-5.(3iC)
CQ14 高リスクETに対する細胞減少療法としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
動静脈血栓症や重篤な出血などを予防することを目的に,ヒドロキシウレアおよびアナグレリドが勧められる。
解説
ET高リスク群では血栓症予防を目的として,細胞減少療法と抗血小板療法を行う。細胞減少療法薬には,ヒドロキシウレア(HU)とアナグレリド(ANA)がある。このうちHUはもっとも頻用される細胞減少療法薬であり,経過観察とのランダム化比較試験では,観察期間27カ月の血栓症の発症はHU群3.6%,経過観察群24%と,HU投与により有意に血栓症の発症が減少している1)。ET高リスク群において,細胞減少療法薬のHUとANAを直接比較した2つのランダム化比較試験が報告されている。PVSG診断基準により診断されたETで,かつ82%が既治療例である809例を対象とした試験では,ANA+低用量アスピリンは,HU+低用量アスピリンより静脈血栓症のリスクは低いが,心房血栓,重篤な出血,骨髄線維症への進展頻度が高く,EFSは劣るという結論であった2)。一方,WHO分類(2008)により診断されたETで,かつ前治療歴がない初回治療253例を対象とした試験(この試験では原則単剤療法であり,アスピリンの併用は28~29%の例に行われている)では,ANAはHUと比べ血栓症や出血の頻度に差がなく,またEFSにも有意差を認めないという結果であった3)。3,611例の高リスクETを対象とした前方視的観察試験の結果は,年齢中央値がANA群(804例)で56歳,他の細胞減少療法薬群(2,807例,このうちHU治療は2,341例になされている)で70歳と異なっていることに留意が必要であるが,100人・年あたりの血栓症ANA群1.62件,他の細胞減少療法群2.06件とANA群で少なかった4)。一方,主要出血イベントはANA群0.89件,他の細胞減少療法薬群0.43件と,ANA群で多いという結果であった。他の細胞減少療法群の80%以上がHU治療を受けていることを考えると,上記の前方視的ランダム化比較試験の結果とあわせて,ANA,HUいずれも高リスクET細胞減少療法の初回治療薬として推奨される。
本邦では保険適用ではないが,IFN-αの高リスクETに対する有用性が報告されている。高リスクET 123例を対象にした単一群試験では,全血液学的奏効が90例にみられている5)。長時間作用型IFNであるpeg-IFN-α 2bの有効性も報告されており,36例の高リスクETを対象とした単一群試験では,12カ月時点で67%に血小板数のコントロールがみられている6)。
参考文献
1) Cortelazzo S, et al. Hydroxyurea for patients with essential thrombocythemia and a high risk of thrombosis. N Engl J Med. 1995; 332(17): 1132-6.(1iiDi)
2) Harrison CN, et al. Hydroxyurea compared with anagrelide in high-risk essential thrombocythemia. N Engl J Med. 2005; 353(1): 33-45.(1iiDi)
3) Gisslinger H, et al. Anagrelide compared with hydroxyurea in WHO-classified essential thrombocythemia: the ANAHYDRET Study, a randomized controlled trial. Blood. 2013; 121(10): 1720-8.(1iiDi)
4) Birgegård G, et al. Treatment of essential thrombocythemia in Europe: a prospective long-term observational study of 3649 high-risk patients in the Evaluation of Anagrelide Efficacy and Long-term Safety study. Haematologica. 2018; 103(1): 51-60.(3iiiC)
5) Huang BT, et al. Interferonα-2b gains high sustained response therapy for advanced essential thrombocythemia and polycythemia vera with JAK2V617F positive mutation. Leuk Res. 2014; 38(10): 1177-83.(ET : 3iiiDiv,PV : 1iiDiv)
6) Langer C, et al: Pegylated interferon for the treatment of high risk essential thrombocythemia: results of a phase II study. Haematologica. 2005; 90(10): 1333-8.(3iiiDiv)
CQ15 妊娠合併ET/PVに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
低用量アスピリンによる治療介入を推奨する。ハイリスク妊娠の場合は,低分子量ヘパリン(保険適用外)の併用を検討する。
解説
22研究,762MPN合併妊婦,1,210妊娠のメタアナリシスでは,生産率(Live Birth)は71.3%である。この報告には159例のPV合併妊娠,815例のET合併妊娠が含まれており,生産率はそれぞれ66.7%,71.1%であった1)。流産の59.1%は第一trimesterに生じていた。これとは別のET合併妊娠のメタアナリシス(21研究,504妊婦,756妊娠)もほぼ同様の結果であり,生産率は74%,流産の73%は第一trimesterに生じていた2)。つまり,妊娠合併PV/ETでは妊娠早期の流産が多い。
上述の妊娠合併MPNのシステマティックレビューでは227例にアスピリンが,90例にIFN-αが使用されており,使用によりそれぞれオッズ比が8.6,9.7と,生産率の改善を認めている1)。アスピリンに加えてヘパリンを併用しても生産率の改善は認めていない。ETを対象としたメタアナリシスでは母体の血栓症,出血に関する検討が行われている2)。低分子量ヘパリンが使用された82妊娠では1例も生じていなかったのに対し,使用されていない407妊娠中8例(2.5%)に出現している。ヘパリンは使用されずアスピリンのみが使用された212妊娠では分娩前静脈血栓塞栓は6イベント(4.2%)生じており,ヘパリンとアスピリンが併用された71妊娠では1例も生じていない。分娩後は,低分子量ヘパリンが投与された96妊娠では静脈血栓塞栓症を認めなかったのに対し,投与されなかった229妊娠においては6例の静脈血栓塞栓症を認めた(4.4%)。出血イベントは,分娩前には低分子量ヘパリンが使用された82例では0%,使用されていない407妊娠では4.0%,分娩後には使用の有無にかかわらずともに2.9%認めている。
治療介入の有無によるランダム化比較試験の報告はないものの,妊娠合併ET/PVに対して血管血栓イベントの予防,流産の予防を期待して,妊娠中および分娩後6週間,少量アスピリン投与が勧められる。アスピリンは分娩1~2週間前に一時中止するか,あるいは低分子量ヘパリン(保険適用外)へ変更する。低分子量ヘパリンは,分娩12~24時間前に中止する。分娩時の麻酔に際し,いつアスピリンを中止すべきかを含めて,産科医との密接な連携が重要である。これとならび,PVの場合はHt値<45%に維持する。
血栓症,出血の既往,以前の妊娠におけるMPNが原因と考えらえる流産,胎児発達遅滞,死産,胎盤機能不全,重篤な子癇,血小板数が持続して150万/μL以上の場合はハイリスク妊娠と考えられている。ハイリスク妊娠で主要血栓症の既往,あるいは以前に妊娠に伴う重篤な合併症がある場合は,アスピリンに加え低分子ヘパリンの併用(出血がある場合はアスピリンを中止する)が勧められる。血小板数が150万/μL超の場合はIFN-α(保険適用外)を用い減少をはかる。特にJAK2V617F変異は流産をきたす独立した予後不良因子であり,IFN-αで血小板数を減らすことにより合併症を回避できる可能性が指摘されている3)。また,以前に主要な出血イベントを生じている場合は,アスピリンに代えて血小板数増加に対しIFN-αの使用を考慮する。細胞減少療法薬はIFN-αが望ましく,ヒドロキシウレア(HU)は妊娠中は禁忌,授乳中に投与する場合は,授乳を中止させる。
本邦から,妊娠ET患者にアスピリンとIFN-αを投与した9例10妊娠のケースシリーズが報告されており,全例で健児が得られている4)。
参考文献
1) Maze D, et al. Association of Treatments for Myeloproliferative Neoplasms During Pregnancy With Birth Rates and Maternal Outcomes: A Systematic Review and Meta-analysis. JAMA Netw Open. 2019; 2(10): e1912666.(レビュー)
2) Skeith L, et al. Risk of venous thromboembolism in pregnant women with essential thrombocythemia: a systematic review and meta-analysis. Blood. 2017; 129(8): 934-9.(レビュー)
3) Melillo L, et al. Outcome of 122 pregnancies in essential thrombocythemia patients: A report from the Italian registry. Am J Hematol. 2009; 84(10): 636-40.(3iC)
4) Edahiro Y, et al. Interferon therapy for pregnant patients with essential thrombocythemia in Japan. Int J Hematol. 2021; 113(1): 106-11.(3iiiC)
CQ16 骨髄線維症(PMF, post PV/post ET-MF)に対してどのようなリスク分類が勧められるか
- 推奨グレード
- カテゴリー2A
PMFのリスク分類は,IPSS, DIPSS, DIPSS plusを推奨する。
- 推奨グレード
- カテゴリー2B
post PV/post ET-MFのリスク分類は,MYSEC-PMを推奨する。
解説
PMFの予後予測モデルには,臨床情報に基づく3種類の国際的予後分類(International Prognostic Scoring System:IPSS)1-3),染色体異常と遺伝子変異情報に基づくGenetically Inspired Prognostic Scoring System for Primary Myelofibrosis(GIPSS)4),70歳以下の移植適応年齢を対象とした臨床情報と遺伝子変異情報を統合したMutation-enhanced International Prognostic Score System for transplantation-age patients with primary myelofibrosis(MIPSS70)5),およびそれに新たな染色体異常,遺伝子変異,性別によるHbの閾値設定を加味したMIPSS70-ver2.0などがある6)。日常診療では,PMFのhigh molecular riskであるASXL1,SRSF2,EZH2,IDH1,IDH2変異,あるいはU2AF1変異の測定が困難であることを考えると,現実に使用可能なモデルは臨床情報に基づくものとなる。年齢>65歳,体重減少・夜間盗汗・発熱などの臨床症状,Hb<10g/dL,診断時WBC>25,000/μL,末梢血液中の芽球割合≧1%の5つを予後因子とするIPSS1),前述の5因子に異なった重み付けをしたDynamic IPSS(DIPSS)7),DIPSSに染色体異常,血小板数,輸血依存性を付加したDIPSS plus3)である。スコアの合計により,低リスク,中間-Ⅰリスク,中間-Ⅱリスク,高リスクの4つのリスクグループに分類する。これらのモデルを本邦のPMFに適応した場合,IPSS,DIPSSではInt-2と高リスク群の区別が不良であるが,DIPSS plusモデルでは分離可能であった8)。低リスク/中間-Ⅰリスクと,中間-Ⅱリスク/高リスクに大きく2分して治療方針を考える現在の治療指針においては,いずれの分類も治療法選択に用いることが可能であるが,より精緻な予後予測という観点からはDIPSS plusが本邦の患者に適したモデルである。
PMFとpost-PV/ET-MFは,生じている遺伝子変異や症状が類似していることから,同様の治療方針で臨まれている。PMFを対象に開発されたIPSS,DIPSS,DIPSS plusがpost-PV/ET-MFにも適応できるかを検討した3つの報告では,2報が困難である,1報が適応できる,との相反する結果であった9-11)。post-PV/ET-MFを対象に開発されたMyelofibrosis Secondary to PV and ET Prognostic Model(MYSEC-PM)は,年齢,Hb<11g/dL,末梢血芽球≧3%,血小板<15万/μL,持続する全身症状,CALR変異がないこと,の6つの独立した予後不良因子のスコアで4群に層別化するものであり,IPSSと比較しpost-PV/ET-MFの予後予測において優れていた12)。別コホートにおいてもMYSEC-PMはPET/PPV-MFの予後をIPSSより良好に層別化可能であった13)。治療法が変わると予後モデルの適応が変わる可能性がある。MYSEC-PMは,ルキソリチニブ(RUX)治療を受けたpost-PV/ET-MFの予後予測にも有用である14)。
参考文献
1) Cervantes F, et al. New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibrosis Research and Treatment. Blood. 2009; 113(13): 2895-901.(3iiA)
2) Passamonti F, et al. Dynamic International Prognostic Scoring System(DIPSS)predicts progression to acute myeloid leukemia in primary myelofibrosis. Blood. 2010; 116(15): 2857-8.(3iiA)
3) Gangat N, et al. DIPSS plus: a refined Dynamic International Prognostic Scoring System for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count, and transfusion status. J Clin Oncol. 2011; 29(4): 392-7.(3iiA)
4) Tefferi A, et al. GIPSS: genetically inspired prognostic scoring system for primary myelofibrosis. Leukemia. 2018; 32(7): 1631-42.(3iiA)
5) Guglielmelli P, et al. MIPSS70: Mutation-Enhanced International Prognostic Score System for Transplantation-Age Patients With Primary Myelofibrosis. J Clin Oncol. 2018; 36(4): 310-8.(3iiA)
6) Tefferi A, et al. MIPSS70+ Version 2.0: Mutation and Karyotype-Enhanced International Prognostic Scoring System for Primary Myelofibrosis. J Clin Oncol. 2018; 36(17): 1769-70.(3iiA)
7) Passamonti F, et al. A dynamic prognostic model to predict survival in primary myelofibrosis: a study by the IWG-MRT(International Working Group for Myeloproliferative Neoplasms Research and Treatment). Blood. 2010; 115(9): 1703-8.(3iiA)
8) Takenaka K, et al. Clinical features and outcomes of patients with primary myelofibrosis in Japan: report of a 17-year nationwide survey by the Idiopathic Disorders of Hematopoietic Organs Research Committee of Japan. Int J Hematol. 2017; 105(1): 59-69.(3iA)
9) Masarova L, et al. Patients with post-essential thrombocythemia and post-polycythemia vera differ from patients with primary myelofibrosis. Leuk Res. 2017; 59: 110-6.(3iiA)
10)Hernández-Boluda JC, et al. The International Prognostic Scoring System does not accurately discriminate different risk categories in patients with post-essential thrombocythemia and post-polycythemia vera myelofibrosis. Haematologica. 2014; 99(4): e55-7.(3iiA)
11)Tefferi A, et al. Application of current prognostic models for primary myelofibrosis in the setting of post-polycythemia vera or post-essential thrombocythemia myelofibrosis. Leukemia. 2017; 31(12): 2851-2.(3iiA)
12)Passamonti F, et al. A clinical-molecular prognostic model to predict survival in patients with post polycythemia vera and post essential thrombocythemia myelofibrosis. Leukemia. 2017; 31(12): 2726-31.(3iiA)
13)Hernández-Boluda JC, et al. Performance of the myelofibrosis secondary to PV and ET-prognostic model(MYSEC-PM)in a series of 262 patients from the Spanish registry of myelofibrosis. Leukemia. 2018; 32(2): 553-5.(3iiA)
14)Palandri F, et al. Differences in presenting features, outcome and prognostic models in patients with primary myelofibrosis and post-polycythemia vera and/or post-essential thrombocythemia myelofibrosis treated with ruxolitinib. New perspective of the MYSEC-PM in a large multicenter study. Semin Hematol. 2018; 55(4): 248-55.(3iiA)
CQ17 骨髄線維症(PMF, post PV/post ET-MF)に対してルキソリチニブの投与は勧められるか
(1)低リスクMF症例(2)高リスクMF症例(3)同種造血細胞移植適応症例における移植前
- 推奨グレード
- カテゴリー2A(低リスクMF症例),カテゴリー1(高リスクMF症例),カテゴリー2B(移植適応症例における移植前)
高リスクMFと低リスクMFで脾腫や全身症候を伴う場合にはルキソリチニブを推奨する。同種造血細胞移植適応患者については,移植時期を含めて投与を検討する。
解説
PMF,post PV/post ET-MFに対するJAK1/JAK2阻害薬ルキソリチニブ(RUX)は,中間-Ⅱリスク以上,脾腫5cm以上,血小板数10万/μL以上の症例を対象に,脾臓縮小率を主要評価項目とした2つの第Ⅲ相ランダム化比較試験において,プラセボもしくは既存治療に対して優位性を示した。全身症候についてもRUX群で有意な改善が認められた1,2)。さらに,長期観察の結果からは,RUXはOSの改善にも寄与することが示唆された3)。また,ERNEST試験による1,010例の観察研究の結果からも,RUXによる生存率の改善効果が示されている[生存期間中央値;RUX群6.7年vs. ヒドロキシウレア(HU)群5.1年]4)。なお,生存改善効果は,中間-Ⅱリスク以上の患者で認められていた。また,その後の臨床Ⅲb相拡大アクセス試験で,血小板数が5万~10万/μLの患者にも有効であることが示された5)。以上の結果から,中間-Ⅱリスク以上のMFに対する治療として,脾腫や全身症候を伴う場合にはRUXが勧められる。全身症候は,少量から奏効が認められるが,脾腫などの改善効果は,RUXの用量に依存することに注意する。
一方,RUXと同種造血細胞移植について,生存への優位性を直接比較した研究は発表されておらず,若年で合併症がなく適切なドナーが得られる場合には,同種造血細胞移植が推奨される。移植適応症例における移植前のRUX治療については,少数の単独非対照前方視的試験,後方視的解析の結果から,移植前の全身状態の改善は期待できるが,移植後予後の改善が得られるかどうかは明らかではない6-9)。RUX奏効例では移植後の予後を改善する可能性が示唆されている。投与に際しては,RUX中止後のリバウンドを避けるため,移植前治療まで徐々に減量するなどの注意が必要である。これまでの臨床試験では,RUXの継続率は,3年で50%程度であり,移植適応患者については,移植時期を含めて投与を検討する必要がある。
低リスクMFについても,中間-Ⅰリスクを含む臨床試験において,脾腫や全身症候を改善する効果がみられることが示された5,10,11)。低リスク群においても,脾腫や全身症候を有する場合は,RUXが勧められる。ただし,移植適応患者については,高リスクMFと同様に移植時期を含めて検討する必要がある。
最近本邦でも承認されたJAK1/JAK2/アクチビンA受容体1型阻害薬モメロチニブ(MMB)は,JAK阻害剤未投与の骨髄線維症を対象としたRUXとの前方視的ランダム化比較試験において,脾腫の35%以上の縮小は非劣性が,赤血球輸血非依存の割合は優位性が示されている12)。全身症状の改善割合は,RUXに対して非劣性が示されなかった。また,貧血を有する中間または高リスクの成人の骨髄線維症に対して,ダナゾール(MFに対しては国内未承認)と比較して脾容積および全身症状を改善することも第Ⅲ相試験で示されている13)。MMBは骨髄線維症の治療選択肢の一つであるが、その位置づけについては今後の検討課題である。
参考文献
1)Verstovsek S, et al. A double-blind, placebo-controlled trial of ruxolitinib for myelofibrosis. N Engl J Med. 2012; 366(9): 799-807.(1iC)
2)Harrison C, et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis. N Engl J Med. 2012; 366(9): 787-98.(1iC)
3)Vannucchi AM, et al. A pooled analysis of overall survival in COMFORT-I and COMFORT-II, 2 randomized phase III trials of ruxolitinib for the treatment of myelofibrosis. Haematologica. 2015; 100(9): 1139-45.(1iA)
4)Guglielmelli P, et al. Impact of ruxolitinib on survival of patients with myelofibrosis in the real world: update of the ERNEST Study. Blood Adv. 2022; 6(2): 373-5.(3iiiA)
5)Al-Ali HK et al. Primary analysis of JUMP, a phase 3b, expanded-access study evaluating the safety and efficacy of ruxolitinib in patients with myelofibrosis, including those with low platelet counts. Br J Haematol. 2020; 189(5): 888-903.(3iiiC)
6)Kröger N, et al. Impact of prior JAK-inhibitor therapy with ruxolitinib on outcome after allogeneic hematopoietic stem cell transplantation for myelofibrosis: a study of the CMWP of EBMT. Leukemia. 2021; 35(12): 3551-60.(3iiiC)
7)Robin M, et al. Ruxolitinib before allogeneic hematopoietic transplantation in patients with myelofibrosis on behalf SFGM-TC and FIM groups. Bone Marrow Transplant. 2021; 56(8): 1888-99.(2Dii)
8)Shanavas M, et al. Outcomes of Allogeneic Hematopoietic Cell Transplantation in Patients with Myelofibrosis with Prior Exposure to Janus Kinase 1/2 Inhibitors. Biol Blood Marrow Transplant. 2016; 22(3): 432-40.(3iiiA)
9)Salit RB, et al. Pre-hematopoietic cell transplant Ruxolitinib in patients with primary and secondary myelofibrosis. Bone Marrow Transplant. 2020; 55(1): 70-6.(3iiiA)
10)Mead AJ, et al. Response to ruxolitinib in patients with intermediate-1-, intermediate-2-, and high-risk myelofibrosis: results of the UK ROBUST Trial. Br J Haematol. 2015; 170(1): 29-39.(3iiiC)
11)Kirito K, et al. Evaluation of the dose and efficacy of ruxolitinib in Japanese patients with myelofibrosis. Int J Hematol. 2018; 107(1): 92-7.(3iiiC)
12)Mesa RA, et al. SIMPLIFY-1: A Phase III Randomized Trial of Momelotinib Versus Ruxolitinib in Janus Kinase Inhibitor-Naïve Patients With Myelofibrosis. J Clin Oncol. 2017 35(34):3844-3850(1iDiv)
13)Verstovsek, S, et al. Momelotinib versus danazol in symptomatic patients with anaemia and myelofibrosis (MOMENTUM): results from an international, double-blind, randomised, controlled, phase 3 study. Lancet 2023;401:269-280.(1iC)
CQ18 骨髄線維症(PMF,post PV/post ET-MF)に対して同種造血細胞移植は勧められるか
- 推奨グレード
- カテゴリー2B
中間-Ⅱリスク以上の若年者で,合併症がなく適切なドナーが得られる場合は,同種造血細胞移植を推奨する。
解説
現時点では,骨髄線維症(PMF,post PV/post ET-MF)を根治させ得る治療は同種造血細胞移植のみである。骨髄の線維化が著明であるにもかかわらず,移植した造血幹細胞は生着可能で,骨髄の線維化も生着に伴って半数以上の症例で消失がみられる。MFに対する同種移植の成績は,ほとんどが後方視的解析であるが,OSは40~50%の報告が多く1-5),移植後2年経過した場合,長期生存が得られる可能性が期待される6)。わが国の日本造血細胞移植学会一元化登録事業データ(TRUMP)を用いた解析では,PMFに対する初回移植成績としては,ドナーソース別に5年OSは,血縁骨髄63%,血縁末梢血43%,非血縁骨随41%,臍帯血(2年OS)36%となっている7)。以上のことから,同種造血幹細胞移植はPMF,post PV/post ET-MFの治癒的治療となり得ることは明らかで,移植適応症例では同種移植が推奨される。
同種移植を行った症例と行わなかった症例について,生存率を後方視的に解析した研究では,DIPSSで中間-Ⅱリスク以上でかつ65歳未満のPMF症例では,同種移植により死亡リスクが減少することが示されている1,2,5)。このため,DIPSSで中間-Ⅱリスク以上で65歳未満であれば,同種移植を行うことが推奨される。しかしながら,通常の骨髄破壊的前処置では治療関連死亡率が30~40%と高いこと,またPMF例の多くは高齢で発症するため適応症例が限られることなどの問題が指摘されている。なお,2015年に発表されたEBMT/ELN国際ワーキンググループによるコンセンサスレポートでは,PMFに対する同種移植の対象症例は,70歳未満の中間-Ⅱリスク以上,65歳未満の中間-Ⅰリスク群では,輸血依存,末梢血芽球>1%,予後不良染色体,triple negativeの症例,ASXL1変異陽性など白血病への移行高リスク群が挙げられている8)。
幹細胞ソースとしては,移植後の非再発死亡は,HLA一致同胞間移植と比較して,非血縁者間移植の方が治療関連死亡のリスクが高いとする報告が多い9-11)。また,フルダラビン(FLU),メルファラン(MEL)に,非血縁者間移植では抗胸腺細胞免疫グロブリン(ATG)を加えた骨髄非破壊的前治療による前視方的試験(MPD-RC101)でも,非血縁者間移植では,生着不全が多く,生存率も低いなど,HLA一致血縁ドナー以外からの移植成績が低いとされるが,最近の報告では,ドナーによる移植成績の差は小さくなってきている。わが国での後方視的解析においても,移植後非再発死亡のリスク因子として,移植前の頻回輸血,臍帯血移植などが抽出されており,臍帯血移植後の主な死因として感染症が多いことが報告されている7)。ただし,全死亡のリスク因子としては,幹細胞ソースは抽出されておらず,HLA一致血縁ドナーが得られない場合は,非再発死亡の増加はみられるものの,HLA一致非血縁ドナー,臍帯血は選択枝になり得る。HLA半合致移植については,報告例も増加傾向であり,MFにおいても選択可能な幹細胞ソースであることが示されているが,生着不全と非再発死亡に注意が必要である12-14)。
移植前治療について,骨髄破壊的前治療と,骨髄非破壊的前治療の後方視的解析による比較では,両群でOSに差はないため,いずれも選択可能であるが,若年者では,無GVHD/再発生存率を考慮すると,骨髄破壊的前治療が推奨される10,11,15,16)。MFに対する同種移植の前方視的試験は限られているため,至適な移植前処置は明らかではない。骨髄非破壊的前処置では,FLU+ブスルファン(BU)もしくは,FLU+MELが主に用いられているが,その至適投与量や,これらに追加するATGや放射線の全身照射の要否・投与量(線量)など,まだまだ検討すべき課題が多い。
移植前にJAK1/JAK2阻害薬ルキソリチニブ(RUX)を投与すると,全身症状の改善,腫瘍量の減量などが期待できるが,移植後成績が向上するかどうかについてはエビデンスが得られていない。少なくともこれまでの解析結果からは,移植後成績に影響を与える因子としては抽出されていない17-20)。移植前に脾腫の改善が得られた症例では良好な結果が期待できること21),RUXの投与継続率などを考慮して,移植前のRUXの要否,投与開始後の移植時期の判断をすることが求められる。
MFに対する同種造血細胞移植では,生着不全に関わる因子の一つとして脾腫が挙げられる。しかし,移植前に摘脾や,脾腫の縮小を期待して放射線療法を施行した場合の移植後再発,生存に及ぼす影響については,一定の見解が得られていない22,23)。最近では,脾腫に対してRUXが用いられることが多く,移植前マネージメントにおける摘脾や脾照射の役割は小さくなりつつある。
参考文献
1) Scott BL, et al. The Dynamic International Prognostic Scoring System for myelofibrosis predicts outcomes after hematopoietic cell transplantation. Blood. 2012; 119(11): 2657-64.(3iiiA)
2) Kröger N, et al. Impact of allogeneic stem cell transplantation on survival of patients less than 65 years of age with primary myelofibrosis. Blood. 2015; 125(21): 3347-50; quiz 3364.(3iiiA)
3) Kröger N, et al. Impact of Molecular Genetics on Outcome in Myelofibrosis Patients after Allogeneic Stem Cell Transplantation. Biol Blood Marrow Transplant. 2017; 23(7): 1095-101.(3iiiA)
4) Ali H, et al. MIPSS70+ v2.0 predicts long-term survival in myelofibrosis after allogeneic HCT with the Flu/Mel conditioning regimen. Blood Adv. 2019; 3(1): 83-95.(3iiiA)
5) Gowin K, et al. Survival following allogeneic transplant in patients with myelofibrosis. Blood Adv. 2020; 4(9): 1965-73.(3iiiA)
6) Robin M, et al. Long-term outcome after allogeneic hematopoietic cell transplantation for myelofibrosis. Haematologica. 2019; 104(9): 1782-8.(3iiiA)
7) Murata M, et al. Comparison of Outcomes of Allogeneic Transplantation for Primary Myelofibrosis among Hematopoietic Stem Cell Source Groups. Biol Blood Marrow Transplant. 2019; 25(8): 1536-43.(3iiiDii)
8) Kröger NM, et al. Indication and management of allogeneic stem cell transplantation in primary myelofibrosis: a consensus process by an EBMT/ELN international working group. Leukemia. 2015; 29(11): 2126-33.(レビュー)
9) Hernández-Boluda JC, et al. Determinants of survival in myelofibrosis patients undergoing allogeneic hematopoietic cell transplantation. Leukemia. 2021; 35(1): 215-24.(3iiiA)
10)Gupta V, et al. Reduced-intensity hematopoietic cell transplantation for patients with primary myelofibrosis: a cohort analysis from the center for international blood and marrow transplant research. Biol Blood Marrow Transplant. 2014; 20(1): 89-97.(3iiiA)
11)Rondelli D, et al. MPD-RC 101 prospective study of reduced-intensity allogeneic hematopoietic stem cell transplantation in patients with myelofibrosis. Blood. 2014; 124(7): 1183-91.(3iiiA)
12)Hernández-Boluda JC, et al. Predicting Survival after Allogeneic Hematopoietic Cell Transplantation in Myelofibrosis: Performance of the Myelofibrosis Transplant Scoring System(MTSS)and Development of a New Prognostic Model. Biol Blood Marrow Transplant. 2020; 26(12): 2237-44.(3iiiA)
13)Kunte S, et al, Allogeneic blood or marrow transplantation with haploidentical donor and post-transplantation cyclophosphamide in patients with myelofibrosis: a multicenter study. Leukemia. 2022; 36(3): 856-64.(3iiiA)
14)Raj K, et al. Family Mismatched Allogeneic Stem Cell Transplantation for Myelofibrosis: Report from the Chronic Malignancies Working Party of European Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2019; 25(3): 522-8.(3iiiA)
15)Kröger N, et al. Allogeneic stem cell transplantation after reduced-intensity conditioning in patients with myelofibrosis: a prospective, multicenter study of the Chronic Leukemia Working Party of the European Group for Blood and Marrow Transplantation. Blood. 2009; 114(26): 5264-70.(3iiiDii)
16)McLornan D, et al. Myeloablative and Reduced-Intensity Conditioned Allogeneic Hematopoietic Stem Cell Transplantation in Myelofibrosis: A Retrospective Study by the Chronic Malignancies Working Party of the European Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2019; 25(11): 2167-71.(3iiiA)
17)Shanavas M, et al. Outcomes of Allogeneic Hematopoietic Cell Transplantation in Patients with Myelofibrosis with Prior Exposure to Janus Kinase 1/2 Inhibitors. Biol Blood Marrow Transplant. 2016; 22(3): 432-40.(3iiiA)
18)Shahnaz Syed Abd Kadir S, et al. Impact of ruxolitinib pretreatment on outcomes after allogeneic stem cell transplantation in patients with myelofibrosis. Eur J Haematol. 2018; 101(3): 305-17.(3iiiA)
19)Gupta V, et al. Ruxolitinib Therapy Followed by Reduced-Intensity Conditioning for Hematopoietic Cell Transplantation for Myelofibrosis: Myeloproliferative Disorders Research Consortium 114 Study. Biol Blood Marrow Transplant. 2019; 25(2): 256-64.(3iiiDii)
20)Robin M, et al. Ruxolitinib before allogeneic hematopoietic transplantation in patients with myelofibrosis on behalf SFGM-TC and FIM groups. Bone Marrow Transplant. 2021; 56(8): 1888-99.(2Dii)
21)Kröger N, et al. Impact of prior JAK-inhibitor therapy with ruxolitinib on outcome after allogeneic hematopoietic stem cell transplantation for myelofibrosis: a study of the CMWP of EBMT. Leukemia. 2021; 35(12): 3551-60.(3iiiA)
22)Polverelli N, et al. Impact of spleen size and splenectomy on outcomes of allogeneic hematopoietic cell transplantation for myelofibrosis: A retrospective analysis by the chronic malignancies working party on behalf of European society for blood and marrow transplantation(EBMT). Am J Hematol. 2021; 96(1): 69-79.(3iiiA)
23)Bossard JB, et al. Splenectomy before allogeneic hematopoietic cell transplantation for myelofibrosis: A French nationwide study. Am J Hematol. 2021; 96(1): 80-8.(3iiiDiv)
CQ19 骨髄線維症(PMF,post PV/post ET-MF)から進展した白血病に対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
通常のAML治療に準じて寛解導入を行い,移植適応症例については,同種造血細胞移植を検討することを推奨する。
解説
MFから進展した白血病に対する治療のデータは限られており,現時点で推奨される治療は明らかではない。比較的症例数の多い後方視的研究では,MFから急性白血病に進展した場合,化学療法の有効性は乏しく,生存期間の中央値は2.6~3.6カ月と報告されている1,2)。
Mayo-AGIMM studyによる410例の後方視的解析では,同種造血細胞移植を受けた症例(24例)の5年OSが10%であったのに対し,寛解導入療法で寛解に至るも同種移植を受けていない症例(24例)の5年OSは13%,寛解が得られず移植を受けていない症例(200例)の5年OSは1%であったことから,寛解導入療法が奏効しても,同種移植なしでは,長期予後は厳しいことが示されている2)。MFから進展した白血病に対する同種移植の臨床試験は存在せず,後方視的解析のみであるが,治療関連死亡率,再発率いずれも高いものの,移植後3~5年の生存率は約20~30%で,同種移植は根治的治療となり得ることが示唆される3-5)。移植前に寛解であることが,移植後の長期予後に関連するかについては,後方視的解析によって異なった結果が得られている。
NCCNのガイドラインにおいては,同種造血細胞移植適応患者では,臨床試験に参加,もしくは,寛解導入療法後に寛解が得られれば移植を実施,寛解導入療法としては,脱メチル化薬単独もしくはルキソリチニブ(RUX)の併用,急性白血病に準じた強力な化学療法が併記されている6)。移植非適応患者では,臨床試験,脱メチル化薬単独もしくはRUXの併用,低用量の化学療法が選択肢として挙げられている。
Mayo-AGIMM studyでは,MFから進展した白血病に対してAMLに準じた強力な化学療法を施行した場合の寛解率は35%と報告されているが,上述のように,その後同種移植を施行されない場合の5年OSは10%で,いったん寛解が得られても,多くの症例は再発する2)。一方,脱メチル化薬アザシチジン(AZA)を投与した症例の後方視的解析では,全奏効率は,32~62%と,一定の効果はあるが,効果の持続期間は短く,AZA治療後の地固め療法の開発が求められる7-9)。一方,同じく脱メチル化薬のdecitabineとJAK1/JAK2阻害薬RUXの併用療法は,全奏効率は44~61%であるが,強力な寛解導入療法に近い奏効が得られ,同種移植適応患者については,移植までの橋渡し治療となり得る可能性がある10-12)。また,最近,AMLに対して使用可能となったBCL-2阻害薬ベネトクラクス(VEN)については,少数例の後方視的解析ではあるが,脱メチル化薬との併用が一部の症例において同種移植までの橋渡し治療として有用な可能性が示されている13-15)。
以上から,MFから進展した白血病に対しては,通常のAML治療に準じて,AZAとVENの併用療法,もしくは,強力化学療法にて寛解導入を行い,移植適応症例については,同種移植を検討することが勧められる。
参考文献
1) Mesa RA, et al. Leukemic transformation in myelofibrosis with myeloid metaplasia: a single-institution experience with 91 cases. Blood. 2005; 105(3): 973-7.(3iiiC)
2) Tefferi A, et al. Blast phase myeloproliferative neoplasm: Mayo-AGIMM study of 410 patients from two separate cohorts. Leukemia. 2018; 32(5): 1200-10.(3iiiA)
3) Alchalby H, et al. Allogeneic stem cell transplantation for myelofibrosis with leukemic transformation: a study from the Myeloproliferative Neoplasm Subcommittee of the CMWP of the European Group for Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2014; 20(2): 279-81.(3iiiA)
4) Cahu X, et al. Allo-SCT for Philadelphia-negative myeloproliferative neoplasms in blast phase: a study from the Societe Francaise de Greffe de Moelle et de Therapie Cellulaire(SFGM-TC). Bone Marrow Transplant. 2014; 49(6): 756-60.(3iiiA)
5) Gupta V, et al. Genetic factors rather than blast reduction determine outcomes of allogeneic HCT in BCR-ABL-negative MPN in blast phase. Blood Adv. 2020; 4(21): 5562-73.(3iiiA)
6) NCCN Clinical Practice Guidelines in Oncology. Myeloproliferative neoplasms Version 1.2022.(ガイドライン)
7) Thepot S, et al. Treatment of progression of Philadelphia-negative myeloproliferative neoplasms to myelodysplastic syndrome or acute myeloid leukemia by azacitidine: a report on 54 cases on the behalf of the Groupe Francophone des Myelodysplasies(GFM). Blood. 2010; 116(19): 3735-42.(3iiiDiv)
8) Andriani A, et al. Azacytidine for the treatment of retrospective analysis from the Gruppo Laziale for the study of Ph-negative MPN. Leuk Res. 2015; 39(8): 801-4.(3iiiDiv)
9) Andriani A, et al. Treatment of Philadelphia-negative myeloproliferative neoplasms in accelerated/blastic phase with azacytidine. Clinical results and identification of prognostic factors. Hematol Oncol. 2019; 37(3): 291-5.(3iiiA)
10)Rampal RK, et al. Safety and efficacy of combined ruxolitinib and decitabine in accelerated and blast-phase myeloproliferative neoplasms. Blood Adv. 2018; 2(24): 3572-80.(3iiiDiv)
11)Bose P, et al. A phase 1/2 study of ruxolitinib and decitabine in patients with post-myeloproliferative neoplasm acute myeloid leukemia. Leukemia. 2020; 34(9): 2489-92.(3iiiDiv)
12)Mascarenhas JO, et al. Phase 2 study of ruxolitinib and decitabine in patients with myeloproliferative neoplasm in accelerated and blast phase. Blood Adv. 2020; 4(20): 5246-56.(3iiiDiv)
13)Masarova L, et al. Single-center experience with venetoclax combinations in patients with newly diagnosed and relapsed AML evolving from MPNs. Blood Adv. 2021; 5(8): 2156-64.(3iiiDiv)
14)Tremblay D, et al. Venetoclax and hypomethylating agent combination therapy in acute myeloid leukemia secondary to a myeloproliferative neoplasm. Leuk Res. 2020; 98: 106456.(3iiiC)
15)Gangat N, et al. Venetoclax with azacitidine or decitabine in blast-phase myeloproliferative neoplasm: A multicenter series of 32 consecutive cases. Am J Hematol. 2021; 96(7): 781-9.(3iiiDiv)
CQ20 pre-PMFに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー3
現時点では明らかなエビデンスは存在しないが,PMFの予後予測分類に基づいて治療方針を検討することを推奨する。
- 推奨グレード
- カテゴリー3
血栓既往を有する場合や心血管リスクのある場合などでは,血栓予防を考慮する。
解説
WHO分類(2017)では,PMFを前線維化期PMF(pre-PMF)と線維化期(overt PMF)PMFの2つに分けた診断基準が記載されている。骨髄生検による病理所見,特に線維化の評価が重要視され,pre-PMFではGrade 1を超える細網線維の増生は伴わない。予後の観点から,本態性血小板血症と慎重に鑑別することが求められる。
現時点では,ELNやNCCNのガイドラインにおいても,pre-PMFの治療に特化した記載はない。したがって,現時点ではpre-PMFにおいてもPMFと同様にIPSSなどの予後予測分類に基づいて治療方針を決定することが推奨される1)。ただし,後方視的解析では,IPSSは,pre-PMFに対しても,予後予測分類として有用であるものの,低リスク群と高リスク群の分離が不十分であることも示されており,治療方針の決定には注意が必要である2)。また,複数の後方視的研究から,pre-PMFでは,血栓・出血性イベントが高い可能性が示されており3-5),pre-PMFにおいても,ETの血栓症リスク分類であるIPSET-thrombosis,revised IPSET-thrombosisに基づいた血栓症リスクの評価の有効性を示す報告もあり,血栓症高リスク群で血栓予防を行うことは妥当と考えられる6)。
参考文献
1) Finazzi G, et al. Prefibrotic myelofibrosis: treatment algorithm 2018. Blood Cancer J. 2018; 8(11): 104.(レビュー)
2) Guglielmelli P, et al. Presentation and outcome of patients with 2016 WHO diagnosis of prefibrotic and overt primary myelofibrosis. Blood. 2017; 129(24): 3227-36.(3iiA)
3) Buxhofer-Ausch V, et al. Leukocytosis as an important risk factor for arterial thrombosis in WHO-defined early/prefibrotic myelofibrosis: an international study of 264 patients. Am J Hematol. 2012; 87(7): 669-72.(3iiDi)
4) Finazzi G, et al. Incidence and risk factors for bleeding in 1104 patients with essential thrombocythemia or prefibrotic myelofibrosis diagnosed according to the 2008 WHO criteria. Leukemia. 2012; 26(4): 716-9.(3iiDi)
5) Barbui T, et al. Disease characteristics and clinical outcome in young adults with essential thrombocythemia versus early/prefibrotic primary myelofibrosis. Blood. 2012; 120(3): 569-71.(3iiDi)
6) Guglielmelli P, et al. Validation of the IPSET score for thrombosis in patients with prefibrotic myelofibrosis. Blood Cancer J. 2020; 10(2): 21.(3iiDi)

