第Ⅰ章 白血病
Ⅰ 白血病
3 急性リンパ芽球性白血病/リンパ芽球性リンパ腫
(acute lymphoblastic leukemia/lymphoblastic lymphoma:ALL/LBL)
総論
急性リンパ性白血病とリンパ芽球性リンパ腫はいずれもリンパ球系前駆細胞由来の腫瘍であり本態は同じ疾患と考えられている。骨髄にリンパ芽球が浸潤している場合は急性リンパ芽球性白血病(acute lymphoblastic leukemia:ALL),骨髄への浸潤が少なく腫瘤が前景にある場合はリンパ芽球性リンパ腫(lymphoblastic lymphoma:LBL)としている。この境界は必ずしも明瞭ではなく一般に骨髄中にリンパ芽球が25%以上認められるときにはALLと診断されることが多い。
WHO分類(2017)では,リンパ系腫瘍をB細胞系とT/NK細胞(T細胞およびnatural killer:NK細胞)系とに大別し,正常リンパ系細胞の分化段階と概括対応させて細分類した1)。すなわち,ALL/LBLは前駆B細胞(precursor B-cell)由来と前駆T細胞(precursor T-cell)由来に分類され,それぞれ,B細胞性ALL/LBLとT細胞性ALL/LBLと呼ばれ,B細胞性ALL/LBLは,非特定型(not otherwise specified)と反復性遺伝子異常を伴う(with recurrent genetic abnormalities)型に分類される。その他にB細胞系,T細胞系ともにprovisional entityが加えられている(表1)1)。FAB分類2)のL3は成熟B細胞腫瘍(mature B-cell neoplasms)であるバーキットリンパ腫(Burkitt lymphoma)に包含され,ALL/LBLには含まれてない1)。
表1 ALL/LBLのWHO分類(2017)
・B-lymphoblastic leukemia/lymphoma, NOS
・B-lymphoblastic leukemia/lymphoma with recurrent genetic abnormalities
・B-lymphoblastic leukemia/lymphoma with t(9;22)(q34.1;q11.2); BCR-ABL1
・B-lymphoblastic leukemia/lymphoma with t(v;11q23.3); KMT2A rearranged
・B-lymphoblastic leukemia/lymphoma with t(12;21)(p13.2;q22.1); ETV6-RUNX1
・B-lymphoblastic leukemia/lymphoma with hyperdiploidy
・B-lymphoblastic leukemia/lymphoma with hypodiploidy
・B-lymphoblastic leukemia/lymphoma with t(5;14)(q31.1;q32.3); IL3-IGH
・B-lymphoblastic leukemia/lymphoma with t(1;19)(q23;p13.3); TCF3-PBX1
・Provisional entity: B-lymphoblastic leukemia/lymphoma, BCR-ABL1-like
・Provisional entity: B-lymphoblastic leukemia/lymphoma with iAMP21
T-lymphoblastic leukemia/lymphoma
・Provisional entity: Early T-cell precursor lymphoblastic leukemia
・Provisional entity: Natural killer(NK)cell lymphoblastic leukemia/lymphoma
(文献1)より引用)
ALLの初回治療はリンパ系腫瘍に有効性の高い抗白血病薬(抗がん薬)の多剤併用化学療法が主体となり,寛解導入療法,寛解後療法(地固め療法と維持療法),中枢神経浸潤の予防が施行される。
予後因子は,従来から年齢,白血球数が重視されていたが,現在ではこれらに加えて染色体の低2倍体(染色体数<44本),t(4;11)などのKMT2A再構成,IgH転座,t(9;22)(q34;q11.2); BCR::ABL1(Ph),複雑核型,BCR::ABL1-like(Ph-like),IKZF1変異が予後不良因子とされている3)。このうちPh陽性ALLはチロシンキナーゼ阻害薬(tyrosine kinase inhibitor : TKI)登場以前に予後不良ALLとして認識されたものであり,現在ではTKI治療により予後が改善している。さらに,最近は微小残存病変/測定可能残存病変(minimal/measurable residual disease : MRD)が従来の予後因子を凌駕する予後因子である可能性が提起されている。
参考文献
1) Borowitz MJ, et al. Precursor lymphoid neoplasms. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, Lyon, IARC; 2017: pp199-213.(テキストブック)
2) Bennett JM, et al.: The morphological classification of acute lymphoblastic leukaemia: Concordance among observers and clinical correlations. Br J Haematol. 1981; 47(4): 553-61.
3) NCCN Clinical Practice Guidelines in Oncology. Acute Lymphoblastic Leukemia. Version 4.2021(ガイドライン)
アルゴリズム
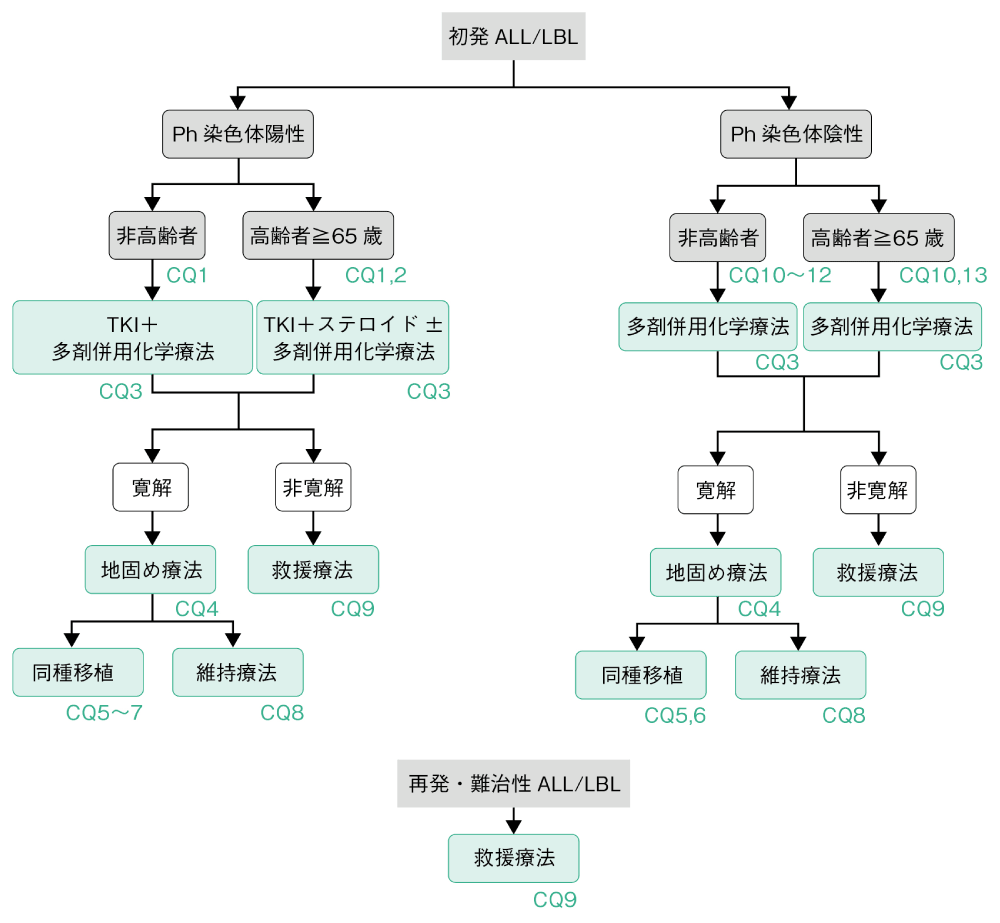
寛解導入療法の選択は,まずPhiladelphia(Ph)染色体の有無で分類し,Ph染色体陽性(以降,Ph陽性)であればTKIを含む化学療法が推奨される(CQ1,2)。第一寛解期のPh陽性ALLでは同種造血幹細胞移植が推奨される(CQ5)。同種移植後MRD陰性の状態での予防的なTKI維持療法は勧められない。ただし,MRDが陽性となった時点で行う先制的なTKI投与は推奨される(CQ7)。高齢者(65歳以上)のPh陽性ALLに対してはTKI+ステロイドによる寛解導入療法が推奨される。可能であればTKIに加えて減弱化学療法で地固め療法,維持療法を行うことが推奨される(CQ2)。第一寛解期のPh陽性ALLに同種造血幹細胞移植を行わない場合はTKIの維持療法を5年以上継続することが推奨される(CQ8)。
Ph陰性ALLでは,思春期・若年成人(おおむね40歳まで)であれば小児型化学療法が推奨される。40~64歳に成人型化学療法を行う場合は大量メトトレキサート(MTX)が組み込まれている化学療法が推奨される。小児型化学療法を成人に用いる場合は年齢層ごとに薬剤量を調節するなどの工夫が必要である(CQ11)。T細胞性ALL(T-ALL)は現在のところB細胞性ALL(B-ALL)と別個の治療を行う根拠はない(CQ10)。LBLは,WHO分類(2017)ではALLと同じカテゴリーに属し,ALLと同じ治療が推奨される(CQ12)。
完全寛解(CR)に到達すれば,Ph染色体の有無や年齢にかかわらず,抗がん薬の髄腔内投与かつ大量MTXあるいは大量シタラビン(AraC)の使用が中枢神経系(central nervous system:CNS)再発予防に必要である。頭部照射は高リスク症例に対して許容される(CQ3)。第一寛解期のPh陰性ALLでは,小児型化学療法が行われていれば化学療法の継続が推奨されるが,予後不良因子を持つ症例には同種造血幹細胞移植を考慮する(CQ5)。45歳以上の同種造血幹細胞移植で減弱前処置(reduced-intensity conditioning : RIC)は骨髄破壊的前処置(myeloablative conditioning : MAC)と同等の成績であり,両者の相反する特徴である治療関連毒性と再発率を十分に考慮し,適切な前処置を選択する必要がある(CQ6)。第一寛解期で同種造血幹細胞移植を行わない場合は,維持療法が推奨される(CQ8)。
CR時あるいはその後の経過でのMRD評価は再発予測に重要である。寛解導入療法後の0.01%以上のMRD残存は再発リスクが高いが,2回目以降のMRD至適測定時期は治療レジメンによって異なる(CQ4)。
高齢者(65歳以上)Ph陰性ALLに対する標準的な治療法は開発段階である。多剤併用化学療法か,緩和的ステロイド治療かは患者の状態によって選択する(CQ13)。
ALL再発例では前治療歴を考慮した再寛解導入療法を行う。晩期再発例では初回寛解導入療法と同一のレジメンによる再治療も選択肢に入る。B-ALL再発例では,CD19が陽性であればブリナツモマブ(BLINA)が,CD22が陽性であればイノツズマブ オゾガマイシン(InO)の使用が推奨される。Ph陽性ALLの再発では,イマチニブ(IMA)使用後であればダサチニブ(DAS)あるいはポナチニブ(PON)へ,DAS使用後であればPONへの変更が妥当である。T-ALLの再発ではネララビン(NEL)が治療選択肢に加わる。25歳以下のCD19陽性B-ALLの再発後寛解導入不能症例,あるいは同種造血幹細胞移植後再発ではCAR-T療法が治療選択肢に加わる(CQ9)。
CQ1 初発Ph陽性ALLに対するTKIは何が勧められるか
- 推奨グレード
- カテゴリー2A
第二世代以降のTKIが使用されることが多いが,初発症例には保険適用に問題がある。第一世代TKIと第二・三世代TKIとのランダム化比較試験の報告はない。
解説
TKI登場以前は,Ph陽性ALLであってもALLとして共通の化学療法が行われていた。そのため,第一世代TKIであるイマチニブ(IMA)は,通常の化学療法に追加された治療成績の報告が多い。いずれの報告でもTKI登場以前と比べ,血液学的完全寛解(HCR)およびOSとも優れた治療成績であった1-6)。併用する化学療法については,強力な化学療法と減弱化学療法とのランダム化比較試験が行われており,強力な化学療法との併用では,寛解導入療法時の早期死亡割合が有意に高かったことが治療成績に影響を与えていた7)。その後,第二世代TKIが登場し臨床試験が始められたが,そのなかではダサチニブ(DAS)を使用したものが多い。IMAをDASに置き換えた強力な化学療法と併用の治療成績は,IMA使用時よりも優れた傾向であったが,現在のところDASがIMAに優るというエビデンスは得られていない8-10)。一方,Ph陽性ALLは比較的高齢者が多いこと,強力な化学療法との併用の場合には一定割合の早期死亡が避けられないこと,などからステロイド併用のみによる寛解導入療法を行った治療成績が報告されている11,12)。本邦からも非高齢者における同様な治療法が報告されたが,早期死亡はなく全例HCRが得られており,優れた治療成績であった13)。DASは初発Ph陽性ALLには保険適用の問題があるが,IMAより強いBCR-ABL1阻害活性を有し,変異型BCR::ABL1であるT315I,E255V変異などを除けば,ABL1遺伝子変異を有する多くの症例にも有効であることもあり,実臨床でも使用されていることが多い。近年,CD19とCD3に二重特異性を有するT細胞誘導抗体製剤であるブリナツモマブ(BLINA)と併用した治療成績報告がされ14),Ph陽性ALLにおいても“chemotherapy-free”療法が確立することが期待されている。なお,BLINAの現在の保険適用は再発・難治である。第三世代TKIであるポナチニブ(PON)は,他のTKIに抵抗性を示す変異型BCR::ABL1であるT315I変異などに対しても強力な阻害作用を示す。IMAあるいはDASをPONに置き換えた強力な化学療法との併用療法では,それまでの治療法と比べ優れた治療成績であり,分子遺伝学的奏効も早期に得られ,現状では推奨されている造血幹細胞移植療法をも回避できる可能性が示唆されている15,16)。なお,この治療法は有害事象の問題でPONの投与量が途中で修正されている。ステロイドのみの併用では,高齢または強力な治療に不適格な症例を対象にした報告があるが,この対象群にはPONの減量が必要な場合があるとされている17)。初発Ph陽性ALLの保険適用に関しては,DASと同様である。TKIに関する臨床試験の報告は,いずれもTKIのランダム化比較試験ではない。TKIを選択する上では,それぞれの効果・有害事象の特徴を理解し,年齢および合併症を考慮することも必要である。
参考文献
1)Thomas DA, et al. Treatment of Philadelphia chromosome-positive acute lymphocytic leukemia with hyper-CVAD and imatinib mesylate. Blood. 2004; 103(12): 4396-407.(3iiiDiv)
2)Daver N, et al. Final report of a phase II study of imatinib mesylate with hyper-CVAD for the front-line treatment of adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia. Haematologica. 2015; 100(5): 653-61.(3iiiA)
3)Fielding AK, et al. UKALLXII/ECOG2993: addition of imatinib to a standard treatment regimen enhances long-term outcomes in Philadelphia positive acute lymphoblastic leukemia. Blood. 2014; 123(6): 843-50.(3iiiA)
4)Yanada M, et al. High complete remission rate and promising outcome by combination of imatinib and chemotherapy for newly diagnosed BCR-ABL-positive acute lymphoblastic leukemia: a phase II study by the Japan Adult Leukemia Study Group. J Clin Oncol. 2006; 24(3): 460-6.(3iiiDiv)
5)Hatta Y, et al. Final analysis of the JALSG Ph+ALL202 study: tyrosine kinase inhibitor-combined chemotherapy for Ph+ALL. Ann Hematol. 2018; 97(9): 1535-45.(3iiiDi)
6)Fujisawa S, et al. Phase II study of imatinib-based chemotherapy for newly diagnosed BCR-ABL-positive acute lymphoblastic leukemia. Am J Hematol. 2017; 92(4): 367-74.(3iiiDi)
7)Chalandon Y, et al. Randomized study of reduced-intensity chemotherapy combined with imatinib in adults with Ph-positive acute lymphoblastic leukemia. Blood. 2015; 125(24): 3711-9.(1iiDiv)
8)Ravandi F, et al. First report of phase 2 study of dasatinib with hyper-CVAD for the frontline treatment of patients with Philadelphia chromosome-positive (Ph+) acute lymphoblastic leukemia. Blood. 2010; 116 (12): 2070-7.(3iiiDiv)
9)Ravandi F, et al. Long-term follow-up of a phase 2 study of chemotherapy plus dasatinib for the initial treatment of patients with Philadelphia chromosome-positive acute lymphoblastic leukemia. Cancer. 2015; 121(23): 4158-64.(3iiiDiv)
10)Ravandi F, et al. US Intergroup Study of Chemotherapy Plus Dasatinib and Allogeneic Stem Cell Transplant in Philadelphia Chromosome Positive ALL. Blood Adv. 2016; 1(3): 250-9.(3iiiDii)
11)Foà R, et al. Dasatinib as first-line treatment for adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia. Blood. 2011; 118(25): 6521-8.(3iiiDiv)
12)Chiaretti S, et al. A multicenter total therapy strategy for de novo adult Philadelphia chromosome positive acute lymphoblastic leukemia patients: final results of the GIMEMA LAL1509 protocol. Haematologica. 2021; 106(7): 1828-38.(3iiiDiv)
13)Sugiura I, et al. Dasatinib-based 2-step induction for adults with Philadelphia chromosome-positive acute lymphoblastic leukemia. Blood Adv. 2022; 6(2): 624-36.(3iiiDi)
14)Foà R, et al. Dasatinib-Blinatumomab for Ph-Positive Acute Lymphoblastic Leukemia in Adults. N Engl J Med. 2020; 22; 383(17): 1613-23.(3iiiDiv)
15)Jabbour E, et al. Combination of hyper-CVAD with ponatinib as first-line therapy for patients with Philadelphia chromosome-positive acute lymphoblastic leukaemia: a single-centre, phase 2 study. Lancet Oncol. 2015; 16(15): 1547-55.(3iiiDi)
16)Jabbour E, et al. Combination of hyper-CVAD with ponatinib as first-line therapy for patients with Philadelphia chromosome-positive acute lymphoblastic leukaemia: long-term follow-up of a single-centre, phase 2 study. Lancet Haematol. 2018; 5(12): e618-27.(3iiiDi)
17)Martinelli G, et al. INCB84344-201: Ponatinib and steroids in frontline therapy for unfit patients with Ph+acute lymphoblastic leukemia. Blood Adv. 2022; 6(6): 1742-53.(3iiiDiv)
CQ2 高齢者(65歳以上)Ph陽性ALLに対する初期治療はどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
高齢者のPh陽性ALLに対してはTKI+ステロイドによる寛解導入が推奨される。
- 推奨グレード
- カテゴリー2A
可能であればTKIに加えて減弱化学療法で地固め療法,維持療法を行うことが推奨される。
解説
GRAALLの報告では55歳以上の症例にイマチニブ(IMA)併用化学療法で寛解導入を行い,72%の症例がCRに達した1)。55歳以上を対象にIMA単独と多剤併用化学療法を比較したGMALLの研究ではCR率はそれぞれ96.3%と50.0%であり,IMA単独が有意に良好であった。また,IMA単独群で有害事象も少なかったことからIMA単独による寛解導入療法の有効性が示された2)。高齢者にIMA単独800mgを投与したGIMEMAの報告では100%のCRを得ているが分子遺伝学的寛解は27例中1例のみであった3)。TKIにステロイドを併用した試みも行われており,GIMEMAのLAL1205では対象年齢はやや若いが(年齢中央値53.6歳)ダサチニブ(DAS)140mgとステロイドによる寛解導入療法で100%のCRが得られ,そのうち約20%の症例でBCR::ABLが3logを超す寛解を得ている4)。これらを参考に高齢者のPh陽性ALLに対してはTKI+ステロイドによる寛解導入を推奨する。GIMEMAのLAL1811では年齢中央値66.5歳(約8割が60歳以上)の集団にポナチニブ(PON)45mgとプレドニゾロン(PSL)で寛解導入を行っているが24週でのCR率は86.4%,分子遺伝学的寛解は40.9%であり従来のIMAおよびDASの報告より劣っていた。心臓血管に関する有害事象が多く,PON投与量などが今後の検討課題である5)(本邦ではPONのPh陽性ALLに対する保険適用は再発または難治のB-ALLである)。
寛解後療法についてはGIMEMAのLAL1205でTKI単独の治療を継続した症例では19例中17例が再発しておりTKI単独治療の限界を示している4)。再発例ではDASに耐性を示すBCR::ABLのT315I変異が多かった。EWALLでは年齢中央値69歳の集団にDASと強度減弱化学療法で寛解導入,地固め,維持療法を行い,さらにDASを継続した。CR率は96%,5年RFSは28%,OSは36%であり,高齢者へのTKIと強度減弱化学療法の有用性が示された6)。CALGB10701では中央値60歳の集団にDASとデキサメタゾン(DEX)による化学療法を行い,寛解後療法に強度減弱化学療法を行った。5年DFSは34%,OSは46%であった7)。以上から,高齢者においては可能であればTKIを併用した減弱化学療法で地固め療法,維持療法を行うことを推奨する。減弱化学療法の薬剤や投与量は年齢や全身状態によって検討されるべきであるが,EWALLの地固め療法ではDAS 100mgに加えてコース1,3,5ではL-アスパラギナーゼ(L-Asp)10,000U/m2とメトトレキサート(MTX)1g/m2を,コース2,4,6ではシタラビン(AraC)1g/ m2を12時間ごとに隔日3日投与している。
最近,化学療法を使わない治療としてDASとステロイドによる寛解導入療法後にブリナツモマブ(BLINA)投与を2~3コース行った結果が報告された。CR率は98%で,2log以上の分子学的奏効がDASの寛解導入療法後に29%,BLINA投与2コース後には60%に得られた。18カ月時点のOSは95%,DFSは88%と極めて良好であり,今後,高齢者に期待される治療である8)(本邦ではBLINAの保険適用は再発または難治のB-ALLである)。
参考文献
1) Delannoy A, et al. Imatinib and methylprednisolone alternated with chemotherapy improve the outcome of elderly patients with Philadelphia-positive acute lymphoblastic leukemia: results of the GRAALL AFR09 study. Leukemia. 2006; 20(9): 1526-32.(3iiiA)
2) Ottmann OG, et al. Imatinib compared with chemotherapy as front-line treatment of elderly patients with Philadelphia chromosome-positive acute lymphoblastic leukemia(Ph+ALL). Cancer. 2007; 109(10): 2068-76.(1iiDiv)
3) Vignetti M, et al. Imatinib plus steroids induces complete remissions and prolonged survival in elderly Philadelphia chromosome-positive patients with acute lymphoblastic leukemia without additional chemotherapy: results of the Gruppo Italiano Malattie Ematologiche dell’Adulto(GIMEMA)LAL0201-B protocol. Blood. 2007; 109(9): 3676-8.(3iiiDiv)
4) Foà R , et al. Dasatinib as first-line treatment for adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia. Blood. 2011; 118(25): 6521-8. (3iiiDiv)
5) Martinelli G, et al. INCB84344-201: Ponatinib and steroids in frontline therapy for unfit patients with Ph+acute lymphoblastic leukemia. Blood Adv. 2022; 6(6): 1742-53.(3iiiDiv)
6) Rousselot P, et al. Dasatinib and low-intensity chemotherapy in elderly patients with Philadelphia chromosome-positive ALL. Blood. 2016; 128(6): 774-82.(3iiiDiii)
7) Wieduwilt MJ, et al. Dasatinib and dexamethasone followed by hematopoietic cell transplantation for adults with Ph-positive ALL. Blood Adv. 2021; 5(22): 4691-700. (2Div)
8) Foà R, et al. Dasatinib-Blinatumomab for Ph-Positive Acute Lymphoblastic Leukemia in Adults. N Engl J Med. 2020; 383(17): 1613-23.(3iiiDiv)
CQ3 成人ALLの治療においてどのような中枢神経系再発予防が勧められるか
- 推奨グレード
- カテゴリー2A
抗がん薬の髄腔内投与かつ大量メトトレキサートあるいは大量シタラビンの使用はすべての成人ALLにおいて推奨される。
- 推奨グレード
- カテゴリー2B
頭部照射は高リスク症例に対して許容されるCNS再発予防法である。
解説
CNS再発予防を行わない成人ALLでのCNS再発率は3割と高率であり,抗がん薬の髄腔内投与(intrathecal:IT),化学療法の強度を上げた大量メトトレキサート(MTX)や大量シタラビン(AraC)を用いることによりCNS再発率は有意に低下することが示されている1,2)。成人ALLに対して18Gyの頭部照射を含んだ小児ALLレジメンを用いることによりCNS再発率は2.3%まで低下したが,45歳以上では治療関連死亡率が23%と高率であった3)。初発時に中枢病変を有する症例が7%含まれるhyper-CVAD/MA交替療法におけるCNS再発率が4%であること,放射線照射による中枢神経への影響を考慮すると,頭部照射の適応は慎重に考慮するべきといえる2)。JALSGによる大量MTXと中等量MTXのランダム化比較試験(JALSGALL202-O試験)では,初発時に中枢病変陽性症例のみ頭部照射が20~24Gy行われた4)。全体のCNS再発は大量MTX群で1例,中等量MTX群で3例(両群間で有意差なし)と全体で1%程度の再発率にとどまり,中枢病変陽性症例に対する頭蓋内照射は許容される治療といえる。AYA世代ALLを染色体異常,MRD,初期プレドニゾロン(PSL)治療反応性などによりリスクを評価し,高リスク症例に対して18Gy,初発時中枢病変陽性症例では24Gyの頭部照射を行うGIMEMAからの臨床試験では,76例中4例(5%)のCNS再発率と報告され,疾患リスクによりCNS予防強度を最適化し良好な成績を示している5)。以上より,ALLに対する頭部照射は18~24Gyの範囲内で,初発時中枢病変陽性症例,高リスク症例に限り検討する。一方で,45歳以上での頭部照射については有害事象に留意し慎重に検討すべきである。
小児標準リスクALLを対象にMTX単剤ITとAraC/PSLを追加するtriples ITをランダム化比較した臨床試験では6年CNS再発率が5.9% vs. 3.4%で有意にtriples ITで低かったものの,骨髄再発と精巣再発が多く,6年OSは94.4% vs. 90.3%でtriples ITで有意に低下した6)。成人ALLにおいてITの内容における比較試験は存在しない。
参考文献
1)Cortes J, et al. The value of high-dose systemic chemotherapy and intrathecal therapy for central nervous system prophylaxis in different risk groups of adult acute lymphoblastic leukemia. Blood. 1995; 86(6): 2091-7.(3iiDi)
2)Kantarjian HM, et al. Results of treatment with hyper-CVAD, a dose-intensive regimen, in adult acute lymphocytic leukemia. J Clin Oncol. 2000;18(3): 547-61.(3iiiA)
3)Huguet F, et al. Pediatric-inspired therapy in adults with Philadelphia chromosome-negative acute lymphoblastic leukemia: the GRAALL-2003 study. J Clin Oncol. 2009; 27(6): 911-8.(3iiiDi)
4)Sakura T, et al. High-dose methotrexate therapy significantly improved survival of adult acute lymphoblastic leukemia: a phase III study by JALSG. Leukemia. 2018; 32(3): 626-32.(1iiDii)
5)Testi AM, et al. Adolescent and young adult acute lymphoblastic leukemia. Final results of the phase II pediatric-like GIMEMA LAL-1308 trial. Am J Hematol. 2021; 96(3): 292-301.(3iiiA)
6)Matloub Y, et al. Intrathecal triple therapy decreases central nervous system relapse but fails to improve event-free survival when compared with intrathecal methotrexate: results of the Children’s Cancer Group(CCG)1952 study for standard-risk acute lymphoblastic leukemia, reported by the Children’s Oncology Group. Blood. 2006; 108(4): 1165-73.(1iiiDiv)
CQ4 寛解期成人ALLにおけるMRDは,どのような評価方法,評価時期,閾値の判定が勧められるか
- 推奨グレード
- カテゴリー1
Real-time quantitative polymerase chain reaction(RQ-PCR)法による白血病特異的融合遺伝子測定および免疫グロブリン重鎖(Ig)/T細胞受容体(TCR)遺伝子再構成測定が推奨される。
- 推奨グレード
- カテゴリー2A
寛解導入療法後の0.01%以上のMRD残存は再発リスクが高い。2回目以降のMRD至適測定時期は,寛解導入療法後や地固め療法後など治療レジメンによって異なり,MRD至適測定時期と治療介入のための閾値はレジメンごとに臨床試験で検討されるべきである。実地診療においても1回目のMRD測定は寛解導入療法後が推奨される。
解説
MRD測定は,形態学的に同定できないほど減少した白血病細胞を定量化する検査である。MRD測定法としては,骨髄単核球中の白血病細胞同定が少なくとも<1×104(<0.01%)の感度を持つ検査が適切であり,世界的には異常な免疫形質を持った白血病細胞を同定する6カラー以上のフローサイトメトリー法1,2),白血病特異的融合遺伝子(BCR::ABL1など)やIg/TCR遺伝子再構成を同定するRQ-PCR法,Ig/TCR遺伝子再構成を同定する次世代シーケンス法が行われている3,4)。本邦においては,白血病特異的融合遺伝子のほかに2019年よりIg/TCR遺伝子再構成(RQ-PCR法)によるMRD測定が2回まで保険適用となっている。治療開始前に症例特異的なプライマー作成用検体提出が必須であるが,提出検体の質が担保されていれば概ね<1×104の感度でMRD検出が可能である。
MRDと予後の相関を検討した臨床研究は多数報告されており,それらのメタアナリシス結果が出されている。これらに組み込まれている臨床研究のMRD閾値は過半数が0.01%である。16件の成人臨床研究(2,076例),20件の小児臨床研究(11,249例),3件の小児成人混合臨床研究(312例)を統合解析した研究5)では,成人MRD陰性化症例のEFSのHR 0.28,95%CI 0.20-0.39であり,10年EFSはMRD陽性群21%に対して陰性群64%であった。MRD測定時期については寛解導入療法後MRD陰性 HR 0.33,95%CI 0.24-0.44,地固め療法後MRD陰性 HR 0.25,95%CI0.18-0.36といずれのMRD陰性化も予後と強く相関していた。また,23件の成人B-ALL研究のメタアナリシス結果では,MRD陰性がRFS(HR 2.34,95%CI 1.91-2.86),OS(HR 2.19,95%CI 1.63-2.94)と相関し,MRD測定時期は治療開始3カ月以内(HR 2.60,95%CI 2.05-3.31)であっても,3カ月以降(HR 2.23,95%CI 1.67-2.97)であっても予後と強く相関した6)。本邦からもPh陰性ALL 51例でMRDを評価した報告がされている。寛解導入療法後MRD陰性症例15例は陽性症例30例に比して3年DFSが73% vs. 41%(p=0.018)と有意に良好であり,地固め療法初回後にMRD陰性化した11例においても3年DFS 45%と寛解導入療法後MRD陰性群に対し劣った7)。臨床研究において治療層別化に用いるMRDは,寛解導入療法後<10-3を用いている報告が多い8)。
参考文献
1) Gaipa G, et al. Time point-dependent concordance of flow cytometry and real-time quantitative polymerase chain reaction for minimal residual disease detection in childhood acute lymphoblastic leukemia. Haematologica. 2012; 97(10): 1582-93. (3iiDii)
2) Denys B, et al. Improved flow cytometric detection of minimal residual disease in childhood acute lymphoblastic leukemia. Leukemia. 2013; 27(3): 635-41.(3iiDii)
3) Brüggemann M, et al. Standardized MRD quantification in European ALL trials: proceedings of the Second International Symposium on MRD assessment in Kiel, Germany, 18-20 September 2008. Leukemia. 2010; 24(3): 521-35.(レビュー)
4) Campana D. Minimal residual disease in acute lymphoblastic leukemia. Hematology Am Soc Hematol Educ Program. 2010; 2010: 7-12.(レビュー)
5) Berry DA, et al. Association of Minimal Residual Disease With Clinical Outcome in Pediatric and Adult Acute Lymphoblastic Leukemia: A Meta-analysis. JAMA Oncol. 2017; 3(7): e170580.(3iiDii)
6) Bassan R, et al. A systematic literature review and meta-analysis of minimal residual disease as a prognostic indicator in adult B-cell acute lymphoblastic leukemia. Haematologica. 2019; 104(10): 2028-39.(3iiDii)
7) Nagafuji K, et al. Prospective evaluation of minimal residual disease monitoring to predict prognosis of adult patients with Ph-negative acute lymphoblastic leukemia. Eur J Haematol. 2019; 103(3): 164-71.(3iiDii)
8) Ribera JM,et al. Chemotherapy or allogeneic transplantation in high-risk Philadelphia chromosome-negative adult lymphoblastic leukemia. Blood; 2021; 137(14): 1879-94.(2A)
CQ5 第一寛解期ALLには同種造血幹細胞移植が勧められるか(Ph陰性,Ph陽性を含む)
- 推奨グレード
- カテゴリー2A
第一寛解期のPh陰性ALLでは,小児型化学療法が行われていれば化学療法の継続が推奨されるが,予後不良因子を持つ症例には同種造血幹細胞移植を考慮する。
第一寛解期のPh陽性ALLでは,同種造血幹細胞移植が推奨される。
解説
第一寛解期(CR1)ALLに対する造血幹細胞移植の適応はgenetic randomization,すなわちCR1が得られた患者をHLA適合ドナーがいる場合には同種移植群に割り付け,ドナーがいない場合には自家移植群あるいは化学療法群に割り付けるという前方視的比較試験で検証されてきた。実際に行われた治療で群別して解析するとバイアスを生じるので,割り付けられた群(ドナーあり群 vs. ドナーなし群)に従って解析されており,割り付けられた治療が行われていない症例が含まれていることに留意する必要がある(intent-to-treat analysis)。後方視的解析については,年齢を一致させた化学療法群と同種移植群の比較の報告が増えている。
Ph陰性ALLは小児型化学療法の普及に伴って予後が改善してきている。16~39歳を対象に小児型化学療法(CALGB10403)とCIBMTR登録例を比較した大規模研究では,小児型化学療法がMACによる同種移植よりもOS,DFS,NRMの点で優れていた1)。55歳までを対象にしたGRAALL-2003とGRAALL-2005試験では,予後不良因子を持つ症例にHLA適合ドナーの有無でgenetic randomizationを行っているが,CR1での同種移植施行例は非施行例と比べて優位性が認められなかった2)。JALSG/日本造血・免疫細胞療法学会(Japanese Society for Transplantation and Cellular Therapy:JSTCT)の共同研究ではJALSG登録の化学療法例とJSTCT登録(TRUMP)のHLA一致血縁または8/8アリル一致非血縁ドナーから移植を受けた症例のデータを解析した。16~24歳の5年DFSは化学療法群70.4%,移植群62.8%,25~65歳の5年DFSは化学療法群57.0%,移植群60.7%であり,どちらの群においても化学療法群は移植群に比べて同等もしくはそれ以上の生存率を示していた3)。移植後のQOLの低下を考慮するとCR1では化学療法が優先される傾向にある。一方で,予後不良な染色体t(4;11),初めの1週間で骨髄中の白血病細胞が5%以上残存した症例,寛解導入に救援療法を必要とした症例等では,同種造血幹細胞移植施行例の優位性が示されている2)。また,MRD陽性例(0.1%または0.01%以上)も化学療法では予後不良であり,移植の適応と考えられている4)。
Ph陽性ALLについては,TKIの導入によって化学療法の成績が著しく改善しているが,CR1に同種造血幹細胞移植を施行している報告が多く,非移植例との比較は困難である。これら多くの報告では移植例の方が予後良好である。本邦のPh+ALL208試験ではCR1の同種移植群の3年OSは74%,非移植群は48%である5)。さらに現在までに2報のメタアナリシスが報告されている6,7)。解析に用いられた論文は重複しているが両者ともDFS,RFSは移植群で良好である。genetic randomizationにより最も多くの254例を解析しているGRAAPH-2005試験では同種移植群が非移植群より有意に予後良好であった8)。これらを参考にして本ガイドラインでは,CR1での同種移植の実施を推奨する。TKIについては,イマチニブ(IMA)使用例とダサチニブ(DAS)使用例では予後に差がないと考えられるので,いずれの使用例にも同種造血幹細胞移植を推奨する。
一方,後方視的解析ながら予後良好群では同種移植を行った群と化学療法を継続した群では予後に差がないとする報告も散見される。GRAAPH-2005の報告では,初発時白血球30,000/μL未満の群では移植群,非移植群では予後に差がみられず,初発時白血球30,000/μL以上の群のみ同種造血幹細胞移植の恩恵が得られている。また,化学療法2コース後の骨髄でBCR::ABL1の減少が4log未満では非移植群で予後不良であったが,4log未満で移植を行った群,4log以上で移植を行わなかった群,4log以上で移植を行った群の予後はすべて同等であった8)。同様の結果は中国からも報告されており,初発時白血球30,000/μL未満かつ地固め療法2コース後のBCR::ABL1発現が3log以上減少している低リスク群ではRFSは移植群88.2%,非移植群83.9%で予後に差が認められなかった9)。
既報の移植例では,全身状態や臓器予備能などが良好な症例にバイアスがかかっていると予想されることから,移植適応については今後も検討が必要である。
参考文献
1) Wieduwilt MJ, et al. Superior survival with pediatric-style chemotherapy compared to myeloablative allogeneic hematopoietic cell transplantation in older adolescents and young adults with Ph-negative acute lymphoblastic leukemia in first complete remission: analysis from CALGB 10403 and the CIBMTR. Leukemia. 2021; 35(7): 2140.(3iA)
2) Dhédin N, et al. Role of allogeneic stem cell transplantation in adult patients with Ph-negative acute lymphoblastic leukemia. Blood. 2015; 125(16): 2486-96.(2Dii)
3) Kako S, et al. Optimal treatment for Philadelphia-negative acute lymphoblastic leukemia in first remission in the era of high-intensity chemotherapy. Int J Hematol. 2021; 114(5): 608-19.(3iiiA)
4) Gökbuget N, et al. Adult patients with acute lymphoblastic leukemia and molecular failure display a poor prognosis and are candidates for stem cell transplantation and targeted therapies. Blood 2012; 120(9): 1868-76.(3iDii)
5) Fujisawa S, et al. Phase II study of imatinib-based chemotherapy for newly diagnosed BCR-ABL-positive acute lymphoblastic leukemia. Am J Hematol. 2017; 92(4): 367-74.(3iiiDi)
6) Ponvilawan B, et al. Is stem cell transplantation still needed for adult Philadelphia chromosome-positive acute lymphoblastic leukemia receiving tyrosine kinase inhibitors therapy?: A systematic review and meta-analysis. PLoS One. 2021; 16(6): e0253896.(3iiiA)
7) Zeng Q, et al. Comparison of allogeneic hematopoietic stem cell transplantation and TKI combined with chemotherapy for adult philadelphia chromosome positive acute lymphoblastic leukemia: a systematic review and meta-analysis. Cancer Med. 2021; 10(24): 8741-53.(3iiiA)
8) Chalandon Y, et al. Randomized study of reduced-intensity chemotherapy combined with imatinib in adults with Ph-positive acute lymphoblastic leukemia. Blood. 2015; 125(24): 3711-9.(1iiDiv)
9) Wang J, et al. Allogeneic Stem Cell Transplantation versus Tyrosine Kinase Inhibitors Combined with Chemotherapy in Patients with Philadelphia Chromosome-Positive Acute Lymphoblastic Leukemia. Biol Blood Marrow Transplant. 2018; 24(4): 741-50.(3iiiA)
CQ6 第一寛解期ALLの同種造血幹細胞移植には骨髄破壊的前処置と減弱前処置のどちらが勧められるか
- 推奨グレード
- カテゴリー2B
45歳以上のALLに対する減弱前処置(RIC)は骨髄破壊的前処置(MAC)と同等の成績であり,両者の相反する特徴である治療関連毒性と再発率を十分に考慮し,適切な前処置を選択する必要がある。
合併症のない45歳未満のALLに対する移植前処置はCPA+TBI 12Gyに中等量のVP16を追加するMACレジメンが有益である。
解説
EBMTから45歳以上ALLの第一または第二寛解期におけるHLA一致同胞間造血幹細胞移植の後方視的比較では2年NRMは21% vs. 29%(RIC vs. MAC)(p=0.03)でMAC群で有意に高く,3年再発率は47% vs. 31%(p<0.001)でRIC群で有意に高かったが,3年生存率は48% vs. 45%で同等であった。多変量解析でもRICは移植関連死亡率が少なく,再発が多い独立した因子として抽出された1)。血縁,非血縁,臍帯血をすべて含む本邦の成人ALLワーキンググループの解析においても3年NRMは36% vs. 38%(RIC vs. MAC)で同等,3年再発率は26% vs. 15%(p=0.008)でRIC群で有意に多いが,3年生存率は53% vs. 51%で同等であった。欧州からの報告と異なり多変量解析にてRICは治療関連死亡率,再発率,生存率のいずれにおいても独立した因子として抽出されなかった。HLA不適合ドナーかつ55歳以上では,RICでのOSが有意に良好であった2)。
本邦ALLワーキンググループの解析では,50歳以上のMRD陰性となったPh陽性ALLにおいてRICはMACと同等の治療成績であり,PS不良とHCT-specific comorbidity index(HCT-CI)高値の症例ではRICの治療成績が有意に良好であった3)。
45歳以上のALLに使用されるRICレジメンはフルダラビン(FLU)をベースに,ブスルファン(BU),メルファラン(MEL),全身照射(total body irradiation:TBI)のいずれかを追加するレジメンが広く使用されている。これら3つのRICレジメンにおける優劣は存在せず,いずれも同等の治療成績であった4)。
ALLに対するMACレジメンではシクロホスファミド(CPA)/TBIに中等量のエトポシド(ETP)の上乗せ効果を後方視的に比較した研究が本邦から報告されている5)。両群間でNRMは同等だが,ETP/CPA/TBI群は再発が有意に少なく(HR 0.75,p=0.05),無白血病生存(LFS)も有意に良好(HR 0.76,p=0.01)であった。サブグループ解析では,adverse riskのCR1とCR2以降の症例でLFSの改善がみられた。本レジメンは45歳未満で合併症の存在しないALL症例の前処置として有益と考えられる。
Ph陽性ALL以外にMRDの有無,すなわち疾患リスクによりRIC/MACの有用性を比較する研究は今のところ存在していない。また,いずれの報告もレジストリデータからの後方視的研究であり,前方視的研究は存在しない。しかし,本邦からのエビデンス創出が多くされていることは有利な点といえる。現時点ではRIC/MACの相反する特徴である治療関連死亡率と再発率を慎重に考慮した上で,各症例に合わせた前処置を選択する必要がある。
参考文献
1) Mohty M, et al. Reduced-intensity versus conventional myeloablative conditioning allogeneic stem cell transplantation for patients with acute lymphoblastic leukemia: a retrospective study from the European Group for Blood and Marrow Transplantation. Blood. 2010; 116(22): 4439-43.(3iA)
2) Tanaka J, et al. Reduced-intensity vs myeloablative conditioning allogeneic hematopoietic SCT for patients aged over 45 years with ALL in remission: a study from the Adult ALL Working Group of the Japan Society for Hematopoietic Cell Transplantation(JSHCT). Bone Marrow Transplant. 2013; 48(11): 1389-94.(3iA)
3) Akahoshi Y, et al. Reduced-intensity conditioning is a reasonable alternative for Philadelphia chromosome-positive acute lymphoblastic leukemia among elderly patients who have achieved negative minimal residual disease: a report from the Adult Acute Lymphoblastic Leukemia Working Group of the JSHCT. Bone Marrow Transplant. 2020; 55(7): 1317-25.(3iA)
4) Peric Z, et al. Comparison of reduced-intensity conditioning regimens in patients with acute lymphoblastic leukemia >45 years undergoing allogeneic stem cell transplantation-a retrospective study by the Acute Leukemia Working Party of EBMT. Bone Marrow Transplant. 2020; 55(8): 1560-9.(3iA)
5) Arai Y, et al. Improved prognosis with additional medium-dose VP16 to CY/TBI in allogeneic transplantation for high risk ALL in adults. Am J Hematol. 2018; 93(1): 47-57.(3iA)
CQ7 Ph陽性ALLに対する移植後TKIの維持療法は勧められるか
- 推奨グレード
- カテゴリー2A
同種移植後MRD陽性となった時点で行う先制的なTKI投与は推奨されるが,MRD陰性の時点で開始する予防的なTKI維持療法は推奨されない。
解説
Ph陽性ALLに対する同種移植後のTKI維持療法には,MRD陰性の状態で開始する予防的なものと,MRD陽性になった時点で開始する先制的なものがある。先制的TKI維持療法を含む広義なTKI維持療法の有効性をランダム化比較試験で検証した研究は存在しないが,同種移植後に広義のTKI維持療法を行う治療は,前方視的単群試験ではヒストリカルコントロールより良好な成績を示し1,2),後方視的コホート研究では非TKI維持療法群より良好な成績を示している3)。TKI維持療法が行われる治療では移植前にもTKI併用療法が行われており,治療成績の改善にTKI維持療法がどの程度寄与しているのかは不明であるという問題はあるが,TKI維持療法を受けた群での治療成績の改善は一貫した傾向として認められる。同種移植後MRDが陰性化しない場合,あるいは陰性化後に陽性となったときにはTKI維持療法を開始するべきである。この際にはABL1遺伝子の変異解析を行い適切なTKIを選択することが望ましい(ただしABL1遺伝子変異解析には保険適用がない)。
予防的TKI維持療法と先制的TKI維持療法の優劣に関しては,ランダム化比較試験で検証した研究がある4)。55例のPh陽性白血病が完全寛解期に同種移植を受け,予防的なイマチニブ(IMA)の投与を行うA群(26例)とMRD陽性化時点で先制的に投与を行うB群(29例)に割り付けられた。分子学的再発率はA群で有意に低かったが(40% vs. 69%,p=0.046),血液学的寛解の維持率(81% vs. 78%),および5年OS(80% vs. 74.5%)の点で両群に差はみられなかった。本邦では,JALSG Ph+ALL213試験において,ダサチニブ(DAS)併用化学療法後同種移植を施行した症例に対して,移植前MRD陽性症例(14例)に対してはDASの予防的投与を,移植前MRD陰性症例(44例)に対しては先制的投与を行うこととして検討が行われた2)。先制的投与群では実際に先制的投与を受けた症例が少なかった(6例)こと,投与を受けた症例は全例分子生物学的寛解を再度得たこと,予防的投与群ではDAS投与に伴う重症有害事象の発生頻度が高かった(8例中6例)ことなどから,DASの予防的投与は推奨されないと判断された。こうした結果より,同種移植後MRD陰性の状態での予防的なTKI維持療法は推奨されない。
参考文献
1) Chen H, et al. Administration of imatinib after allogeneic hematopoietic stem cell transplantation may improve disease-free survival for patients with Philadelphia chromosome-positive acute lymphobla stic leukemia. J Hematol Oncol. 2012; 5: 29.(3iiiDiii)
2) Sugiura I, et al. Dasatinib-based 2-step induction for adults with Philadelphia chromosome-positive acute lymphoblastic leukemia. Blood Adv. 2022; 6(2): 624-36.(3iiiDiii)
3) Brissot E, et al. Tyrosine kinase inhibitors improve long-term outcome of allogeneic hematopoietic stem cell transplantation for adult patients with Philadelphia chromosome positive acute lymphoblastic leukemia. Haematologica. 2015; 100(3): 392-9.(3iiiDiii)
4) Pfeifer H, et al. Randomized comparison of prophylactic and minimal residual disease-triggered imatinib after allogeneic stem cell transplantation for BCR-ABL1-positive acute lymphoblastic leukemia. Leukemia. 2013; 27(6): 1254-62.(1A)
CQ8 第一寛解期ALLに対して造血幹細胞移植を行わない場合,維持療法は勧められるか
- 推奨グレード
- カテゴリー1(Ph陰性),カテゴリー2A(Ph陽性)
第一寛解期で造血幹細胞移植を行わない場合,維持療法は推奨される。Ph陽性症例ではTKIを長期に使用することが推奨される。
解説
1960年代に小児ALLで維持療法の中止と継続でランダム化比較試験が行われ,維持療法の有用性が示されている1)。当時の治療は寛解後療法が極めて不十分で(寛解導入療法の後はすぐ維持療法),これのみで現在の標準治療における維持療法の必要性を判断することは難しい。しかし,その後も日本の小児ALLにおいて,維持療法における6-メルカプトプリン(6-MP)とメトトレキサート(MTX)の投与方法に関して,中等量間歇投与群と少量持続内服群のランダム化比較試験で,前者の方が5年寛解持続率が良好であることが示される(72.1% vs. 49.7%,p<0.05)など2),維持療法の必要性は複数の研究で確認されている。
成人ALLにおいても,Cancer and Leukemia Group B(CALGB)の研究で維持療法を行わないプロトコールを用いたところ,中間解析で過去のCALGBの研究(1年以上の維持療法を行う)に比較して明らかに寛解持続期間が短く,研究が早期終了となったことは維持療法の必要性を示している3)。また,UK Medical CouncilとEastern Cooperative Oncology Groupの共同研究においても,1,929例のALL患者を寛解が得られたのちに,HLA一致血縁ドナーを持つものは同種移植群,ドナーを持たないものを,自家移植群(維持療法なし)と化学療法群(地固め療法,維持療法を行う)にランダム割り付けし(両群ともにMTX大量療法を含む強化療法は行う)比較したところ,自家移植群で有意に5年OSが不良であった(46% vs. 37%,p=0.03)4)。この研究もやはり維持療法の必要性を示している。これらの研究より,Ph陰性ALLの場合,第一寛解期で造血幹細胞移植を行わない場合,維持療法は必要であると考えられる。
Ph陽性症例に対してはイマチニブ(IMA)の登場以降,これを併用した化学療法による研究が多く行われ,従来の治療に比較し,CR率,第一寛解期同種移植の施行率,OSいずれも著しく改善した。しかし同種移植が行われなかった場合,そのOSは各研究によって大きく異なる。IMA併用維持療法を行うが2~3年で治療を終了してしまう研究では移植を受けなかった患者の再発率は78~87%と高い5,6)。一方,IMAの投与を5年または無期限で続ける研究では,同種移植を受けなかった症例でも,DFSがそれぞれ42.7%(3年DFS)7),43%(5年DFS)8)と良好である。これらの研究から,Ph陽性ALLで同種移植を受けない場合には,TKIを含む維持療法が推奨され,TKIは治療開始から5年以上継続することが推奨される。MRDを評価するなどしてTKIをいずれかの時点で中止にできるかどうかは現時点では不明である。
参考文献
1) Lonsdale D, et al. Interrupted vs. continued maintenance therapy in childhood acute leukemia. Cancer. 1975; 36(2): 341-52.(1iiDii)
2) Koizumi S, et al. Comparison of intermittent or continuous methotrexate plus 6-mercaptopurine in regimens for standard-risk acute lymphoblastic leukemia in childhood(JCCLSG-S811). The Japanese Children’s Cancer and Leukemia Study Group. Cancer. 1988; 61(7): 1292-300.(1iiDii)
3) Cuttner J, et al. Phase III trial of brief intensive treatment of adult acute lymphocytic leukemia comparing daunorubicin and mitoxantrone: a CALGB Study. Leukemia. 1991; 5(5): 425-31.(3iDii)
4) Goldstone AH, et al. In adults with standard-risk acute lymphoblastic leukemia, the greatest benefit is achieved from a matched sibling allogeneic transplantation in first complete remission, and an autologous transplantation is less effective than conventional consolidation/maintenance chemotherapy in all patients: final results of the International ALL Trial(MRC UKALL XII/ECOG E2993). Blood. 2008; 111(4): 1827-33.(1iiA)
5) Yanada M, et al. Prospective monitoring of BCR-ABL1 transcript levels in patients with Philadelphia chromosome-positive acute lymphoblastic leukaemia undergoing imatinib-combined chemotherapy. Br J Haematol. 2008; 143(4): 503-10.(3iiiDiv/3iiDii)
6) Bassan R, et al. Chemotherapy-phased imatinib pulses improve long-term outcome of adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia: Northern Italy Leukemia Group protocol 09/00. J Clin Oncol. 2010; 28(22): 3644-52.(3iiiA)
7) Kuang P, et al. Sustaining integrating imatinib and interferon-α into maintenance therapy improves survival of patients with Philadelphia positive acute lymphoblastic leukemia ineligible for allogeneic stem cell transplantation. Leuk Lymphoma. 2016; 57(10): 2321-9.(3iiA)
8) Daver N, et al. Final report of a phase II study of imatinib mesylate with hyper-CVAD for the front-line treatment of adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia. Haematologica. 2015; 100(5): 653-61.(3iiiA)
CQ9 再発ALLに対する再寛解導入療法の選択肢としてどのような治療が勧められるか,CAR-T細胞療法はどのようなときに考慮すべきか
- 推奨グレード
- カテゴリー2B
ALL再発例では前治療歴を考慮した再寛解導入療法を行う。晩期再発例では初回寛解導入療法と同一のレジメンによる再治療も選択肢に入る。
- 推奨グレード
- カテゴリー1
B-ALL再発例では,CD19が陽性であればブリナツモマブが,CD22が陽性であればイノツズマブ オゾガマイシンの使用が推奨される。
- 推奨グレード
- カテゴリー2A
Ph陽性ALLの再発では,イマチニブ使用後であればダサチニブあるいはポナチニブへ,ダサチニブ使用後であればポナチニブへの変更が妥当である。
- 推奨グレード
- カテゴリー2B
T-ALLの再発ではネララビンが治療選択肢に加わる。
- 推奨グレード
- カテゴリー2A
25歳以下の再発・難治性CD19陽性B-ALLの一部(適応の詳細は解説参照)ではCAR-T細胞療法が治療選択肢に加わる。
解説
成人ALLの再発例の予後は一般に不良である。再寛解を得て同種造血幹細胞移植を行うことで長期生存が得られる可能性はあり,それが基本方針であるが,第二寛解率は低く,寛解持続期間は短く,第二寛解期に同種移植を行える症例は多くない。LALA-94試験登録患者のうち初回再発をきたした421例の解析では,第二寛解が得られた割合は44%で,第二寛解期に同種移植が実施できた割合は14%であった1)。5剤(DXR,VCR,L-Asp,CPA,PSL)併用寛解導入療法やhyper-CVAD療法(CPA,VCR,DXR,DEX)などALLの初回寛解導入に用いられるレジメンの中から,当該患者の初回治療で用いられていない薬剤を多く含むレジメンを選択するのが良いとされる。ただし,晩期再発症例では,初回寛解導入療法と同一のレジメンによる再治療も選択肢に入る。以下に記載する新規薬剤を化学療法と併用する場合にはhyper-CVAD療法(あるいはその改変版)が新規薬剤との併用レジメンのエビデンスがあり有力な選択肢である。
イノツズマブ オゾガマイシン(InO)は,B細胞特異抗原であるCD22に対するヒト化モノクローナル抗体と細胞障害性化合物カリケアマイシンの複合体である。再発・難治性前駆B細胞ALLに対し,ランダム化比較試験で有意にCR率を改善させた(81% vs. 29%)。一方で,veno-occlusive disease(VOD)が全体で11%に,InO投与後に同種移植を受けた症例では21%に認められたため注意が必要である2)。ブリナツモマブ(BLINA)はB細胞特異抗原であるCD19に対するモノクローナル抗体とT細胞特異抗原であるCD3に対するモノクローナル抗体をリンカーで結合させた特殊なモノクローナル抗体製剤であり,B細胞性腫瘍細胞とT細胞を架橋し,T細胞を介した免疫反応を誘導する薬剤である。再発・難治性B-ALLに対し,ランダム化比較試験で有意にCR率を改善させた(34% vs. 16%)3)。BLINAは骨髄抑制が軽度で比較的安全性が高いため,同種移植への橋渡し治療としても優れている。InO後の同種移植におけるVOD発症に関しても,InO併用化学療法による寛解導入療法後に地固め療法としてBLINA治療を行った後に同種移植を行うことでVOD発症を抑制できたという報告がある4)。
イマチニブ(IMA)継続中,あるいは使用後のPh陽性ALLの再発ではBCR::ABL1遺伝子にIMA抵抗性の変異が存在することが多い。第二世代TKIであるダサチニブ(DAS)はIMA抵抗性変異を持つBCR::ABL1に対しても,T315I変異を除く多くの場合に阻害活性を持つ。IMA継続中のPh陽性ALLの再発例を対象としたDAS単剤療法の第Ⅱ相試験では,血液学的奏効率が42%で,数カ月間奏効が維持できることが示されており5),IMA抵抗性変異を獲得した患者の一部ではDASが有効であることが示唆される。第三世代TKIであるポナチニブ(PON)は,DAS抵抗性BCR::ABL1変異であるT315I変異を持つBCR::ABL1に対しても阻害活性を持つ。DASあるいはニロチニブ(NIL)に対して治療抵抗性または不耐容例,およびBCR::ABL1 T315I陽性例を対象にした試験で,PONは有効性を示している6)。本来は再発時にABL1変異解析を行い,TKI抵抗性変異の存在と種類を確認し,適切なTKIを選択するのが望ましいが,現時点ではABL1変異解析には保険適用がない。InOとBLINAは再発Ph陽性ALLに対しても治療効果があることが示されており,これらをTKIと併用することも選択肢として挙げられる。
T-ALLの再発・難治例ではネララビン(NEL)療法の有効性が示されている。CALGBが行った第Ⅱ相試験で,多くの前治療歴を有するT-ALLの患者において全奏効率が41%であった7)。
CAR-T細胞療法はキメラ抗原受容体遺伝子を導入した患者T細胞(CAR-T細胞)を輸注することで行う細胞療法で,25歳以下の再発・難治性CD19陽性B-ALLの一部に対してはCD19CAR-T細胞であるチサゲンレクルユーセル(Tisa-Cel)が承認されている。本剤は,再発・難治性CD19陽性B-ALLのうち,初発の患者では標準的な化学療法を2回以上施行したが寛解が得られない場合,再発の患者では化学療法を1回以上施行したが寛解が得られない場合,同種造血幹細胞移植の適応とならない,または同種造血幹細胞移植後に再発した場合に使用可能となっている。治験において,再発・難治性CD19陽性B-ALLに対し81%にCRをもたらすなど高い有効性を示したが,77%でサイトカイン放出症候群を起こすなど特異的な重症有害事象も報告された8)。そのため本邦においては,安全性に配慮して限定された登録施設のみで治療を実施することとなっている。CAR-T細胞療法は超高額医療であるため,実施決定にあたっては保険適用を遵守する必要がある。本剤製造のためのアフェレーシス産物の発送から製品着荷までに6週間程度の時間がかかることに留意し,治療実施施設との連絡を早期にとるようにする。
参考文献
1) Tavernier E, et al. Outcome of treatment after first relapse in adults with acute lymphoblastic leukemia initially treated by the LALA-94 trial. Leukemia. 2007; 21(9): 1907-14.(3iiA)
2) Kantarjian HM, et al. Inotuzumab Ozogamicin versus Standard Therapy for Acute Lymphoblastic Leukemia. N Engl J Med. 2016; 375(8): 740-53.(1iiA)
3) Kantarjian H, et al. Blinatumomab versus Chemotherapy for Advanced Acute Lymphoblastic Leukemia. N Engl J Med. 2017; 376(9): 836-47.(1iiA)
4) Jabbour E, et al. Chemoimmunotherapy with inotuzumab ozogamicin combined with mini-hyper-CVD, with or without blinatumomab, is highly effective in patients with Philadelphia chromosome-negative acute lymphoblastic leukemia in first salvage. Cancer. 2018; 124(20): 4044-55.(3iiiA)
5) Ottmann O, et al. Dasatinib induces rapid hematologic and cytogenetic responses in adult patients with Philadelphia chromosome positive acute lymphoblastic leukemia with resistance or intolerance to imatinib: interim results of a phase 2 study. Blood. 2007; 110(7): 2309-15.(3iDiv)
6) Cortes JE, et al. A phase 2 trial of ponatinib in Philadelphia chromosome-positive leukemias. N Engl J Med. 2013; 369(19): 1783-96.(3iiiDiv)
7) DeAngelo DJ, et al. Nelarabine induces complete remissions in adults with relapsed or refractory T-lineage acute lymphoblastic leukemia or lymphoblastic lymphoma: Cancer and Leukemia Group B study 19801. Blood. 2007; 109(12): 5136-42.(3iiiDiv)
8) Maude SL, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med. 2018; 378(5): 439-48.(3iiiDiv)
CQ10 初発Ph陰性ALLに対してT細胞性ALLとB細胞性ALLは同様の治療が勧められるか
- 推奨グレード
- カテゴリー2B
T-ALLは治療層別化因子にはなり得るが,B-ALLと別個の治療法は確立していない。
解説
T-ALLは,B-ALLに比べ小児では予後不良とされるが,成人では明確な差は認められていない1)。しかし,小児では予後良好因子を持つB-ALLが多いこと,成人ではTKIが登場する以前は特に難治性であったPh陽性ALLがB-ALLに多く含まれていることなどの影響を考慮する必要がある2)。成人においては,高齢者を含めT-ALLとB-ALLは同じ治療法が行われており,T-ALLを個別に治療した大規模な臨床試験の報告はない。近年,思春期・若年成人(AYA)世代においては,小児型の治療法がこれまで成人に行われていた治療法より優れているとされ3),対象年齢を高めた層にも小児型治療法を試みる臨床試験が行われている。小児プロトコールは成人における治療法に比べ,ステロイド,ビンクリスチン(VCR),L-アスパラギナーゼ(L-Asp)の投与量およびCNS浸潤の予防が多く,また,治療開始前の予後因子,初期治療反応性,寛解後のMRDの有無により造血幹細胞移植を含めた治療層別化が行われていることが特徴である。小児においても,T-ALLはB-ALLと同一のプロトコールで治療されていることが多いが,T-ALLはB-ALLに比べ,発症年齢が高い,予後良好な遺伝子変異が少ない,診断時に著明な白血球数増加,前縦隔腫瘤などの髄外腫瘤を伴っていることが多く,T-ALLを予後不良因子として層別化している治療法もある4,5)。これまでの成人に対する小児型治療法の報告は,ランダム化比較試験ではなく,T-ALL自体が予後不良として層別化されていないものもあるが,治療成績はこれまでの成人型治療法に比べて優れており,B-ALLとT-ALLの治療成績に違いはなかった6-10)。T-ALLに対する治療法としては,大量メトトレキサート(MTX)およびT-ALLに有効なネララビン(NEL)の効果を評価したランダム化比較試験が報告されている11,12)。小児を中心に31歳までのAYA世代を対象にした試験で,小児型治療法を骨格とした治療において,MTXが低用量から開始され漸次増量されるCapizziスタイルのMTX投与群よりも大量MTX投与群の方が劣っており,またNELについてはNEL使用群の治療成績が優れていた。一方,成人型治療法においてもNELを併用した治療成績が報告されているが,既存の治療法と比べ生存期間の延長は認められていない13)。なお,NELは初発ALLには保険適用の問題がある。ALLにおいても発症に関わる分子機構は徐々に明らかになってきている。T-ALLはB-ALLとは異なる分子病態,臨床的特徴を有し,さらに治療に対する反応性および有効な薬剤が異なる。将来はT-ALLとB-ALLでは異なった薬剤を使用した治療戦略が確立されると予想される。
参考文献
1) Marks DI, et al. T-cell acute lymphoblastic leukemia in adults: clinical features, immunophenotype, cytogenetics, and outcome from the large randomized prospective trial(UKALL XII/ECOG 2993). Blood. 2009; 114(25): 5136-45.(1iiA/3iiiA)
2) Jinnai I, et al. Intensified consolidation therapy with dose-escalated doxorubicin did not improve the prognosis of adults with acute lymphoblastic leukemia: the JALSG-ALL97 study Int J Hematol. 2010; 92(3): 490-502.(3iiiDiv)
3) Stock W, et al. What determines the outcomes for adolescents and young adults with acute lymphoblastic leukemia treated on cooperative group protocols? A comparison of Children’s Cancer Group and Cancer and Leukemia Group B studies. Blood. 2008; 112(5): 1646-54.(3iiiDiv)
4) Möricke A, et al. Risk-adjusted therapy of acute lymphoblastic leukemia can decrease treatment burden and improve survival: treatment results of 2169 unselected pediatric and adolescent patients enrolled in the trial ALL-BFM 95. Blood. 2008; 111(9): 4477-89.(3iiiDiv)
5) Goldberg JM, et al. Childhood T-cell acute lymphoblastic leukemia: the Dana-Farber Cancer Institute acute lymphoblastic leukemia consortium experience. J Clin Oncol. 2003; 21(19): 3616-22.(3iiiDiv)
6) Huguet F, et al. Pediatric-inspired therapy in adults with Philadelphia chromosome-negative acute lymphoblastic leukemia: the GRAALL-2003 Study. J Clin Oncol. 2009; 27(6): 911-8.(3iiiDi)
7) Hayakawa F, et al. Markedly improved outcomes and acceptable toxicity in adolescents and young adults with acute lymphoblastic leukemia following treatment with a pediatric protocol: a phase II study by the Japan Adult Leukemia Study Group. Blood Cancer J. 2014; 4(10): e252.(3iiiDii)
8) Stock W, et al. A pediatric regimen for older adolescents and young adults with acute lymphoblastic leukemia: results of CALGB 10403. Blood. 2019; 133(14): 1548-59.(3iiiA)
9) Toft N, et al. Results of NOPHO ALL2008 treatment for patients aged 1-45 years with acute lymphoblastic leukemia. Leukemia. 2018; 32(3): 606-15.(3iiiDiv)
10)Quist-Paulsen P, et al. T-cell acute lymphoblastic leukemia in patients 1-45 years treated with the pediatric NOPHO ALL2008 protocol. Leukemia. 2020; 34(2): 347-57.(3iiiDiv)
11)Winter SS, et al. Improved Survival for Children and Young Adults With T-Lineage Acute Lymphoblastic Leukemia: Results From the Children’s Oncology Group AALL0434 Methotrexate Randomization. J Clin Oncol. 2018; 36(29): 2926-34.(1iiDi)
12)Dunsmore KP, et al. Children’s Oncology Group AALL0434: A Phase III Randomized Clinical Trial Testing Nelarabine in Newly Diagnosed T-Cell Acute Lymphoblastic Leukemia. J Clin Oncol. 2020; 38(28): 3282-93.(1iiDii)
13)Abaza Y, et al. Hyper-CVAD plus nelarabine in newly diagnosed adult T-cell acute lymphoblastic leukemia and T-lymphoblastic lymphoma. Am J Hematol. 2018; 93(1): 91-9.(3iiiDiv)
CQ11 成人(40~64歳)Ph陰性ALLにはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
成人型治療を用いる場合には大量メトトレキサートが組み込まれているレジメンが推奨される。また,成人用に改編した小児型治療を40~64歳に用いる場合には年齢層ごとに薬剤量を調節するなどの工夫が必要である。
解説
40~64歳のPh陰性ALLに対する化学療法をまとめた論文は見当たらないが,2000年代半ば以降に発表された成人ALLの治療成績を表1に示す。CR率は,74~94%,OSは32~60%である。OSに関しては,予後因子に応じて造血幹細胞移植が組み込まれている臨床試験が多く,化学療法単独の治療成績とはいえないことに注意が必要である。
この年代に対する臨床試験は,成人型治療を用いた研究と成人用に改編した小児型治療を用いた研究とがある。成人型治療では,MDアンダーソンがんセンターから報告されているhyper-CVAD/MA療法(CPA,VCR,DXR,DEX,大量MTX,大量AraC)では,40~59歳82例でCR率94%,5年OS 30%,60歳以上59例で,CR率80%,5年OS 17%であった1)。同じく成人型治療であるJALSG ALL97試験では,Ph陰性ALL症例のサブグループ解析でCR率 81%,5年OS 39%であり,このうち35~54歳はCR率80%,5年OS 38%,55~64歳はCR率78%,5年OS 26%であった2)。また,成人型治療に大量メトトレキサート(MTX)を併用したJALSG ALL202-O試験では,25~64歳を対象とし,CR率86%,5年OS 64%であり,比較対象とした中等量MTXの5年OS 48%に対し有意に良好であった3)。
表1 成人ALLの治療成績
| 試験名 | 発表年 | 研究期間 | 症例数 | 年齢中央値(range) | SCT | Ph | 治療型 | 寛解率 | 全生存率 |
|---|---|---|---|---|---|---|---|---|---|
| Hyper-CVAD | 2004 | 1992~2000 | 288 |
40 (15~92) |
yes | yes | 成人型 | 92% |
38% (5年) |
| LALA 94 | 2004 | 1994~2002 | 922 |
33 (15~55) |
yes | yes | 成人型 | 84% |
33% (5年) |
| MRC UKALL XII/ECOG E2993 | 2005 | 1993~2003 | 1,521 | 15~59 | yes | yes | 成人型 | 91% |
38% (5年) |
| GMALL 07/2003 | 2007 | 2003~2006 | 713 |
34 (15~55) |
yes | yes | 小児型 | 89% |
54% (5年) |
| SWOG 9400 | 2008 | 1995~2000 | 200 | 15~65 | yes | yes |
成人型 80% |
33% (5年) |
SWOG 9400 |
| GRALL-2003 | 2009 | 2003~2005 | 225 |
31 (15~60) |
yes | no | 小児型 | 94% |
60% (42カ月) |
| JALSG ALL 97 | 2010 | 1997~2001 | 404 |
38 (15~64) |
yes | yes | 成人型 | 74% |
32% (5年) |
| JALSG ALL202-O(高用量MTX群) | 2018 | 2002~2011 | 343 |
43 (25~64) |
no | no | 成人型 | 86% |
58% (5年) |
| GRAALL-2005 | 2018 | 2006~2014 | 787 |
36 (18~59) |
no | no | 小児型 | 92% |
58.50% (5年) |
成人用に改編した小児型治療を用いた報告では,カナダのプリンセスマーガレット病院からは(DFCI91-01を改編したプロトコールを)18~60歳(年齢中央値37歳)まで適応した結果が報告されている。CR率は35歳以下98%に対し,36~49歳86%,50~60歳73%,と加齢とともに低下し,3年OSも35歳以下83%に対し,36歳以上では52%へ低下した4)。フランスのGRAALL-2005では,18~59歳(年齢中央値36.1歳)を対象に成人用改編小児型治療を用い,35~44歳(171例),45~54歳(151例),55~59歳(93例)でそれぞれCR率は89.5%,89.4%,79.6%であり,また5年OSが60.3%,58.0%,25.1%であった。55歳以上で治療成績が著明に低下し,次の臨床研究から毒性の高かった45歳以上で用量設定を変更したことが報告された5)。
以上より,成人型治療を用いる場合には大量MTXが組み込まれているレジメンを用いることが推奨され,また,成人用に改編した小児型治療を40~64歳に用いる場合には年齢層ごとに薬剤量を調節するなどの工夫が必要である。
L-aspについてはアスパラギナーゼに対する抗体産生によるアスパラギナーゼ活性の低下または失活,過敏反応が問題となっている。これらを改善するために本邦では2023年6月にErwinia chrysanthemi由来のアスパラギナーゼであるクリサンタスパーゼ,2023年10月にE.cloi由来アスパラギナーゼをpolyethylene glycol(PEG)で化学修飾したPEG-アスパラギナーゼ(PEG-asp)が上市された。しかし,クリサンタスパーゼの効果はL-aspの効果より弱いという報告もあり,クリサンタスパーゼの使用はL-aspあるいはPEG-aspを使えない症例に限るべきである。PEG-aspは成人における投与量,投与方法が確立していないので現時点では臨床試験内での使用が望ましい。
参考文献
1)Kantarjian H, et al. Long-term follow-up results of hyperfractionated cyclophosphamide, vincristine, doxorubicin, and dexamethasone (Hyper-CVAD), a dose-intensive regimen, in adult acute lymphocytic leukemia. Cancer. 2004; 101(12): 2788-801.(3iiA)
2)Jinnai I, et al. Intensified consolidation therapy with dose-escalated doxorubicin did not improve the prognosis of adults with acute lymphoblastic leukemia: the JALSG-ALL97 study. Int J Hematol. 2010; 92(3): 490-502.(3iiiDiv)
3)Sakura T, et al. High-dose methotrexate therapy significantly improved survival of adult acute lymphoblastic leukemia: a phase III study by JALSG. Leukemia. 2018; 32(3): 626-32.(1iiDii)
4)Storring JM, et al. Treatment of adults with BCR-ABL negative acute lymphoblastic leukaemia with a modified paediatric regimen. Br J Haematol. 2009; 146(1): 76-85.(3iiDiv)
5)Huguet F, et al. Intensified Therapy of Acute Lymphoblastic Leukemia in Adults: Report of the Randomized GRAALL-2005 Clinical Trial. J Clin Oncol. 2018; 36(24): 2514-23.(1iiDi)
CQ12 骨髄浸潤のないLBLにはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
骨髄浸潤の有無にかかわらず,LBLに対する化学療法はALLと同等の強度が推奨される。
- 推奨グレード
- カテゴリー2B
縦隔病変が存在するT細胞性LBL(T-LBL)で治療経過中に縦隔病変が残存する例には縦隔への放射線療法は有効である。
解説
LBLに対する化学療法はリンパ腫レジメンよりもALLレジメンの有用性が示されている。ALLレジメンではhyper-CVAD/MA交替療法(CPA,VCR,DXR,DEX,大量MTX,大量AraC)1),ドイツのBerlin-Frankfurt-Munster(BFM)レジメンいずれも有用性が示されている2)。また,18~59歳の成人LBLに対する小児ALLレジメンは3年DFS,OSがそれぞれ72.4%,69.2%と良好な成績が示された3)。本プロトコールでは中枢神経照射,2年間の維持療法が含まれ,多変量解析において年齢(45歳以上 vs. 45歳未満)は有意なリスク因子とはならなかった。現時点で,hyper-CVAD/MA交替療法,BFM,小児ALLレジメンの有用性を直接比較するデータは存在していない。
T細胞性LBL(T-LBL)の7割が縦隔病変を有し,縦隔病変に対する同部位への放射線療法あるいは全脳照射が試みられてきた。しかし,成人LBL,小児T-LBLともに全脳照射およびALLレジメンにより,縦隔への放射線療法を行わずとも良好な治療成績が示されている3,4)。成人LBLに対する小児ALLレジメンを施行した前述の臨床試験では,維持療法に入る前に全脳照射を行い,寛解導入療法後のFDG-PET陽性所見は予後と関連しないと報告されている3)。一方で,BFMレジメンにおける寛解導入療法後あるいはhyper-CVAD療法2コース終了後のFDG-PET陽性例では有意にDFS,OSが低下することが示されている5)。本研究ではFDG-PET陽性例に対して放射線療法は行われていなかった。また,成人LBLにおいて大量MTX/AraC 2コース終了後のCTで縦隔病変が残存している症例については同部位への24Gyの放射線療法により縦隔再発を4.5%まで低下することが示されている6)。本試験では初発時縦隔病変の有無は再発率,生存率に影響しなかった。LBLに対する縦隔照射と全脳照射の両者を比較した試験は存在していないが,放射線療法による中枢神経への影響を勘案すると,予防的な全脳照射よりも残存病変への縦隔照射が優れた治療といえる。また,International Lymphoma Radiation Oncology Group(ILROG)ガイドラインでは,縦隔照射30~36Gy,1回線量1.8~2Gyが推奨されている7)。
参考文献
1)Thomas DA, et al. Outcome with the hyper-CVAD regimens in lymphoblastic lymphoma. Blood. 2004; 104(6): 1624-30.(3iiiA)
2)Burkhardt B, et al. Impact of cranial radiotherapy on central nervous system prophylaxis in children and adolescents with central nervous system-negative stage III or IV lymphoblastic lymphoma. J Clin Oncol. 2006; 24(3): 491-9.(3iiiB)
3)Lepretre S, et al. Pediatric-Like Acute Lymphoblastic Leukemia Therapy in Adults With Lymphoblastic Lymphoma: The GRAALL-LYSA LL03 Study. J Clin Oncol. 2016; 34(6): 572-80.(3iiiA)
4)Reiter A, et al. Intensive ALL-type therapy without local radiotherapy provides a 90% event-free survival for children with T-cell lymphoblastic lymphoma: a BFM group report. Blood. 2000; 95(2): 416-21.(3iiiDi)
5)Wang L, et al. Interim PET-CT may predict PFS and OS in T-ALL/LBL adult patients. Oncotarget. 2017; 8(58): 99104-11.(3iiiA)
6)Cortelazzo S, et al. Results of a lymphoblastic leukemia-like chemotherapy program with risk-adapted mediastinal irradiation and stem cell transplantation for adult patients with lymphoblastic lymphoma. Ann Hematol. 2012; 91(1): 73-82.(3iiiA)
7)Dabaja BS, et al. Lymphoblastic Lymphoma: Guidelines From the International Lymphoma Radiation Oncology Group(ILROG). Int H Radiat Oncol Biol Phys. 2018; 102(3): 508-14.
CQ13 高齢者(65歳以上)Ph陰性ALLにはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
高齢者Ph陰性ALLに対する標準的な治療法は開発段階である。多剤併用化学療法か,緩和的ステロイド治療かは患者の状態によって選択する。
解説
65歳以上の高齢者かつPh陰性ALLを対象とした前方向視的試験の報告は非常に限定的であり,標準治療は開発段階である。前方向視的試験としてはスペインのPETHEMAから56~79歳(年齢中央値66歳)を対象としたALL-OLD07で,CR率74%,OS中央値12.4カ月と報告されている1)。また,57~89歳(年齢中央値67歳)でCharlson Comorbidity Index 4以上のフレイル症例を対象としたALL-07FRAILでは,CR率は54%,OS中央値は7.6カ月であった2)。
65歳以上の高齢者は,若年者に比べ複数の既往歴および合併症を有している割合が高く,化学療法に必要な臓器機能が保たれていない場合も少なくない3)。そのため,高齢者に対する全身的化学療法は,有害事象や治療関連死の比率が高くなる。合併症,PS,日常生活動作(Activities of Daily Living:ADL),手段的日常動作(Instrumental Activities of Daily Living:IADLs)など全身状態を評価し,治療強度を決めることが大切である。治療強度は基本的に骨髄抑制的薬剤の有無およびその投与量により決まる。全身状態に応じてALL治療のキードラッグであるL−アスパラギナーゼ(L-Asp)やアントラサイクリン系薬剤,骨髄抑制的薬剤の減量を検討する。
低強度レジメンとしては,ビンクリスチン(VCR)+プレドニゾロン(PSL)4),POMP療法(PSL,VCR,MTX,6-MP)5),中等度レジメンとしては,GMALL療法(IDR,DEX,VCR,CPA,AraC)6),PETHEMA-ALLOLD07(VCR,DEX,IDR,CPA,AraC,MTX,L-Asp)1),GRAALL療法(DXR,VCR,DEX,AraC,CPA)7),modified DFCI91-01療法(DEX,DXR,VCR,MTX,L-Asp,6-MP,髄注)8)が,高強度レジメンとしては,hyper-CVAD/MA療法(CPA,VCR,DXR,大量MTX,大量AraC《1g/m2》)9)が参考となる。
参考文献
1) Ribera JM, et al. Feasibility and results of subtype-oriented protocols in older adults and fit elderly patients with acute lymphoblastic leukemia: Results of three prospective parallel trials from the PETHEMA group. Leukemia Res. 2016; 41: 12-20.(3iiDiv)
2) Ribera JM, et al. Treatment of Frail Older Adults and Elderly Patients With Philadelphia Chromosome-negative Acute Lymphoblastic Leukemia: Results of a Prospective Trial With Minimal Chemotherapy. Clin Lymphoma Myeloma Leuk. 2020; 20(8): e513-22.(3iiDiv)
3) Gökbuget N. How I treat older patients with ALL. Blood. 2013; 122(8): 1366-75.(レビュー)
4) Hardisty RM, et al. Vincristine and prednisone for the induction of remissions in acute childhood leukaemia. Br Med J. 1969; 2(5658): 662-5.(3iiiDiv)
5) Berry DH, et al. Comparison of prednisolone, vincristine, methotrexate and 6-mercaptopurine vs. 6-mercaptopurine and prednisone maintenance therapy in childhood acute leukemia: a Southwest Oncology Group Study. Cancer.1980; 46(5): 1098-103.(1iiDi)
6) Goekbuget N, et al. Moderate Intensive Chemotherapy Including CNS-Prophylaxis with Liposomal Cytarabine Is Feasible and effective in Older Patients with Ph-Negative Acute Lymphoblastic Leukemia(ALL): Results of a Prospective Trial From the German Multicenter Study Group for Adult ALL(GMALL). Blood. 2012; 120(21): 1493.(3iiiDiv)
7) Hunault-Berger M, et al. A randomized study of pegylated liposomal doxorubicin versus continuous-infusion doxorubicin in elderly patients with acute lymphoblastic leukemia:the GRAALL-SA1 study. Haematologica. 2011; 96(2): 245-52.(3iDiv)
8) Martell MP, et al. Treatment of elderly patients with acute lymphoblastic leukaemia using a paediatric-based protocol. Br J Haematol. 2013; 163(4): 458-64.(3iiiDiv)
9) O’Brien S, et al. Results of the hyperfractionated cyclophosphamide, vincristine, doxorubicin, and dexamethasone regimen in elderly patients with acute lymphocytic leukemia. Cancer. 2008; 113(8): 2097-101.(3iiiDiv)

