第Ⅰ章 白血病
Ⅰ 白血病
2 急性前骨髄球性白血病
(acute promyelocytic leukemia:APL)
総論
急性前骨髄球性白血病(acute promyelocytic leukemia:APL)は急性骨髄性白血病(acute myeloid leukemia:AML)の一病型で,WHO分類(2017)では反復性遺伝子異常PML::RARAを伴うAPLとされる1)。典型例ではt(15;17)(q24.1;q21.2)の染色体異常を認める。骨髄において,豊富なアズール顆粒を有し,束状のアウエル小体(ファゴット細胞)や核形不整のある異常前骨髄球の腫瘍性増殖が認められるのが一般的であるが,顆粒の微細な(少ない)タイプもある。ペルオキシダーゼ染色は顆粒の微細なタイプも含め強陽性となり,表面マーカーではCD13・CD33陽性,HLA-DR・CD34陰性のことが多い。正常造血の抑制による貧血,感染症および出血に加えて,APL細胞に由来する線溶亢進型の播種性血管内凝固(disseminated intravascular coagulation:DIC)による強い出血傾向を特徴とする。AMLの10~15%を占め,30~50歳代に多く,60歳以上で減少する。
APLでは,稀にPML::RARAの検出されないvariant RARA translocationsも存在する1)。そのうち最も頻度の高い(APLの約0.8%)亜型はt(11;17)/PLZF(ZBTB16)::RARAであり,t(17;17)/STAT5B::RARAとともに,全トランス型レチノイン酸(all-trans retinoic acid:ATRA)のみならず亜ヒ酸(arsenic trioxide:ATO)も無効であるため注意が必要である2)。Variant RARA translocationsはいずれも特定の遺伝子が17番染色体上のRARAと転座するため,FISH検査でPML::RARAの融合シグナルは陰性となるが,RARAシグナル数の異常を認める。APLの診断の際には,FISH法やRT-PCR法によりt(15;17)染色体異常およびPML::RARA融合遺伝子を早期に検出することが重要である。
APLの発症には,t(15;17)染色体異常が存在するだけでは不十分で,その他の遺伝子異常が必要とされる。網羅的遺伝子解析では,診断時のAPL細胞において,FLT3-ITD変異や-TKD変異をはじめ,WT1,NRAS,KRAS,ARID1A,ARID1Bなどに遺伝子変異を認めている3)。これらの主にシグナル伝達経路の活性化変異はPML::RARAと協調して発症に関与していると考えられる。他のAMLで頻度が高いDNMT3A,NPM1,TET2,ASXL1およびIDH1/2などの異常の頻度はAPLでは低い。
未治療APLに対する本邦での標準治療はATRAとアントラサイクリン系薬剤を中心とする抗がん薬の併用療法であり,70歳以下では90%を超える完全寛解(CR)率や80%近い長期生存率を得られる4)。APL治療の課題は,DICとAPL分化症候群(differentiation syndrome:DS)に伴う早期死亡対策と,治療前白血球数10,000/μL以上など高リスク症例に対する治療の確立である。Japan Adult Leukemia Study Group(JALSG)APL204試験では,初回寛解導入療法開始後30日目までの早期死亡は約5%にみられ,大多数は出血合併症もしくはDSによるものであった5)。APL寛解導入療法にあたっては,速やかにATRAの投与を開始し,血小板値・フィブリノゲン値の維持につとめることで,DICによる重篤な臓器出血を予防する。DSに関しては,発熱・呼吸困難・胸水貯留など症状・所見が一つでも出現した疑い段階で早期に治療介入する必要がある。
APLの無病生存に対する予後因子は治療前白血球数である6,7)。Sanz分類では,治療前白血球数>10,000/μLを高リスク,白血球数≦10,000/μLかつ血小板数≦40,000/μLを中間リスク,白血球数≦10,000/μLかつ血小板数>40,000/μLを低リスクと分類している7),一般には高リスクと標準(低・中間)リスクに分けて,層別化した治療が行われる。
APLではFLT3-ITD変異が12~38%に認められる8)。FLT3-ITD変異は白血球数高値と関連があるとの報告が多いが,予後に関しては一定した見解が得られていない。ただPicharskiらは,24報のメタアナリシスで,FLT3-ITD変異や-TKD変異と予後不良の関連性を報告している9)。また,ドイツ10)およびスペインPETHEMA11)の後方視的検討では,FLT3-ITD/wild typeの比が,それぞれ0.66および0.5以上の場合,RFSなどで劣ることを報告している。
CD56陽性(カットオフ値10%以上)はAPLの10~15%に認められ,白血球数とは独立した再発の予後不良因子である12)。
APLでは他のがん腫の治療後に発症する治療関連APLが知られている。レビューによると治療関連APLはトポイソメラーゼⅡ阻害薬投与歴や放射線照射歴が発症のリスク因子とされる。de novo APLに比べて寛解率に遜色はないため,心毒性や前治療の影響を考慮しつつ,de novo APL同様の治療を行うことが望ましいとされる13)。
骨髄細胞のPML::RARAは分子学的寛解の判定に有用である。血液学的寛解達成時には半数が陽性であるが,地固め療法終了時には陰性化させる必要がある。経過観察中に再陽性化した例では分子学的再発として早期の治療再開が勧められる。
欧米での標準リスクAPLに対する標準治療はATRA+ATOの併用療法である(国内保険適用外)14,15)。ATOはATRAと協調してAPL細胞を効率的にアポトーシスに導くことができ,骨髄抑制などの毒性があまり強くないことから,現在,本邦でAPLの標準治療となっているATRAと化学療法の併用療法に比べて,効果や安全性の面で優っていると考えられる。
参考文献
1) Arber DA, et al. Acute Myeloid Leukaemia with recurrent genetic abnormalities. Acute promyelocytic leukaemia with PML-RARA. WHO classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, IARC, 2017; pp134-6.(テキストブック)
2) Sobas M, et al. PLZF-RARα, NPM1-RARα, and Other Acute Promyelocytic Leukemia Variants: The PETHEMA Registry Experience and Systematic Literature Review. Cancers(Basel). 2020; 12(5): 1313.(レビュー)
3) Madan V, et al. Comprehensive mutational analysis of primary and relapse acute promyelocytic leukemia. Leukemia 2016; 30(8): 1672-81.
4) Takeshita A, et al. Tamibarotene maintenance improved relapse-free survival of acute promyelocytic leukemia: a final result of prospective, randomized, JALSG-APL204 study. Leukemia. 2019; 33(2): 358-70.(1iiDii)
5) Minamiguchi H, et al. Predictors of early death, serious hemorrhage, and differentiation syndrome in Japanese patients with acute promyelocytic leukemia. Ann Hematol. 2020; 99(12): 2787-800.(2Div)
6) Asou N, et al. Analysis of prognostic factors in newly diagnosed acute promyelocytic leukemia treated with all-trans retinoic acid and chemotherapy. Japan Adult Leukemia Study Group. J Clin Oncol 1998; 16(1): 78-85.(1iiDii)
7) Sanz MA, et al. Definition of relapse risk and role of nonanthracycline drugs for consolidation in patients with acute promyelocytic leukemia: a joint study of the PETHEMA and GIMEMA cooperative groups. Blood 2000; 96(4): 1247-53.(1iiDii)
8) Beitinjaneh A, et al. Prognostic significance of FLT3 internal tandem duplication and tyrosine kinase domain mutations in acute promyelocytic leukemia: a systematic review. Leuk Res. 2010; 34(7): 831-6. (レビュー)
9) Picharski GL, et al. The Impact of Flt3 Gene Mutations in Acute Promyelocytic Leukemia: A Meta-Analysis. Cancers. 2019; 11(9): 1311.(3iiiA)
10)Schnittger S, et al. Clinical impact of FLT3 mutation load in acute promyelocytic leukemia with t(15;17)/PML-RARA. Haematologica. 2011; 96(12): 1799-807.(2iiDii)
11)Chillón MC, et al. Long FLT3 internal tandem duplications and reduced PML-RARα expression at diagnosis characterize a high-risk subgroup of acute promyelocytic leukemia patients. Haematologica. 2010; 95(5): 745-51.(2iiDii)
12)Takeshita A, et al. Impact of CD56 Continuously Recognizable as Prognostic Value of Acute Promyelocytic Leukemia: Results of Multivariate Analyses in the Japan Adult Leukemia Study Group(JALSG)-APL204 Study and a Review of the Literature. Cancers(Basel). 2020; 12(6): 1444.(2iiDii)
13)Rashidi A, Fisher SI. Therapy-related acute promyelocytic leukemia: a systematic review. Med Oncol. 2013; 30(3): 625.(レビュー)
14)Sanz MA, et al. Management of acute promyelocytic leukemia: updated recommendations from an expert panel of the European LeukemiaNet. Blood 2019; 133(15): 1630-43(ガイドライン)
15)NCCN Clinical Practice Guidelines in Oncology. Acute Myeloid Leukemia. Version 1.2022(ガイドライン)
アルゴリズム
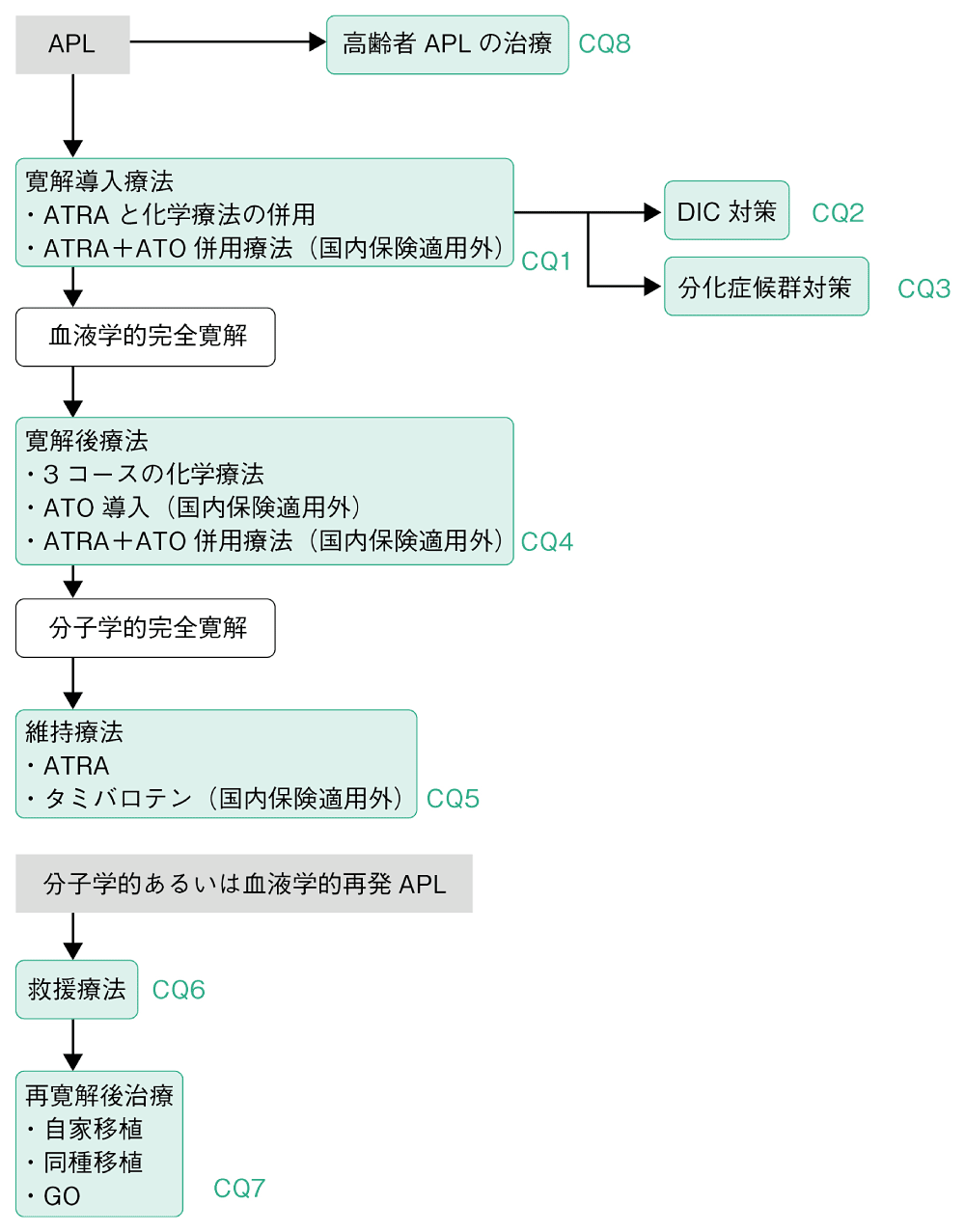
初発APLの寛解導入療法(CQ1)ではATRAと化学療法の併用が標準治療である。初回寛解導入療法では治療抵抗例は稀であり,DICによる重篤な出血やAPL分化症候群(DS)などによる早期死亡が非寛解の主因である。したがって,DIC対策(CQ2)とAPL分化症候群対策(CQ3)が重要である。
血液学的寛解が得られた後,3コースの化学療法からなる寛解後療法(CQ4)を行い,RQ-PCR法を用いた骨髄細胞のPML::RARA陰性化による分子学的寛解への到達を目指す。寛解後療法におけるATRAの併用やATOの導入が試みられている。
維持療法(CQ5)としての多剤併用化学療法は予後を改善しない。タミバロテンとATRAによる維持療法の比較試験では高リスク群においてタミバロテンが優れていた。
寛解導入から維持療法まで,各臨床試験でさまざまな試みがあるが,得られた治療成績は当該試験のプロトコールで寛解導入から維持療法まで実施した結果であり,維持療法同士の比較など,他と切り離しての検討は困難である。寛解導入開始前にAPLのリスクや合併症を評価し,寛解導入だけでなく地固め・維持療法まで考慮して適切な治療プロトコールを選択する。異なるプロトコールの寛解導入・地固め・維持療法を組み合わせることは原則避ける。
再発時(CQ6)の第一選択はATO治療である。血液学的再発ではDICによる出血やDSも合併しやすく,PML::RARAのみ陽性の分子学的再発時に治療を行うことが望ましい。再寛解導入後(CQ7),ATOによる寛解導入後療法を行い,骨髄PML::RARAが陽性の場合は同種造血幹細胞移植,陰性化している場合は大量抗がん薬併用自家末梢血幹細胞移植が勧められる。移植非適応者に対しては,ATOベースの寛解後療法,もしくはATO治療後の再発例にも有効なゲムツズマブ オゾガマイシン(GO)が勧められる。
その他,高齢者(CQ8)に対する治療についても記述する。
CQ1 初発APLに対する寛解導入療法としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
全トランス型レチノイン酸とアントラサイクリン系を主体とした化学療法の併用療法が勧められる。
- 推奨グレード
- カテゴリー1
全トランス型レチノイン酸と亜ヒ酸を併用した治療は全トランス型レチノイン酸と化学療法の併用よりも有用である(国内保険適用外)。
解説
APLの治療では,全トランス型レチノイン酸(ATRA)による分化誘導療法が極めて有効であることが特徴である。ATRAとアントラサイクリン系薬剤併用化学療法の有用性が多数報告されている。イタリアで行われたAIDA0493試験では初発APLに対してATRAとイダルビシン(IDR)による併用療法(AIDA療法)が行われCR率は95%であった1)。ヨーロッパAPL2000試験では,白血球数10,000/μL未満(低・中間リスク)の例を対象に,ATRAとダウノルビシン(DNR)併用による寛解導入と,これにシタラビン(AraC)を追加した場合(AraC群)の比較が行われ,CR率に有意差はなかったものの,2年OSはAraC群が良好であった。ただしAraC群は地固めでもAraCが追加されていた2)。
JALSGによるAPL97試験では,治療前白血球数と末梢血APL細胞数(骨髄芽球数+前骨髄球数)によって層別化し,ATRAおよびリスクに応じた投与量の化学療法(IDR+AraC)を併用する寛解導入療法が実施され,全体のCR率94%,6年OS83.9%と良好な成績を得た3)。また,AraCを少し増量して同様の層別化を行ったAPL204試験では,全体のCR率は92.7%,4年OSは89%であった4)。
このように,初発APLではATRAとアントラサイクリン系を中心とした化学療法の併用療法によって90%以上のCR率が期待できる。なかでも,日本人を対象に良好な成績を報告しているAPL204プロトコールは,本邦での現時点における標準治療と考えられる。しかし,APL204試験では治療前高リスク群や治療中の白血球増多群ではCR率・生存率は十分ではなく4),これら高リスク例への治療アプローチは今後の課題である。
亜ヒ酸(ATO)もATRA同様に分化誘導に働く薬剤であり,本邦でも再発APLに対して単剤で用いられている。しかし,諸外国では初発APLに対するATRAとATOの併用療法が開発され,ATRAと化学療法の併用に代わる新たな標準治療としての地位を確立している。ATRA+ATO併用療法では寛解後療法もATRAとATOのみで行われ化学療法薬がほぼ用いられないことが特徴である。APL0406試験では,低・中間リスクAPLを対象に,ATRA+ATO併用療法とAIDA療法が比較された5)。CR率はともに良好で差はなかった。有害事象は,AIDA療法では血球減少や発熱性好中球減少症が有意に多く,また早期死亡が4例あった。一方,ATRA+ATO併用療法では肝障害が40%,QT延長が8.5%と有意に多かったが早期死亡例はなかった。50カ月EFS97.3% vs. 80.0%,同OS99.2% vs. 92.6%といずれもATRA+ATO併用療法が有意に良好でありATRA+ATO併用療法の高い有効性と安全性が示された。英国や米国からは高リスク例も含んだATRA+ATO併用療法の報告がある6,7)。高リスク例では寛解導入療法でATRAとATOに加えてゲムツズマブオゾガマイシン(GO)の投与が追加される形であったが,いずれの試験でもATRA+ATO併用療法の高い有効性が示された。これらから,海外では低・中間リスクAPLに対するATRA+ATO併用療法は標準治療として確立され,高リスク例に対しても標準治療として推奨されている。現在,本邦ではATOの初発APLに対する保険適用はないが,ATRA+ATO併用療法の早期導入が望まれる。
参考文献
1) Mandelli F, et al. Molecular remission in PML/RAR alpha-positive acute promyelocytic leukemia by combined all-trans retinoic acid and idarubicin(AIDA)therapy. Gruppo Italiano-Malattie Ematologiche Maligne dell’Adulto and Associazione Italiana di Ematologia ed Oncologia Pediatrica Cooperative Groups. Blood. 1987; 90(3): 1014-21.(2Ai)
2) Adès L, et al. Is cytarabine useful in the treatment of acute promyelocytic leukemia? Results of a randomized trial from the European Acute Promyelocytic Leukemia Group. J Clin Oncol. 2006; 24(36): 5703-10.(1iiDi)
3) Asou N, et al. A randomized study with or without intensified maintenance chemotherapy in patients with acute promyelocytic leukemia who have become negative for PML-RARalpha transcript after consolidation therapy: the Japan Adult Leukemia Study Group(JALSG)APL97 study. Blood. 2007; 110(1): 59-66.(3iDii)
4) Shinagawa K, et al. Tamibarotene as maintenance therapy for acute promyelocytic leukemia: results from a randomized controlled trial. J Clin Oncol. 2014; 32(33): 3729-35.(1iiDi)
5) Platzbecker U, et al. Improved Outcomes With Retinoic Acid and Arsenic Trioxide Compared With Retinoic Acid and Chemotherapy in Non-High-Risk Acute Promyelocytic Leukemia: Final Results of the Randomized Italian-German APL0406 Trial. J Clin Oncol. 2017; 35(6): 605-12.(1iiDi)
6) Burnett AK, et al. Arsenic trioxide and all-trans retinoic acid treatment for acute promyelocytic leukaemia in all risk groups(AML17): results of a randomised, controlled, phase 3 trial. Lancet Oncol. 2015; 16(13): 1295-305.(1iiDi)
7) Abaza Y, et al. Long-term outcome of acute promyelocytic leukemia treated with all-trans-retinoic acid, arsenic trioxide, and gemtuzumab. Blood. 2017; 129(10): 1275-83.(3iiiA)
CQ2 初発APLの寛解導入療法におけるDIC対策として何が勧められるか
- 推奨グレード
- カテゴリー1
臨床的にAPLが疑われた場合にはPML::RARAの結果を待たずに早期に全トランス型レチノイン酸を含む治療を開始する。
- 推奨グレード
- カテゴリー2A
寛解導入療法中の出血予防には,血小板輸血により血小板数30,000~50,000/μL以上,新鮮凍結血漿によりフィブリノゲン150mg/dL以上に保つ補充療法が勧められる。
- 推奨グレード
- カテゴリー2B
遺伝子組換えトロンボモジュリンによる治療は推奨される。
解説
APLでは,その細胞中に含まれる組織因子やcancer procoagulantによる,外因系凝固の活性化とともに,細胞表面のannexinⅡ高発現による線溶系の活性化が同時に起こっており,出血傾向の強い線溶亢進型のDICが出現する。
初発APLの寛解導入療法での早期死亡例の大多数はDICによる脳出血などの臓器出血による1,2)。寛解導入療法中にDICがみられる際は,その正常化まで,連日血算および凝固マーカー(PT,APTT,フィブリノゲン,FDP)の検査を行うことが望ましい。
全トランス型レチノイン酸(ATRA)はAPL細胞などの組織因子発現を抑制することで過凝固状態を緩和するとともにannexinⅡの発現も抑えることで異常に亢進した線溶系を抑制し,APLに伴う凝固異常を改善させる。臨床的にAPLが疑われた場合にはPML::RARA遺伝子異常の結果を待たずに早期にATRAを含む治療を開始することが出血予防につながる3)。
JALSG APL試験の後方視的解析では,重症出血の高リスク因子は低フィブリノゲン血症(<100mg/dL),白血球数高値(>20,000/μL)血小板数低値(<30,000/μL)などであった1,2)。このことから出血予防のためには,血小板輸血により血小板数をできれば50,000/μL以上,少なくとも30,000/μL以上,新鮮凍結血漿によりフィブリノゲン150mg/dL以上を目標とする補充療法が推奨される。
ATRAが登場する以前の化学療法時代に,臓器出血予防として,血小板およびフィブリノゲンの補充療法のみ,ヘパリンによる抗凝固療法,トラネキサム酸等による抗線溶療法の3群による後方視的解析が行われたが,寛解率,出血による早期死亡率に有意差を認めなかった4)。スペインのPETHEMAグループによる研究では,トラネキサム酸はATRAと併用することで血栓症のリスクが増大する傾向が示されており,トラネキサム酸投与は推奨されない5)。低分子ヘパリンやダナパロイドなどのヘパリン類は過凝固を抑えるメリットよりも出血の副作用を助長するデメリットの方が大きいと考えられ,現在ではその投与は推奨されない6)。
メシル酸ガベキサートやメシル酸ナファモスタットの合成蛋白分解酵素阻害薬による抗凝固療法についても,明らかな有用性を示した報告はない。
遺伝子組換えトロンボモジュリン(recombinant thrombomodulin : rTM)による治療は,実地診療下でのAPL由来DIC患者に広く使用されている。市販後全例調査によると,APLに合併したDIC 172例に使用され,30日以内の出血による早期死亡率は3.5%と比較的低かったことが報告されている7)。rTMは,APL細胞表面のannexinⅡの発現量を減少させるとともに,トロンビンの存在下でプロテインCを活性化し,凝固反応を抑制することから,APLに対するDICに投与することは理にかなっている。少数例での後方視的検討では,rTMによりDICからの早期離脱や輸血量の低減効果が報告されている8)。
参考文献
1) Yanada M, et al. Severe hemorrhagic complications during remission induction therapy for acute promyelocytic leukemia: incidence, risk factors, and influence on outcome. Eur J Haematol. 2007; 78(3): 213-9.(3iiDi)
2) Minamiguchi H, et al. Predictors of early death, serious hemorrhage, and differentiation syndrome in Japanese patients with acute promyelocytic leukemia. Ann Hematol. 2020; 99(12): 2787-800.(2Div)
3) Di Bona E, et al. Early haemorrhagic morbidity and mortality during remission induction with or without all-trans retinoic acid in acute promyelocytic leukaemia. Br J Haematol. 2000; 108(4): 689-95.(2A)
4) Rodeghiero F, et al. Early deaths and anti-hemorrhagic treatments in acute promyelocytic leukemia. A GIMEMA retrospective study in 268 consecutive patients. Blood. 1990; 75(11): 2112-7.(3iiiB)
5) Brown JE, et al. All-trans retinoic acid(ATRA)and tranexamic acid: a potentially fatal combination in acute promyelocytic leukaemia. Br J Haematol. 2000; 110(4): 1010-2.(3iiA)
6) Sanz MA, et al. Management of acute promyelocytic leukemia: updated recommendations from an expert panel of the European LeukemiaNet. Blood. 2019; 133(15): 1630-43(ガイドライン)
7) Matsushita T, et al. Thrombomodulin alfa treatment in patients with acute promyelocytic leukemia and disseminated intravascular coagulation: a retrospective analysis of an open-label, multicenter, post-marketing surveillance study cohort. Thromb Res. 2014; 133(5): 772-81.(3iiiDiv)
8) Ikezoe T, et al. Recombinant human soluble thrombomodulin safely and effectively rescues acute promyelocytic leukemia patients from disseminated intravascular coagulation. Leuk Res. 2012; 36(11): 1398-402.(3iiiDiv)
CQ3 APL分化症候群に対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
APL分化症候群(DS)は早期発見と,疑い段階からのデキサメタゾンの早期開始が推奨される。
- 推奨グレード
- カテゴリー2A
DSの重症例では,全トランス型レチノイン酸,亜ヒ酸の投与を中止する。
解説
APL分化症候群(differentiation syndrome:DS)は,APLの寛解導入における全トランス型レチノイン酸(ATRA)や亜ヒ酸(ATO)によるAPL細胞の分化誘導によって引き起こされる重要な合併症であり,重症例では死亡の危険もある。DSの診断に用いられる徴候・症状は,①呼吸困難,②原因不明の発熱,③5kg以上の体重増加,④原因不明の低血圧,⑤急性腎不全,⑥肺浸潤影,⑦胸水・心嚢水であり,これらのうち2つまたは3つを認める場合を中等症のDS,4つ以上を認める場合を重症DSと診断する1)。1つのみでは明確なDSの診断とはならないが,このDS疑いの段階で適切な対応を行うことが重要である。ATRAと化学療法の併用療法施行例の解析では,DSの発症率は15~25%で,好発時期は最初の1週間およびday 15~28の二峰性であった1)。リスク因子として,治療前白血球数高値,治療中白血球数増加,body mass indexや体表面積の高値,などが挙げられている2-4)。
APL93試験において,ATRAを投与してから化学療法を実施した場合とATRAと化学療法を同時に開始した場合の比較から,同時投与の方がDS発症を抑制する可能性が示された5)。また,Intergroup 0129試験におけるATRA単独による寛解導入療法施行例では,白血球数増加の際にヒドロキシウレア(HU)が追加投与されたが,DS発症率は26%と多く,ATRA再開後のDS再燃もみられた6)。これらの結果やDSの病態を考慮すると,化学療法による白血球数の抑制はDS発症予防に有効と思われる。
DS発症抑制の目的で予防的ステロイド投与も行われている。ATRAとイダルビシン(IDR)の併用(AIDA)療法を実施したLPA96試験とLPA99試験の比較では,前者は治療前白血球数5,000/μL超の場合のみデキサメタゾン(DEX)投与が,後者では全例に予防的プレドニゾロン(PSL)投与が行われた1)。LPA96試験による治療が重症DS発症のリスク因子であったことから,PSLによる一律のDS予防が有効である可能性が示唆された。一方で,ヨーロッパAPL2000試験では治療前または治療中白血球数10,000/μL超の場合のみDEX投与が行われ7),本邦APL204試験では予防的ステロイドは投与されず治療前・治療中の白血球数高値に対して化学療法による介入が行われた2)。これらの試験間でDS発症率に大きな差はなく,また化学療法などの背景も異なるため予防的ステロイドの意義は明確ではないが,白血球数高値例では考慮され得る8)。ATRA+ATO併用療法の場合は両薬剤による強力な分化誘導がかかるが,化学療法は用いられないため注意が必要である。APL0406試験では白血球数増加例はAIDA群24%に対し,ATRA+ATO群47%で有意に多かった9)。全例に予防的PSL投与が実施され,白血球数増加時には最大4,000mg/日のHUで対応することで,中等症以上のDSの発症率に差はなかった(本邦でのHUの承認用量は最大2,000mg/日)。
DSの治療では,DSが疑われた時点で可及的早期にDEX10mgを1日2回経静脈的に投与を開始することが極めて重要である8)。DSの診断に用いられる徴候・症状は感染症や心不全など他の原因でも出現するが,その場合でも直ちにDEXを開始することがELNのエキスパートパネルなどによって強く推奨されている8)。DSが重症の場合はATRAやATOを休薬する。DSが軽快すればDEXを漸減中止し,ATRAもしくはATOを休薬していればDSの症状が完全に消失してから再開する。
参考文献
1) Montesinos P, et al. Differentiation syndrome in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and anthracycline chemotherapy: characteristics, outcome, and prognostic factors. Blood. 2009; 113(4): 775-83.(3iii)
2) Minamiguchi H, et al. Predictors of early death, serious hemorrhage, and differentiation syndrome in Japanese patients with acute promyelocytic leukemia. Ann Hematol. 2020; 99(12): 2787-800.(3iii)
3) Yoon JH, et al. Progressive hyperleukocytosis is a relevant predictive marker for differentiation syndrome, early death, and subsequent relapse in acute promyelocytic leukemia. Sci Rep. 2019; 9(1): 11935.(3iii)
4) Breccia M, et al. Increased BMI correlates with higher risk of disease relapse and differentiation syndrome in patients with acute promyelocytic leukemia treated with the AIDA protocols. Blood. 2012; 119(1): 49-54.(3iii)
5) De Botton S, et al. Incidence, clinical features, and outcome of all trans-retinoic acid syndrome in 413 cases of newly diagnosed acute promyelocytic leukemia. Blood. 1998; 92(8): 2712-8.(3iii)
6) Tallman MS, et al. Clinical description of 44 patients with acute promyelocytic leukemia who developed the retinoic acid syndrome. Blood. 2000; 95(1): 90-5.(3iii)
7) Adès L, et al. Is cytarabine useful in the treatment of acute promyelocytic leukemia? Results of a randomized trial from the European Acute Promyelocytic Leukemia Group. J Clin Oncol. 2006; 24(36): 5703-10.(1iiDi)
8) Sanz MA, et al. Management of acute promyelocytic leukemia: updated recommendations from an expert panel of the European LeukemiaNet. Blood. 2019; 133(15): 1630-43.
9) Lo-Coco F, et al. Retinoic acid and arsenic trioxide for acute promyelocytic leukemia. N Engl J Med. 2013; 369(2): 111-21.(1ii)
CQ4 初発APLの全トランス型レチノイン酸+化学療法による寛解導入後の寛解後療法としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
3コースのアントラサイクリン系薬剤とシタラビンの併用療法が推奨される。
解説
初発APLに対して全トランス型レチノイン酸(ATRA)と化学療法の併用療法が実施される場合,寛解後療法は短期間の地固め療法とその後に実施される長期間の維持療法に分けられる。ここでは地固め療法について述べる。JALSGのAPL204試験では,リスクによって投与量を層別化したATRA・イダルビシン(IDR)・シタラビン(AraC)による寛解導入療法後,地固め療法として3コースのアントラサイクリン系薬剤とAraCの併用療法が行われ,7年OS87%と良好な成績が得られている1)。
寛解導入にATRAとIDRの併用(AIDA)療法を用いたAIDA0493試験では,アントラサイクリン系にAraCまたはエトポシドを併用した地固め療法3コースが実施された2)。同じくAIDA2000試験では低・中間リスク例に対してはATRAとアントラサイクリン系併用,高リスク例に対してはこれらにさらにAraCを追加した地固め療法が,それぞれ3コース実施された2)。OSは低・中間リスク例では両試験に差がなく,高リスク例ではAIDA2000試験が優れており,特に高リスク例でのAraC追加の有用性が示唆された2)。
このように,ATRAと化学療法の併用療法による寛解導入を用いたプロトコールでは,3コースのアントラサイクリン系薬剤を基本とし,これにAraCあるいはATRAを併用した地固め療法が実施されている。治療成績に大きな差はなく,また地固め療法のみを切り離した比較はできないが,本邦では日本人を対象としたJALSG APL204プロトコルが標準治療と考えられ,これに沿った3コースのアントラサイクリン系薬剤とAraC併用の地固め療法が推奨される。
現在,諸外国ではATRAと亜ヒ酸(ATO)の併用(ATRA+ATO)療法が標準治療となっている(ATOは初発APLに対して国内保険適用外)。ATRA+ATO併用療法では,寛解導入療法のみならず寛解後療法でもATRAとATOのみで治療が行われる。代表的なAPL0406試験では,ATRAは2週間の連続投与・その後2週間の休薬を1コースとし計7コースが実施され,ATOは1週あたり5日間の投与を4週間・その後4週間の休薬を1コースとして,計4コースが実施された3)。ATRAとATOは並行して投与されるので,1コースのATO投与につき2コースのATRAが投与されることになる。
寛解後療法におけるATOの有効性は,寛解導入としてATRAと化学療法の併用が行われた場合にも示唆されている。北米C9710試験ではATRA・ダウノルビシン(DNR)・AraCからなる寛解導入療法後に寛解後療法としてATRAとDNRの併用を2コース行う群と,この2コースの前に2コースのATO単独療法を追加する群の比較が行われ,3年EFSは80% vs. 63%でATO2コースを追加した群が良好であった4)。また,米国の別の試験では,寛解後療法をATRA・DNR・ATOの併用療法1コースのみにとどめることで化学療法薬を減量する試みもなされた5)。このように,ATRAと化学療法の併用療法において寛解後療法にATOを組み込むことで有効性や安全性を高めることが期待される。
参考文献
1) Takeshita A, et al. Tamibarotene maintenance improved relapse-free survival of acute promyelocytic leukemia: a final result of prospective, randomized, JALSG-APL204 study. Leukemia; 33(2): 358-70. 2019. (1iiDii)
2) Lo-Coco F, et al. Front-line treatment of acute promyelocytic leukemia with AIDA induction followed by risk-adapted consolidation for adults younger than 61 years: results of the AIDA-2000 trial of the GIMEMA Group. Blood. 2010; 116(17): 3171-9.(3iiA)
3) Lo-Coco F, et al. Retinoic acid and arsenic trioxide for acute promyelocytic leukemia. N Engl J Med. 2013; 369(2): 111-21.(1iiDi)
4) Powell BL, et al. Arsenic trioxide improves event-free and overall survival for adults with acute promyelocytic leukemia: North American Leukemia Intergroup Study C9710. Blood. 2010; 116(19): 3751-7.(1iiDi)
5) Gore SD, et al. Single cycle of arsenic trioxide-based consolidation chemotherapy spares anthracycline exposure in the primary management of acute promyelocytic leukemia. J Clin Oncol. 2010; 28(6): 1047-53.(3iiiDii)
CQ5 初発APLの分子学的寛解例に対する維持療法としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
高リスク例では,全トランス型レチノイン酸またはタミバロテン内服を中心とした維持療法が考慮される。
解説
初発APLに対して全トランス型レチノイン酸(ATRA)と化学療法の併用療法が実施される場合,寛解後療法は短期間の地固め療法とその後に実施される長期間の維持療法に分けられる。特に地固め療法後に分子学的寛解にある例を対象に,維持療法の意義が検討されてきた。JALSG APL97試験では,地固め療法終了後の分子学的寛解例を対象に,アントラサイクリン系薬剤を含む多剤併用化学療法6コースを行う強化維持療法群と無治療経過観察群の比較が行われ,6年OSは強化維持療法群が有意に不良であった1)。この結果より,分子学的寛解例に対する強化維持療法は勧められない。
イタリアのAIDA0493試験ではATRA単剤,ATRA+メトトレキサート(MTX)+メルカプトプリン(6-MP),MTX+6-MP,維持療法なし,の4群の比較研究が行われたが,12年DFSは4群間に有意差はなかった2)。フランスのAPL93試験でも同じ4群での比較が行われたが,10年累積再発率は維持療法なし群で最も高く,ATRA+MTX+6-MP群で最も低かった3)。特に治療前白血球数>5,000/μLの患者で維持療法の有効性が顕著となった。JALSG APL204試験では,ATRA単剤またはタミバロテン単独による維持療法の比較が行われた4)。タミバロテンはAPL細胞に対してATRAよりも高い分化誘導活性をもつ合成レチノイドである(初発APLでは国内保険適用外)。RFSは低・中間リスク例では2群間に差を認めなかったが,治療前白血球数10,000/μL以上の高リスク例ではタミバロテン群が有意に良好であった。これらの試験からは,低・中間リスク例における維持療法の意義は明らかでないが,治療前白血球数が高くなると維持療法の有用性が高くなり,高リスク例ではATRA単剤やこれにMTX・6-MPを組み合わせた維持療法,あるいはタミバロテン単独による維持療法が考慮される。
なお,現在,諸外国で標準治療として行われているATRAと亜ヒ酸(ATO)の併用療法では,寛解後療法としてATRA7コース,ATO4コースが実施され,その後の維持療法に相当する治療は実施されていない5)。
参考文献
1) Asou N, et al. A randomized study with or without intensified maintenance chemotherapy in patients with acute promyelocytic leukemia who have become negative for PML-RARalpha transcript after consolidation therapy: the Japan Adult Leukemia Study Group(JALSG)APL97 study. Blood. 2007; 110(1): 59-66.(1iiDii)
2) Avvisati G, et al. AIDA 0493 protocol for newly diagnosed acute promyelocytic leukemia: very long-term results and role of maintenance. Blood. 2011; 117(18): 4716-25.(1iiDii)
3) Adès L, et al. Very long-term outcome of acute promyelocytic leukemia after treatment with all-trans retinoic acid and chemotherapy: the European APL Group experience. Blood. 2010; 115(9): 1690-6.(1ii-Dii)
4) Takeshita A, et al. Tamibarotene maintenance improved relapse-free survival of acute promyelocytic leukemia: a final result of prospective, randomized, JALSG-APL204 study. Leukemia. 2019; 33(2): 358-70.(1iiDii)
5) Lo-Coco F, et al. Retinoic acid and arsenic trioxide for acute promyelocytic leukemia. N Engl J Med. 2013; 369(2): 111-21.(1iiDi)
CQ6 再発APLの至適な再寛解導入療法は何か
- 推奨グレード
- カテゴリー1
再発APLの再寛解療法は亜ヒ酸を含む治療が勧められる。
- 推奨グレード
- カテゴリー2B
亜ヒ酸不応例,不耐容例では,ゲムツズマブ オゾガマイシンまたはタミバロテンを含む治療を考慮する。
解説
APLの治療成績は全トランス型レチノイン酸(ATRA)と化学療法の併用療法により向上が認められたが,依然として約15~20%の症例では再発がみられ,そのほとんどが完全寛解後3年以内とされる。再発APLに対する再寛解導入療法の選択には初回治療レジメン,治療中の再発か否か,再発までの寛解持続期間を考慮する必要がある。
ATRAと化学療法の併用療法による初回治療例での再発では,亜ヒ酸(ATO)単剤により80~90%の症例で分子学的再寛解が得られる1,2)。再発APLに対してATOによる寛解導入後に自家移植を行ったJALSG APL205R試験では,CR率は81%であった3)。また,ATOを初回治療に含んだ症例においても,ATOベースの治療での高い再寛解到達率が報告されている4)。初回ATRA治療後再発例におけるATO+ATRA併用療法については,小規模なランダム化比較試験においてATO単独群とATO+ATRA併用群では,CR率,予後に差はみられず,ATOにATRAを併用する意義は明らかでない5)。また,初回治療でATRA+ATO併用療法が行われた症例での早期再発例では,アントラサイクリンを併用する化学療法も選択肢となり得る。
ATO以外の薬剤としてゲムツズマブ オゾガマイシン(GO)の有効性も報告されている。分子学的再発16例に対するGO単剤の投与では,2回投与時点でMRD評価を行った11例中9例で分子学的再寛解が得られた6)。一方で,GO治療による同種移植後の類洞閉塞症候群の発症増加の可能性もあり,移植予定例には使用を避ける,もしくは移植までに一定期間をあける必要がある。合成レチノイン酸であるタミバロテンも再発例に対する治療選択肢となり,ATRA治療後の再発例に対する単剤での第Ⅱ相試験で58%の再寛解導入率が報告されている7)。また,ATRA+ATO併用療法後の再発14例において,タミバロテン単剤での全奏効率は64%,細胞遺伝学的寛解率43%,分子学的寛解率は21%であったが,EFS中央値は3.5カ月,OS中央値は9.5カ月と奏効期間は短かった8)。
再発APLの2~5%で中枢神経系(central nervous system:CNS)浸潤が報告され,その存在について注意が必要である。European APL Groupからの報告では,ATRAと化学療法の併用療法後の再発例の5.3%にCNS浸潤が認められ,CNS浸潤のリスク因子として,診断時WBC10,000/μL以上が抽出された9)。CNS再発例では,髄液中の芽球が消失するまでメトトレキサート(MTX),シタラビン(AraC),ハイドロコルチゾンによる髄注を週に1~2回実施し,その後も定期的な髄注を実施する。
参考文献
1) Shen ZX, et al. Use of arsenic trioxide(As2O3)in the treatment of acute promyelocytic leukemia(APL): II. Clinical efficacy and pharmacokinetics in relapsed patients. Blood. 1997; 89(9): 3354-60.(3iiDiv)
2) Shigeno K, et al. Arsenic trioxide therapy in relapsed or refractory Japanese patients with acute promyelocytic leukemia: updated outcomes of the phase Ⅱ study and postremission therapies. Int J Hematol. 2005; 82(3): 224-9.(3iiiA)
3) Yanada M, et al. Phase 2 study of arsenic trioxide followed by autologous hematopoietic cell transplantation for relapsed acute promyelocytic leukemia. Blood. 2013; 121(16): 3095-102.(2Di)
4) Fouzia NA, et al. Management of relapse in acute promyelocytic leukaemia treated with up-front arsenic trioxide-based regimens. Br J Haematol. 2021; 192(2): 292-9.(3iiiA)
5) Raffoux E, et al. Combined treatment with arsenic trioxide and all-trans-retinoic acid in patients with relapsed acute promyelocytic leukemia. J Clin Oncol. 2003; 21(12): 2326-34.(1iiDiv)
6) Lo-Coco F, et al. Gemtuzumab ozogamicin(Mylotarg)as a single agent for molecularly relapsed acute promyelocytic leukemia. Blood. 2004; 104(7): 1995-9.(3iiiDiv)
7) Tobita T, et al. Treatment with a new synthetic retinoid, Am80, of acute promyelocytic leukemia relapsed from complete remission induced by all-trans retinoic acid. Blood. 1997; 90(3): 967-73.(3iiDiv)
8) Sanford D, et al. Tamibarotene in patients with acute promyelocytic leukaemia relapsing after treatment with all-trans retinoic acid and arsenic trioxide. Br J Haematol. 2015; 171(4): 471-7.(3iiiDiv)
9) de Botton S, et al: Extramedullary relapse in acute promyelocytic leukemia treated with all-trans retinoic acid and chemotherapy. Leukemia. 2006; 20(1): 35-41.(3iDii)
CQ7 APL第二寛解例の寛解後治療として何が勧められるか
- 推奨グレード
- カテゴリー2A
亜ヒ酸による寛解後療法後のMRD陰性例には自家移植が勧められる。
- 推奨グレード
- カテゴリー2A
MRD陽性例で移植可能症例には同種移植が勧められる。
解説
APLの第二寛解期(CR2)での自家もしくは同種移植の施行は,予後,特にOSを改善することが報告されている。亜ヒ酸(ATO)の登場以前では,再発例に対しては全トランス型レチノイン酸(ATRA)と化学療法による再寛解導入療法が行われ,そのCR2での自家移植と同種移植を比較したヨーロッパAPLグループのAPL91とAPL93試験では,7年OSが自家移植群59.8%,同種移植群51.8%,移植非実施群39.5%と自家移植が優れていた。RFSでは自家移植群79.4%,同種移植群92.3%,移植非実施群38%と同種移植が良好であったが,治療関連死亡は自家移植群6%に対し同種移植群39%と多かった1)。また,EBMTの625例を対象とした解析結果ではCR2での5年DFSは,自家移植で51%,同種移植では59%であった2)。ATOによる再発後治療が導入された後においても,CR2での移植療法の有効性が報告されている。インドの研究では,再発APLに対して,ATOもしくはATRA+ATOにて再寛解導入を行い,その後の自家移植の実施別での5年EFSは,移植群83.3%,非移植群34.5%と有意に自家移植実施群で良好であった3)。ELNのレジストリ研究では,ATOベースによる再寛解導入療法,寛解後療法を行った後に自家もしくは同種移植を行った93例と移植を行わなかった55例を比較した。3年OS80% vs. 59%(p=0.03),3年累積再発率(CIR)35% vs. 58%(p=0.02)といずれも移植実施群が優れていた。本研究では,OS,CIRいずれにおいても自家移植群60例と同種移植群33例で有意差は認められなかった4)。
ATRAと化学療法併用レジメンによる治療後の再発APLに対して,ATOによる再寛解導入療法および寛解後療法後に,定量RT-PCR法でのMRD陰性となった症例に自家移植を実施したJALSG APL205R試験では,CR率81%,5年EFS65%,5年OS77%であった5)。また,再発APLにATOが使用可能となって以降は,それ以前の時代に比べ,CR2での自家移植の治療成績が向上した6)。APLのCR2では,ATOによる寛解後療法とMRD陰性の移植可能例では自家移植の実施が推奨され,同種移植については自家移植と比べて高い治療関連死亡率より,寛解期におけるMRD,再発までの期間を考慮した限られた症例での実施が勧められる。ただし,本邦のレジストリ研究では自家移植前のMRD残存の有無は予後因子とはならなかったとの報告もされており,同種移植の実施が困難な症例では,自家移植が選択肢となり得る7)。
近年,再発APLに対して,ATOベースの化学療法のみでも良好な成績が得られる症例もあることから,自家移植の必要性について疑問視する報告もあるが,前方視的試験による検証が必要である。英国National Cancer Research Institute(NCRI)AML17試験の長期観察研究では,AIDAレジメンで初回治療された後に再発しCNS浸潤を認めなかった症例で,ATRA+ATO併用療法後に移植療法を施行しなかった18例中14例が分子学的寛解を維持していると報告されている8)。また,移植適応でないATO不応例,不耐容例ではゲムツズマブ オゾガマイシン(GO)が勧められる9)。
参考文献
1) de Botton S, et al. Autologous and allogeneic stem-cell transplantation as salvage treatment of acute promyelocytic leukemia initially treated with all-trans-retinoic acid: a retrospective analysis of the European acute promyelocytic leukemia group. J Clin Oncol. 2005; 23(1): 120-6.(3iiA)
2) Sanz MA, et al. Hematopoietic stem cell transplantation for adults with acute promyelocytic leukemia in the ATRA era: a survey of the European Cooperative Group for Blood and Marrow Transplantation. Bone Marrow Transplant. 2007; 39(8): 461-9.(3iiiDii)
3) Thirugnanam R, et al. Comparison of clinical outcomes of patients with relapsed acute promyelocytic leukemia induced with arsenic trioxide and consolidated with either an autologous stem cell transplant or an arsenic trioxide-based regimen. Biol Blood Marrow Transplant. 2009; 15(11): 1479-84.(2Di)
4) Lengfelder E, et al. Arsenic trioxide-based therapy of relapsed acute promyelocytic leukemia: registry results from the European LeukemiaNet. Leukemia. 2015; 29(5): 1084-91.(3iiA)
5) Yanada M, et al. Phase 2 study of arsenic trioxide followed by autologous hematopoietic cell transplantation for relapsed acute promyelocytic leukemia. Blood. 2013; 121(16): 3095-102.(2Di)
6) Yanada M, et al. Autologous hematopoietic cell transplantation for acute promyelocytic leukemia in second complete remission: outcomes before and after the introduction of arsenic trioxide. Leuk Lymphoma. 2017; 58(5): 1061-7.(3iiiDiv)
7) Yanada M, et al. Autologous hematopoietic cell transplantation during second or subsequent complete remission of acute promyelocytic leukemia: a prognostic factor analysis. Bone Marrow Transplant. 2022; 57(1): 78-82(3iiiDiv)
8) Russell N, et al. Attenuated arsenic trioxide plus ATRA therapy for newly diagnosed and relapsed APL: long-term follow-up of the AML17 trial. Blood. 2018; 132(13): 1452-4.(3iiiDii/2Dii)
9) Lo-Coco F, et al. Gemtuzumab ozogamicin(Mylotarg)as a single agent for molecularly relapsed acute promyelocytic leukemia. Blood. 2004; 104(7): 1995-9.(3iiiDiv)
CQ8 高齢者APLの至適な治療方法は何か
- 推奨グレード
- カテゴリー2A
全身状態が比較的良好な高齢者に対しては若年者と同様に,治癒を目指した治療が行われるが,アントラサイクリン系薬剤の投与量など,その強度は若年者より弱めるべきである。
- 推奨グレード
- カテゴリー2A
重篤な併存疾患などにより治療強度の維持が困難な高齢者に対しては,亜ヒ酸をベースにした治療も妥当と考えられる(国内保険適用外)。
解説
高齢者APLでは治療毒性による有害事象の発生,治療強度の維持が問題となるが,治療強度を減弱した全トランス型レチノイン酸(ATRA)併用化学療法による治療成績の向上,本邦では保険適用外である亜ヒ酸(ATO)を含む治療の有効性が示されている。
スペインのPETHEMAグループによる,ATRAとイダルビシン(IDR)併用の寛解導入療法とアントラサイクリン系抗がん薬中心の寛解後療法からなる,年齢調整を行わないLPA96とLPA99試験に登録された60歳以上のAPLを対象とした解析では,CR率は良好だったものの,高齢者で感染症による早期死亡がより高率であった1)。また,年齢調整を行ったLPA2005試験との比較では,5年DFSはLPA96/99で69%,LPA2005で87%(p=0.04),5年OSはLPA96/99で60%,LPA2005で74%(p=0.06)とリスク・年齢で調整したATRA併用化学療法により,60歳以上のAPLの治療成績の改善が示された2)。また,イタリアのGIMEMAグループ,ドイツのGerman Study Alliance Leukemia(SAL)study groupからの報告では,3コースからなるAIDA療法の寛解後療法を,年齢に応じて,そのコース数を減らすことにより,治療関連有害事象を減らし,同等の治療成績が得られた3,4)。
ATOは年齢依存の副作用が少ないことから高齢者APLに対しても有効性が期待されている。北米C9710試験では,寛解後療法でATOを単独で追加した群は61~79歳の高齢者群でも有意な予後の改善を認めた5)。MDアンダーソンがんセンターは,寛解導入・寛解後療法にATOとATRAを併用投与した試験を行い,60歳以上でも良好な結果を報告している6)。また,70歳以上の初発APL433例を対象とした国際共同研究では,ATRA+化学療法,もしくはATRA+ATO(±化学療法)の比較が後方視的に行われ,ATRA+ATO併用療法は,70歳以上の高齢APLに対しても忍容性が高く,特に高リスク群で有用性が高いことが報告されている7)。このように,高齢者には通常の化学療法よりも致命的な有害事象をきたすことの少ないATOベースの治療を行うのも妥当と考えられるが,ATOによる初発APL治療は2023年5月現在保険適用外である。
参考文献
1) Sanz MA, et al. All-trans retinoic acid and anthracycline monochemotherapy for the treatment of elderly patients with acute promyelocytic leukemia. Blood. 2004; 104(12): 3490-3.(3iiDii)
2) Martínez-Cuadrón D, et al. Long-term outcome of older patients with newly diagnosed de novo acute promyelocytic leukemia treated with ATRA plus anthracycline-based therapy. Leukemia 2018; 32(1): 21-9.(3iiiDii)
3) Mandelli F, et al. Treatment of elderly patients(>or=60 years)with newly diagnosed acute promyelocytic leukemia. Results of the Italian multicenter group GIMEMA with ATRA and idarubicin(AIDA)protocols. Leukemia. 2003; 17(6): 1085-90.(1iiA)
4) Röllig C, et al. Two cycles of risk-adapted consolidation therapy in patients with acute promyelocytic leukemia. Results from the SAL-AIDA2000 trial. Ann Hematol. 2015; 94(4): 557-63.(3iiiA)
5) Powell BL, et al. Arsenic trioxide improves event-free and overall survival for adults with acute promyelocytic leukemia: North American Leukemia Intergroup Study C9710. Blood. 2010; 116(19): 3751-7.(1iiDi)
6) Estey E, et al. Use of all-trans retinoic acid plus arsenic trioxide as an alternative to chemotherapy in untreated acute promyelocytic leukemia. Blood. 2006; 107(9): 3469-73.(3iiDiv)
7) Kayser S, et al. Outcome of older(≥ 70 years)APL patients frontline treated with or without arsenic trioxide-an International Collaborative Study. Leukemia 2020; 34(9): 2333-41.(3iiiA)

