第Ⅰ章 白血病
Ⅰ 白血病
1 急性骨髄性白血病
(acute myeloid leukemia:AML)
総論
1.AMLの病態と治療
急性骨髄性白血病(acute myeloid leukemia:AML)は,分化・成熟能が障害された幼若骨髄系細胞のクローナルな自律性増殖を特徴とする多様性に富む血液腫瘍である。骨髄における白血病細胞の異常な増殖の結果,正常な造血機能は著しく阻害され,白血球減少,貧血,血小板減少に伴うさまざまな症状を呈する。適切な治療がなされない場合は,感染症や出血により短期間で致死的となる重篤な疾患である。
初発AMLに対する基本的な治療戦略は治癒を目指した強力な化学療法であり,多剤併用療法が基本となる。しかし,その適応は化学療法による臓器毒性や合併症に耐えられるかを年齢,臓器機能,全身状態などによって慎重かつ厳密に判断する必要がある(表1)1,2)。AMLに対する化学療法は寛解導入療法と寛解が得られた後に行う寛解後療法からなる。化学療法のみでは良好な長期予後が得られない症例に対しては,第一寛解期で同種造血幹細胞移植が適応となる。
表1 強力化学療法適応規準
| 項目 | 基準 |
|---|---|
| 年齢 | 65歳未満 |
| 心機能 | 左室駆出率(LVEF)50%以上 |
| 肺機能 | PaO2 60Torr以上またはSpO2 90%以上(room air) |
| 肝機能 | 血清ビリルビン2.0mg/dL以下 |
| 腎機能 | 血清クレアチニン施設基準値の上限の1.5倍以下 |
| 感染症 | 制御不能の感染症の合併なし |
JALSG(日本成人白血病治療共同研究グループ)における臨床第Ⅲ相試験で定める適格規準などを参考に強力化学療法を行うにあたり上記規準が目安となるが,患者の全身状態やその他の合併症を考慮して総合的に判断する必要がある。
(文献1,2)より作成)
寛解導入療法に対する不応例や,完全寛解(complete remission:CR)に到達したものの,その後再発をきたした症例は,再発・難治例として救援療法が必要となる。しかし,再発・難治例においては化学療法のみでの治癒は期待しがたいため,可能な症例では同種造血幹細胞移植が適応となる。FLT3遺伝子変異陽性の再発・難治例に対しては,2種類のFLT3阻害薬(ギルテリチニブ,キザルチニブ)が使用可能である。両剤ともに使用前に,承認されたコンパニオン診断キットでのFLT3遺伝子変異の同定が必要である。また,キザルチニブはFLT3-ITD変異陽性例のみに適応があることに注意する。
高齢者の定義は定かではないが,わが国では65歳以上とすることが多い。本稿では生理的年齢65歳以上を高齢者とした。高齢者AMLでは,臓器機能などの患者側要因により,若年成人と同等の治療強度を持つ化学療法を一律に実施することは困難である。全身状態や臓器機能が十分に保たれている場合には化学療法の適応となるが,一般的に,高齢者AMLに対する化学療法は治療関連合併症の頻度・程度が高く,強力化学療法の適応は慎重に判断しなければならない。
2.AMLの診断と病型分類
AMLの診断は,①骨髄における白血病細胞の存在[WHO分類(2017)]では20%以上,FAB分類では30%以上),②白血病細胞が骨髄系起源であること,③白血病細胞の染色体核型・遺伝子変異解析によって行われ,その後WHO分類(2017)に従って病型分類される(表2)3)。このWHO分類(2017)では,非赤芽球系細胞(non-erythroid cells:NEC)を分母とする芽球比率算定方式を取り止め,芽球比率はすべて骨髄全有核細胞(all nucleated cells:ANC)を分母として算定することが明記された。その結果,従来,ANCが50%超の場合に骨髄芽球がNECの20%以上あれば急性赤白血病と診断されていた症例の多くが,MDSに分類されることになった。また,新たに暫定病型として,BCR::ABL1融合遺伝子を有するAML,RUNX1変異を有するAMLが加えられ,CEBPAの両アレル変異およびNPM1変異を有するAMLが暫定病型から独立した病型になるなど,小規模な改訂がなされた。
表2 AMLのWHO分類(2017)
AML with t(8;21)(q22;q22.1);RUNX1-RUNX1T1
AML with inv(16)(p13.1q22)or t(16;16)(p13.1;q22);CBFB-MYH11
APL with PML-RARA
AML with t(9;11)(p21.3;q23.3);MLLT3-KMT2A
AML with t(6;9)(p23;q34.1);DEK-NUP214
AML with inv(3)(q21.3q26.2)or(t 3;3)(q21.3;q26.2);GATA2, MECOM
AML(megakaryoblastic)with t(1;22)(p13.3;q13.3);RBM15-MKL1
Provisional entity: AML with BCR-ABL1
AML with mutated NPM1
AML with biallelic mutations of CEBPA
Provisional entity: AML with mutated RUNX1
AML with myelodysplasia-related changes
Therapy-related myeloid neoplasms
AML, NOS
AML with minimal differentiation
AML without maturation
AML with maturation
Acute myelomonocytic leukemia
Acute monoblastic/monocytic leukemia
Pure erythroid leukemia
Acute megakaryoblastic leukemia
Acute basophilic leukemia
Acute panmyelosis with myelofibrosis
Myeloid sarcoma
Myeloid proliferations related to Down syndrome
Transient abnormal myelopoiesis(TAM)
Myeloid leukemia associated with Down syndrome
(文献3)より引用)
2022年にInternational Consensus Classificationから新たに提唱され4),European Leukemia Net(ELN)が2022年の改訂で採用している分類を表3に示す5)。今回の改訂では,PML::RARA,CBFB::MYH11,RUNX1::RUNX1T1などのAMLを定義付けるような遺伝子異常を有する場合は,AMLの芽球比率閾値を10%に引き下げている。ただし,BCR::ABL1のみCML移行期との混乱を避けるため20%以上に据え置かれた。
表3 ELNによるAML分類(2022)
APL with t(15;17)(q24.1;q21.2)/PML::RARA
AML with t(8;21)(q22;q22.1)/RUNX1::RUNX1T1
AML with inv(16)(p13.1q22)or t(16;16)(p13.1;q22)/CBFB::MYH11
AML with t(9;11)(p21.3;q23.3)/MLLT3::KMT2A
AML with t(6;9)(p22.3;q34.1)/DEK::NUP214
AML with inv(3)(q21.3q26.2)or t(3;3)(q21.3;q26.2)/GATA2, MECOM(EVI1)
AML with other rare recurring translocations
AML with mutated NPM1
AML with in-frame bZIP mutated CEBPA
AML with t(9;22)(q34.1;q11.2)/BCR::ABL1
Provisional entity: AML with mutated RUNX1
Categories designated AML(if ≥20% blasts in BM or PB)or MDS/AML(if 10-19% blasts in BM or PB)
AML with mutated TP53
AML with myelodysplasia-related gene mutations
Defined by mutations in ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1, or ZRSR2
AML with myelodysplasia-related cytogenetic abnormalities
AML not otherwise specified(NOS)
Myeloid sarcoma
Myeloid proliferations related to Down Syndrome
Transient abnormal myelopoiesis associated with Down syndrome
Myeloid leukemia associated with Down syndrome
Blastic plasmacytoid dendritic cell neoplasm
Acute leukemias of ambiguous lineage
Acute undifferentiated leukemia
MPAL with t(9;22)(q34.1;q11.2)/BCR::ABL1
MPAL with t(v;11q23.3)/KMT2A rearranged
MPAL, B/myeloid, not otherwise specified
MPAL, T/myeloid, not otherwise specified
(文献5)より引用)
今回の重要な分類変更のひとつとして,病歴よりも遺伝学的特徴の方が生物学的AMLの分類に関連していることから,従来のAML-MRCと治療関連骨髄性腫瘍の病型が削除された。
反復性遺伝子異常を伴うAMLのカテゴリーにRARA,KMT2A,MECOMなどが病型に加えられた。また,最近の研究ではCEBPAの片アレル変異であってもbZIP領域に変異がある場合は予後良好であることから,両アレル変異を有するCEBPAからbZIP領域に変異を有するCEBPAに病型が変更された。
TP53変異は独立した病型となり,TP53変異がなくともASXL1,BCOR,EZH2,RUNX1,SF3B1,SRSF2,STAG2,U2AF1,ZRSR2の変異がある場合はMDSの病歴の有無に関わりなく,骨髄異形成関連遺伝子変異を有するAMLと分類された。TP53または骨髄異形成関連遺伝子変異を有するAML以外の従来,AML-MRCと分類されたAMLは,新たに追加された骨髄異形成関連染色体異常を有するAMLの病型に含まれるようになった。
今後は,多様な遺伝子異常が予後に及ぼす影響,新規薬剤登場後の治療成績が詳細に解析されるに従い,病型分類および治療ガイドラインも改訂されることが予測される。
3.AMLの予後因子
標準的な化学療法を受けた若年者AML全体では,70~80%のCRと40%前後の5年RFSが得られるが,種々の予後因子により予後良好群,中間群,不良群の3種類に区別される。
AMLの予後には患者側要因と白血病細胞側要因の双方が関係するとともに,治療反応性も長期予後に影響を及ぼす因子となる(表4)2,6-8)。
表4 AMLにおける予後層別化因子
| 層別化因子 | 良好となる因子 | 不良となる因子 |
|---|---|---|
| 年齢 | 50歳以下 | 60歳以上 |
| 全身状態(PS) | PS 2以下 | PS 3以上 |
| 発症様式 | de novo | 二次性 |
| 染色体核型 |
t(8;21)(q22;q22.1) inv(16)(p13.1q22) t(16;16)(p13.1;q22) t(15;17)(q24.1;q21.2) |
3q 異常[inv(3)(q21.3q26.2) t(3;3)(q21.3;q26.2)など] 5番・7番染色体の欠失または長腕欠失 t(6;9)(p23;q34.1)複雑核型 |
| 遺伝子変異 |
NPM1変異 両アレルCEBPA変異 |
FLT3-ITD変異 |
|
寛解までに要した 治療回数 |
1回 | 2回以上 |
(文献2,6-8)より作成)
患者側要因として,年齢(60歳以上),全身状態(performance status:PS 3以上),合併症の存在(感染症など)が予後不良因子として重要である。
白血病細胞側要因として,染色体核型,発症様式(de novoまたは二次性),初診時白血球数,細胞形態(異形成の有無,FAB病型,myeloperoxidase:MPO染色陽性率)が予後因子となる。
染色体核型はAMLにおける予後層別化因子として最も使用されているが,種々の遺伝子変異の予後因子としての重要性が明らかとなり,従来の染色体核型に基づくリスク分類を遺伝子変異の状態によって細分化するシステムが提唱されている。しかし,AMLに生じている遺伝子変異は固形がんに比較して少ないものの,複数の遺伝子変異が協調的に病態に関与しているため,個々の遺伝子変異単独での予後層別化には注意をする必要があり,複数の遺伝子変異を組み合わせた層別化システムの構築が模索されている。2010年にELNから,遺伝子変異と従来の染色体核型に基づく予後因子を組み合わせた新たな予後層別化システムが提唱されたが,2017年9)に続き2022年5)に新たな染色体異常および遺伝子変異の状態を組み入れた改訂が行われた(表5,6)。CQ1で詳細に解説する。
表5 ELN(2017)によるAMLの層別化システム
| Risk category | Genetic abnormality |
|---|---|
| Favorable |
t(8;21)(q22;q22.1): RUNX1-RUNX1T1 inv(16)(p13.1q22)or(t 16;16)(p13.1;q22): CBFB-MYH11 Mutated NPM1 without FLT3-ITD or with FLT3-ITD low* Biallelic mutated CEBPA |
| Intermediate |
Mutated NPM1 and FLT3-ITD high* Wild type NPM1 without FLT3-ITD or with FLT3-ITD low*(without adverse risk genetic lesions) t(9;11)(p21.3;q23.3); MLLT-KMT2A¶ Cytogenetic abnormalities not classified as favorable or adverse |
| Adverse |
t(6;9)(q23;q34.1): DEK-NUP214 t(v;11)(v;q23): KMT2A rearranged t(9;22)(q34.1;q11.2); BCR-ABL1 inv(3)(q21.3q26.2)or(t 3;3)(q21.3;q26.2); GATA2, MECOM(EVI1) -5 or del(5q), -7, -17/abn(17p) Complex karyotype§, monosomal karyotype † Wild type NPM1 and FLT3-ITD high* Mutated RUNX1‡ Mutated ASXL1‡ Mutated TP53 # |
* low:low allelic ratio(<0.5),high:high allelic ratio(≧0.5)
¶ 稀な予後不良遺伝子変異の重複よりも優先される。
§3つ以上の染色体異常あり,かつ以下の転座・逆位を伴わない;t(8;21),inv(16)/t(16;16),t(9;11),t(v;11)(v;q23.3),t(6;9),inv(3)/(t3;3),BCR-ABL1
†少なくとも1つ以上の付加的モノソミーまたは染色体構造異常(core-binding factor AMLを除く)を伴う1つのモノソミー(XまたはY染色体欠失を除く)。
‡これらのマーカーはFavorable群のリスク因子を伴った場合,Adverseとして扱わない。
#TP53変異は染色体複雑核型と関連する。
(文献9)より引用)
表6 ELN(2022)によるAMLの層別化システム
| Risk category | Genetic abnormality |
|---|---|
| Favorable |
t(8;21)(q22;q22.1)/RUNX1::RUNX1T1 inv(16)(p13.1q22)or t(16;16)(p13.1;q22)/CBFB::MYH11 Mutated NPM1 without FLT3-ITD bZIP in-frame mutated CEBPA |
| Intermediate |
Mutated NPM1 with FLT3-ITD Wild-type NPM1 with FLT3-ITD t(9;11)(p21.3;q23.3)/MLLT3::KMT2A Cytogenetic and/or molecular abnormalities not classified as favorable or adverse |
| Adverse |
t(6;9)(p23;q34.1)/DEK::NUP214 t(v;11q23.3)/KMT2A-rearranged t(9;22)(q34.1;q11.2)/BCR::ABL1 t(8;16)(p11;p13)/KAT6A::CREBBP inv(3)(q21.3q26.2)or t(3;3)(q21.3;q26.2)/GATA2, MECOM(EVI1) t(3q26.2;v)/MECOM(EVI1)-rearranged -5 or del(5q); -7; -17/abn(17p) Complex karyotype, monosomal karyotype Mutated ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1, or ZRSR2 Mutated TP53 |
(文献5)より引用)
参考文献
1) Ohtake S, et al. Randomized study of induction therapy comparing standard-dose idarubicin with high-dose daunorubicin in adult patients with previously untreated acute myeloid leukemia: the JALSG AML201 Study. Blood. 2011; 117(8): 2358-65.(1iiDiv)
2) NCCN Clinical Practice Guidelines in Oncology. Acute Myeloid Leukemia. Version 3.2020-December 23, 2019.(ガイドライン)
3) Arber DA, et al. Acute myeloid leukaemia and related precursor neoplasms. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, Lyon, IARC; 2017: pp129-71.(テキストブック)
4) Arber DA, et al. Acute myeloInternational Consensus Classification of Myeloid Neoplasms and Acute Leukemias: integrating morphologic, clinical, and genomic data Blood. 2022; 140(11): 1200-28.(レビュー)
5) Döhner H, et al. Diagnosis and management of AML in adults : 2022 recommendations from an international expert panel on behalf of the ELN. Blood. 2022; 140(12): 1345-77.(レビュー)
6) Grimwade D, et al. The importance of diagnostic cytogenetics on outcome in AML : analysis of 1,612 patients entered into the MRC AML 10 trial. The Medical Research Council Adult and Children’s Leukaemia Working Parties. Blood. 1998; 92(7): 2322-33.(3iiiD)
7)日本血液学会,日本リンパ網内系学会編.造血器腫瘍取扱い規約 第1版.金原出版.2010年3月.(ガイドライン)
8) Kuriyama K, et al. Trial to extract prognostic factors prior to the start of induction chemotherapy for adult AML. Berlin : Springer. 1998, pp901-5.
9) Döhner H, et al. Diagnosis and management of AML in adults : 2017 ELN recommendations from an international expert panel. Blood. 2017; 129(4): 424-47.(レビュー)
アルゴリズム
2023年5月,未治療のFLT3-ITD変異陽性AMLに対して化学療法との併用においてキザルチニブ(QUIZ)の使用が追加承認され,治療の選択肢となった(CQ9)。これに伴いリューコストラットCDx FLT3変異検査は初発時から実施する必要がある。
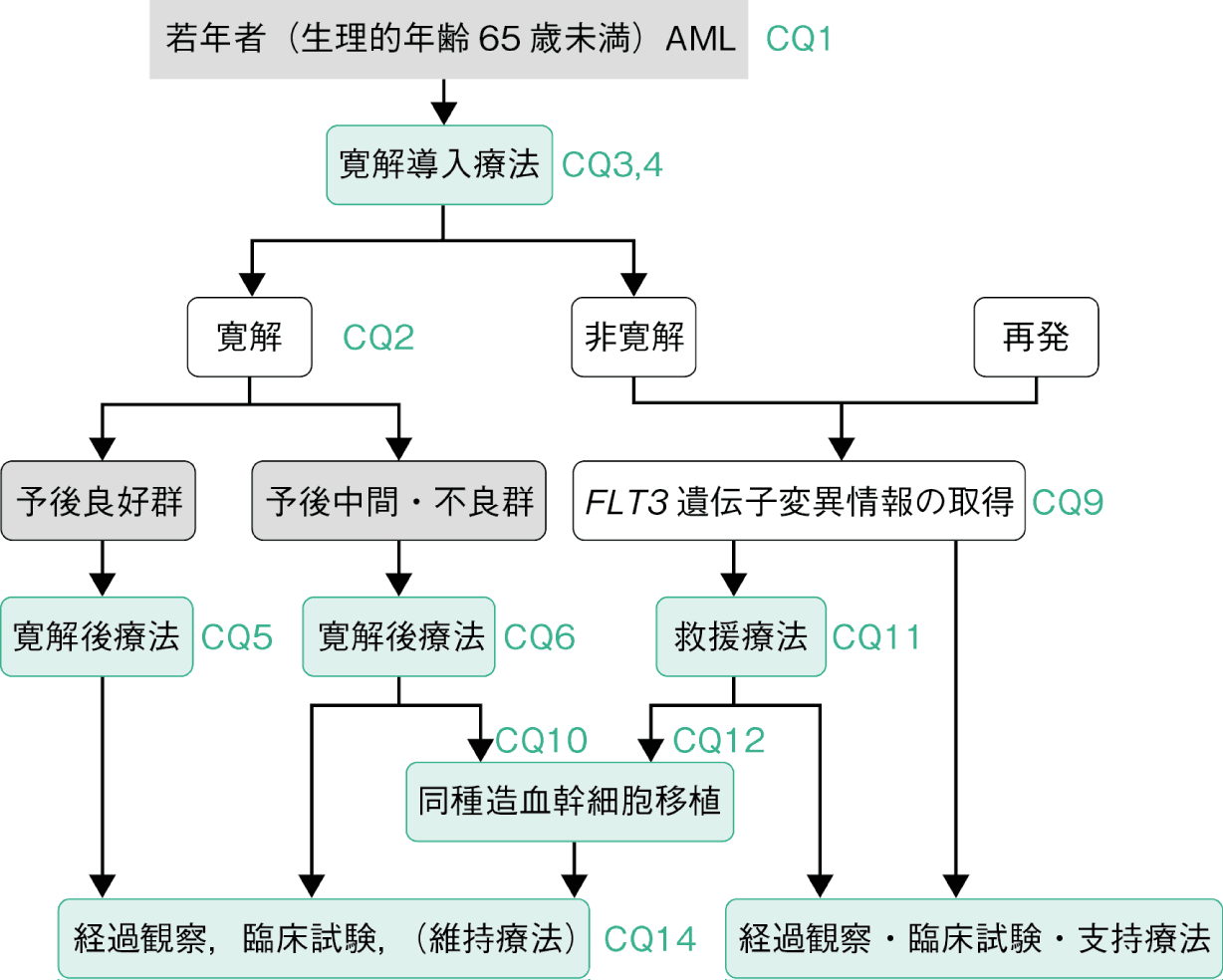
1.若年者(生理的年齢65歳未満)AML
AMLと診断された場合は上記のアルゴリズムに従うことが推奨される。若年者AMLに対する標準的寛解導入療法はアントラサイクリン+標準量シタラビン(AraC)(CQ3)である。その際のアントラサイクリン系薬剤の至適な種類と投与量は1つに限定されないが,ダウノルビシン(DNR)またはイダルビシン(IDR)の使用が推奨される。1コース目の寛解導入療法で非寛解症例に対しては同一レジメンが繰り返されることが多く,1回目の寛解導入療法にAraC大量療法を含む治療を行っていない場合,2回目にAraC大量療法を含む治療を行うことも妥当である(CQ4)。初発FLT3-ITD陽性AMLに対しては化学療法とQUIZ併用が勧められる(CQ3)。
AMLにおいて,染色体核型に加え遺伝子変異を組み入れた予後分類が提唱されており(CQ1),地固め療法は予後因子により層別化して行われる。予後良好群に対してはAraC大量療法(CQ5)が,予後中間群,不良群に対しては同種造血幹細胞移植が推奨されるが(CQ10),適切なドナーが不在の場合は,非交差耐性のアントラサイクリン系薬剤を含んだレジメン,またはAraC大量療法3コースが推奨される(CQ6)。
微小残存病変/測定可能残存病変(minimal/measurable residual disease:MRD)の正確な評価は,再発の予測や造血幹細胞移植を含む治療戦略の個別化に有用な情報となる(CQ2)。
維持療法については,FLT3変異陽性AMLに対する同種造血幹細胞移植後にFLT3阻害剤を維持投与することにより予後の改善が示唆されるなど,今後の状況により,維持療法が有効な対象は拡大する可能性がある(CQ14)。
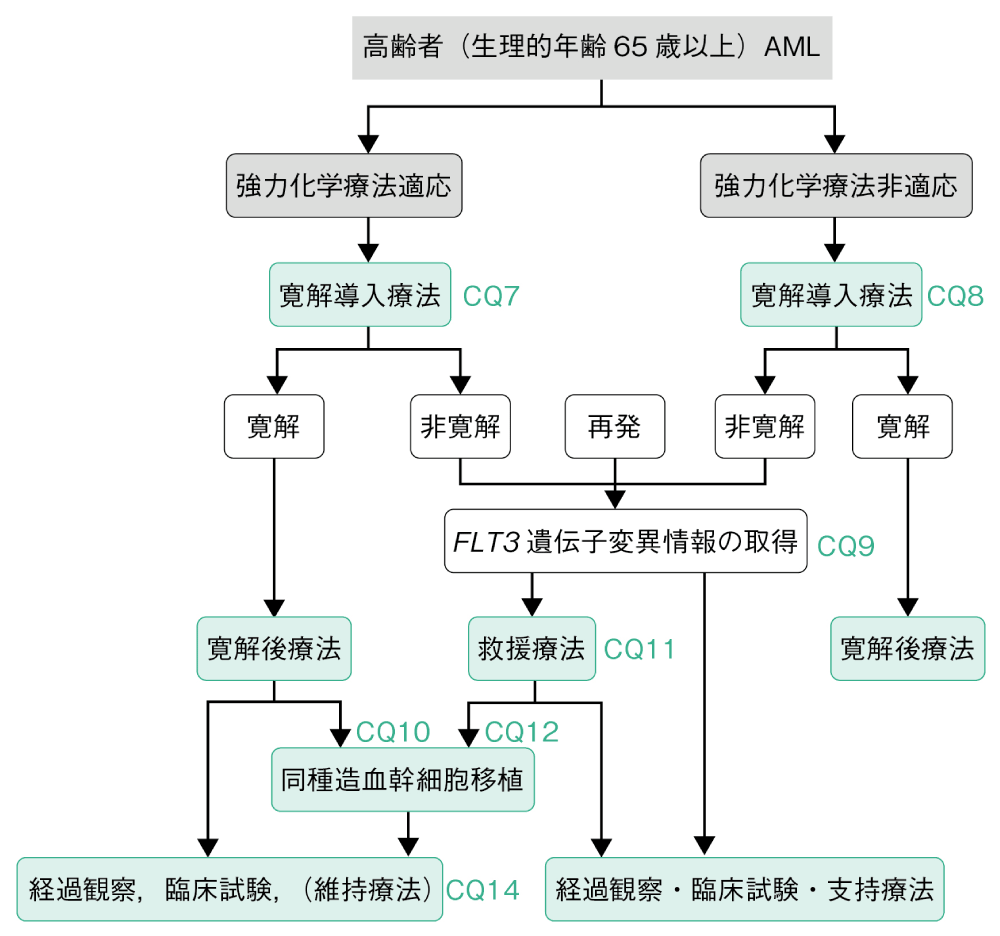
2.高齢者(生理的年齢65歳以上)AML
白血病の予後因子,患者の身体機能,患者・家人の希望,介護等社会的サポートの有無により治療強度を決定する。若年者に準じた強力化学療法が可能と判断された症例に対してはAraC+アントラサイクリンが推奨される(CQ7)。高齢者AMLに対する標準的寛解後療法は確立されてないが,わが国では,非交差耐性のアントラサイクリン系薬剤を含む多剤併用レジメンが実施されることが多い(CQ7)。60~75歳の未治療の高リスク(治療関連・二次性・予後不良群に属するMDS関連染色体異常を有する)AML症例に対し,初回治療としてダウノルビシン・シタラビン配合リポソーム注射剤(CPX-351)が勧められる(CQ7,13)。
予後不良の症例には寛解後療法として骨髄非破壊的前処置による同種造血幹細胞移植も行われることがある。強力化学療法が非適応と判断された場合は,ベネトクラクス(VEN)+アザシチジン(AZA)またはVEN+低用量AraC併用療法,さらに治療強度の減弱やbest supportivecareの選択を検討する(CQ8)。
3.治療関連・二次性AML
強力化学療法の適応のある症例に関しては,化学療法ダウノルビシン・シタラビン配合リポソーム注射剤(CPX-351)で寛解を目指し,引き続き適切な症例に対して造血幹細胞移植を施行することが勧められる。高齢者や強力な化学療法の適応とならない症例に対しては,VENとAZA併用療法の選択を検討する(CQ13)。
4.再発・難治性AMLに対する救援療法
再発・難治性AMLに対して若年者ではAraC大量投与を主体とする救援化学療法によりCRに導入し,引き続き適切な症例に造血幹細胞移植を施行することが勧められる(CQ11)。再発・難治性FLT3変異陽性AMLに対しては,FLT3阻害薬を用い,適切な症例に対して造血幹細胞移植を施行することが勧められる(CQ9)。
強力化学療法が適応とならない症例では,AraC低用量療法,ゲムツズマブ オゾガマイシン(GO)(CD33陽性例に対して),VENとAZA等の非強力化学療法,緩和的支持療法が選択される(CQ11)。
5.非寛解期AMLに対する同種造血幹細胞移植
再発AMLに対し再寛解導入療法を行わず非寛解のままで移植の適応を決定する明確な指標は確立されていない。また,寛解導入療法不応非寛解症例に対する移植の適応を決定する明確な指標も確立されていない(CQ12)。
6.支持療法(好中球減少期のG-CSF)
AMLの寛解導入療法,寛解後療法時におけるG-CSF投与は,好中球減少期間の短縮やQOLの改善が期待でき,高齢者や重症感染症を併発した症例では検討されても良い(CQ15)。
CQ1 AMLの治療選択と予後予測のために遺伝子検査は有用か
- 推奨グレード
- カテゴリー2A
染色体核型検査は予後予測,移植適応を含む治療選択において必須である。FLT3,NPM1,CEBPA,TP53遺伝子などの変異解析によってさらなる治療選択および予後層別化が可能である。
解説
AML細胞の染色体核型は,寛解導入療法に対する反応性および生存に対する強い予後因子であり,WHO分類第5版(2022)およびICC分類(2022)における病型診断,さらには治療法の選択においても重要な情報となる。
2022年にELNガイドラインが改訂され,AMLの予後因子も変更となった1)(総論表6参照)。若年者においては,染色体核型とそれに伴うキメラ遺伝子に基づき,予後良好群,中間群,不良群の3群に分類される。t(8;21)(q22;q22.1)/RUNX1::RUNX1T1,inv(16)(p13.1q22)またはt(16;16)(p13.1;q22)/CBFB::MYH11が予後良好染色体核型,inv(3)(q21.3q26.2)またはt(3;3)(q21.3;q26.2)/GATA2,MECOM(EVI1),MECOM(EVI1)遺伝子(3q26.2)を含む染色体転座,-5またはdel(5q),-7,-17または17p異常,t(6;9)(p23;q34.1)/DEK::NUP214,t(8;16)(p11.2;p13.3)/KAT6A::CREBBP, t(9;11)(p21.3;q23.3)以外のKMT2A(MLL)遺伝子(11q23)を含む染色体転座,t(9;22)(q34.1;q11.2)/BCR::ABL1,複雑核型,monosomal karyotypeが予後不良染色体核型とされ,正常核型,t(9;11)(p21.3;q23.3)/MLLT3::KMT2A,その他の核型は予後中間群に分類されている。
2017年ELNガイドライン2)から2022年ELNの重要な予後因子と治療選択の変更点として以下が挙げられる。
①FLT3阻害薬が初回治療から使用できる場合、FLT3-ITDアレル比がリスク分類で考慮されず,FLT3-ITDはアレル比やNPM1変異の有無に関係なく,すべて予後中間群に分類された。なお本邦において2023年5月、未治療のFLT3-ITD変異陽性AMLにFLT3阻害薬キザルチニブが保険承認された。
②骨髄異形成関連遺伝子変異を伴うAMLは予後不良群に位置付けられ,ASXL1やRUNX1だけでなく,BCOR, EZH2, SF3B1, SRSF2, STAG2, U2AF1, ZRSR2変異が含まれるようになった。
③CEBPAの片アレル,両アレル変異に関係なく,bZIP領域に変異がある場合は予後良好群となった。
④反復性遺伝子異常を伴うAMLカテゴリーに追加されたMECOMやKAT6A::CREBBP融合遺伝子が予後不良群に分類された。
⑤MDSまたはCMML既往AMLと治療関連AMLに加えて、予後不良群に属するMDS関連染色体異常(-5,del(5q), -7, -17, 17p異常や複雑核型,モノソーマル核型など)を有するAMLに対しては、ダウノルビシン・シタラビン配合リポソーム注射剤CPX-351が推奨される3)。本邦でも2024年5月に保険承認された。
将来,本邦でも網羅的な遺伝子変異検査が可能となれば,初回治療からの分子標的薬の導入,第一寛解期での造血幹細胞移植の適応,さらにはMRDマーカーとしての活用など実臨床での治療選択への応用が期待される。
参考文献
1) Döhner H, et al. Diagnosis and management of AML in adults : 2022 recommendations from an international expert panel on behalf of the ELN. Blood. 2022; 140(12): 1345-77.(レビュー)
2) Döhner H, et al. Diagnosis and management of AML in adults?: 2017 ELN recommendations from an international expert panel. Blood. 2017; 129(4): 424-47.(レビュー)
3) Lancet JE et al. CPX-351 (cytarabine and daunorubicin) Liposome for Injection versus Conventional Cytarabine Plus Daunorubicin in Older Patients with Newly Diagnosed Secondary Acute Myeloid Leukemia. J Clin Oncol. 2018; 36(26):2684-92. (1iiA)
CQ2 AMLの予後予測,治療方針決定にMRDの評価は有用か
- 推奨グレード
- カテゴリー2A
AMLにおける測定可能残存病変のモニタリングに経時的な疾患特異的キメラ遺伝子やWT1遺伝子のmRNA発現定量が考慮される。
解説
MRDの正確な評価は,再発の予測や造血幹細胞移植を含む治療戦略の個別化に有用な情報となる。MRD評価法として,RQ-PCR法による疾患特異的遺伝子発現定量とマルチパラメーター・フローサイトメトリー(MFC)による特異的細胞表面マーカー解析,開発中の次世代シーケンサー法による遺伝子変異解析がある1,2)。ELNのMRD working partyによりMRDを用いたAML診療の提言では,各々のMRD測定技術の特性や測定感度を理解した上で,治療経過に沿って連続的にMRDを測定して,各ポイントで得られたMRD結果を治療内容に照らして適切に解釈する重要性が強調された。
RUNX1::RUNX1T1とCBFB::MYH11を有するCBF白血病では,キメラ遺伝子を標的としたRQ-PCR法は高感度で,疾患特異性が高く,MRDと予後との相関が多数例で検討されている。初診時キメラ遺伝子発現量から,寛解導入療法後または地固め療法後に3logを超えるMRD減衰例またはMRD消失例では,再発率が有意に低く,良好な生存率が予測可能な予後因子とされる3-6)。NCCNガイドラインVer1.2022では,CBF白血病に対する寛解後療法としてMRD陰性例は地固め療法,MRD残存例には同種移植を推奨している。そのほか,NPM1変異に対するRQ-PCR法によるMRD定量が予後予測因子としてエビデンスが報告されているが7),AMLの約20%のみ認められる変異で,その変異部位も多様なため研究レベルでの測定に留まる。一方,本邦で汎用されている末梢血WT1定量検査はAMLに非特異的ではあるが,寛解導入後早期のWT1 MRD結果と予後が相関し8,9),他に適当なMRD検査標的がない場合にはMRD検索対象として推奨される1)。
欧米でAMLのMRD評価の主流であるMFC法はわが国では保険適用がない。系統逸脱抗原(Different from Normal:DfN)や白血病特異抗原(leukemia-associated immunophenotype:LAIP)など複数の抗原を組み合わせたパネルにより,各個人のMRDマーカーを同定する必要がある1,2)。また,次世代シーケンサーを用いたMRD解析も開発中であるが,高頻度に認められるクローン性造血に関与する遺伝子変異(DNMT3A,TET2,ASXL1)の残存は予後とは相関しないことや,標的とすべき遺伝子変異や測定感度の問題など解決すべき課題がある10)。
以上から,疾患特異的キメラ遺伝子やWT1遺伝子のmRNA発現定量によるMRDの経時的な評価が考慮される。しかし,その他のMRD検査は未だ本邦では標準化されていない。
参考文献
1) Heuser M, et al. 2021 Update on MRD in acute myeloid leukemia: a consensus document from the European LeukemiaNet MRD Working Party. Blood. 2021; 138(26): 2753-67.(レビュー)
2) Schuurhuis GJ, et al. Minimal/measurable residual disease in AML : a consensus document from the European LeukemiaNet MRD Working Party. Blood. 2018; 131(12): 1275-91.(レビュー)
3) Corbacioglu A, et al. Prognostic impact of minimal residual disease in CBFB-MYH11-positive acute myeloid leukemia. J Clin Oncol. 2010; 28(23): 3724-9.(3iiDiii)
4) Yin JA, et al. Minimal residual disease monitoring by quantitative RT-PCR in core binding factor AML allows risk stratification and predicts relapse: results of the United Kingdom MRC AML-15 trial. Blood. 2012; 120(14): 2826-35.(3iiiD)
5) Jourdan E, et al. Prospective evaluation of gene mutations and minimal residual disease in patients with core binding factor acute myeloid leukemia. Blood. 2013; 121(12): 2213-23.(3iiDii)
6) Rücker FG, et al. Measurable residual disease monitoring in acute myeloid leukemia with t(8;21)(q22;q22.1): Results from the AML Study Group. Blood. 2019; 134(19): 1608-18.(3iiiA)
7) Ivey A, et al. Assessment of Minimal Residual Disease in Standard-Risk AML. N Engl J Med. 2016; 374(5): 422-33.(3iiiA)
8) Lambert J, et al. Early detection of WT1 measurable residual disease identifies high-risk patients, independent of transplantation in AML. Blood Adv. 2021; 5(23): 5258-68.(3iiDi)
9) Miyawaki S, et al. Prognostic potential of detection of WT1 mRNA level in peripheral blood in adult acute myeloid leukemia. Leuk Lymphoma. 2010; 51(10): 1855-61.(3iiiD)
10)Jongen-Lavrencic M, et al. Molecular Minimal Residual Disease in Acute Myeloid Leukemia. N Engl J Med. 2018; 378(13): 1189-99.(3iiA)
CQ3 若年者(65歳未満)初発AMLに対する寛解導入療法としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
若年者初発de novo AMLに対する標準的寛解導入療法はアントラサイクリン(イダルビシンまたはダウノルビシン)+標準量シタラビンである。FLT3-ITD陽性症例に対しては,標準的寛解導入療法とキザルチニブの併用が勧められる。
解説
従来,60歳未満の若年者de novo AMLに対する標準的寛解導入療法は,ダウノルビシン(DNR)45~50mg/m2 3日間+シタラビン(AraC)100mg/m2または200mg/m2 7日間持続投与の“3+7”療法であったが,イダルビシン(IDR)+AraCとDNR+AraCとの比較試験およびメタアナリシスの結果,IDR+AraC のDNR+AraCに対する優越性が報告された1)。しかし,従来のDNR投与量(45~50mg/m2)はIDR投与量(12mg/m2)と比較して,生物学的に少ないことが指摘された。
米国Eastern Cooperative Oncology Group(ECOG)では,60歳未満のde novo AMLに対し増量DNR(90mg/m2)3日間+AraC(100mg/m2)7日間と従来のDNR(45mg/m2)3日間+AraC(100mg/m2)7日間とのランダム化比較試験が実施され,寛解率,生存割合ともに増量DNR(90mg/m2)群が有意に優れていることが示された2)。
英国National Cancer Research Institute(NCRI)では,DNR(90mg/m2)3日間とDNR(60mg/m2)3日間の比較試験が実施され,寛解率および生存割合に有意差は認められず,60日時点での死亡割合はDNR(90mg/m2)群で有意に高いことが示された3)。
Japan Adult Leukemia Study Group(JALSG)で実施されたDNR(50mg/m2)5日間+AraCとIDR(12mg/m2)3日間+AraCとのランダム化比較試験(AML201試験)の結果では,寛解率および生存割合ともに両群の同等性が示されている4)。
その他のアントラサイクリン系薬剤として,ミトキサントロン(MIT)(総量18~30mg/m2)とIDR(総量24~36mg/m2)との比較試験が行われているが,寛解率および生存割合に有意差は認められていない5)。
したがって,若年者初発de novo AMLに対する標準的寛解導入療法は,IDR+AraCまたはDNR+AraCである。NCCNガイドラインでは,DNR+AraC療法におけるDNR投与量は60~90mg/m2 3日間が推奨されている6)が,50mg/m2 5日間投与も同等の成績が得られることが示されている。また,わが国でのDNRの承認用法・用量は,体重1kgあたり1mgを連日あるいは隔日に3~5回投与であることに留意する必要がある。
未治療FLT3-ITD陽性AML(18~75歳)に対して若年者de novo AMLに対する標準的寛解導入療法とキザルチニブ(QUIZ)の併用の有用性が日本人を含む国際共同第Ⅲ相試験(QuANTUM-First)で検討された7)。主要評価項目である全生存期間中央値は、QUIZ併用群で31.9カ月、非併用群で15.1カ月と有意にQUIZ併用群が優れていた(p=0.0324)。未治療のFLT3-ITD変異陽性AMLに対しては、若年者de novo AMLに対する標準的寛解導入療法にキザルチニブ(QUIZ)の併用が勧められる。
参考文献
1) A systematic collaborative overview of randomized trials comparing idarubicin with daunorubicin (or other anthracyclines) as induction therapy for acute myeloid leukaemia. AML Collaborative Group. Br J Haematol. 1998; 103(1): 100-9.(1iiA)
2) Fernandez HF, et al. Anthracycline dose intensification in acute myeloid leukemia. N Engl J Med. 2009; 361(13): 1249-59.(1iiDiv)
3) Burnett AK, et al. A randomized comparison of daunorubicin 90 mg/m2 vs 60 mg/m2 in AML induction : results from the UK NCRI AML17 trial in 1206 patients. Blood. 2015; 125(25): 3878-85.(1iiA)
4) Ohtake S, et al. Randomized study of induction therapy comparing standard-dose idarubicin with high-dose daunorubicin in adult patients with previously untreated acute myeloid leukemia : the JALSG AML201 Study. Blood. 2011; 117(8): 2358-65.(1iiDiv)
5) Li X, et al. The effects of idarubicin versus other anthracyclines for induction therapy of patients with newly diagnosed leukaemia. Cochrane Database Syst Rev. 2015; (6): CD010432.(1iiA)
6) NCCN Clinical Practice Guidelines in Oncology. Acute Myeloid Leukemia. Version 1.2022-December 2, 2021.(ガイドライン)
7) Erba HP, et al. Quizartinib plus chemotherapy in newly diagnosed patients with FLT3-internal-tandem-duplication-positive acute myeloid leukaemia (QuANTUM-First): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2023; 401(10388): 1571-83.(1iA)
CQ4 1回の寛解導入療法で完全寛解が得られない初発AMLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
1回目の寛解導入療法と同一の治療を行うことは妥当である。
- 推奨グレード
- カテゴリー3
1回目の寛解導入療法にシタラビン大量を含む治療を行っていない場合,一部の症例では2回目にシタラビン大量療法を含む治療を行うことで,寛解率が改善する可能性がある。
解説
わが国の初発AML治療はJALSGにおいて多くの検討が行われてきた。これまでのJALSG研究では,1回の寛解導入療法でCRが得られなかった場合,2回目として1回目と同一の治療が実施されている1-6)。AML201試験では,イダルビシン(IDR)+シタラビン(AraC)群(IDR群)の78.2%,ダウノルビシン(DNR)+AraC 群(DNR 群)の77.5%でCR が得られているが,そのうち1回の寛解導入療法で寛解が得られた割合はIDR 群64.1%,DNR 群61.1%,2回目の寛解導入療法を必要とした割合はIDR 群14.1%,DNR 群16.4%であった6)。このことから,1回で寛解が得られず,2回目に同一の寛解導入療法を行った場合,その寛解率はIDR群40%,DNR 群42%となり,比較的高い寛解率が推定される。また,Othusらは後方視的解析により,1回目の寛解導入療法抵抗例に対する同一の2回目治療の寛解率は43%であり,2回目に同一治療を実施した例と他の治療を行った例ではその後の生存に差を認めなかったと報告している7)。
1回目の寛解導入療法と同一の治療以外には,再発・難治性AMLで効果が示されているAraC大量療法を含む治療も選択肢となり得る。しかし,この方法の優越性を明確に示した報告はない。Ravandiらの報告ではAraC 大量療法を含む1回の寛解導入療法で非寛解であった例のうち,2回目で寛解が得られた例は18%であった8)。このことから,1回目に強力な寛解導入療法を行った場合,2回目の寛解導入療法の効果は低下する可能性がある。また,1回目の治療効果にかかわらず,2回目の寛解導入療法を行う治療法の結果について報告がある9)。60歳以下を対象に1回目と2回目の寛解導入療法にどちらも標準量AraCを使用する群(TAD-TAD群)と,1回目に標準量,2回目に大量AraCを使用する群(TAD-HAM群)とを比較した結果,寛解率はTAD-TAD群65%,TAD-HAM群71%で有意差は認められなかった(p=0.072)。サブグループ解析では治療前LDH>700IU/L,予後不良染色体,寛解導入療法後day16の骨髄芽球割合>40%のいずれかを有する群では,寛解率TAD-TAD 群49%,TAD-HAM 群65%と有意(p=0.004)にTAD-HAM群が優れる結果であった。一方,上記因子を有しない群ではCR率に有意差は認められなかった。
以上から,1回の寛解導入療法で寛解が得られなかった場合,2回目に同一の治療を行うことは,複数の臨床研究で採用された方法であること,比較的高い寛解率が期待できることから妥当な方法である。しかし,一部の症例ではAraC大量療法など異なる治療レジメンによって寛解率が改善する可能性がある。なお,海外ではAMLの分類に応じFLT3阻害薬やゲムツズマブ オゾガマイシン(GO)を併用した寛解導入療法が用いられている。これら併用療法も2回目治療として考慮されるが,現在のところ本邦では保険承認されていない。今後の薬剤承認状況などにより2回目の治療も変化する可能性がある。
参考文献
1) Ohno R, et al. Randomized study of individualized induction therapy with or without vincristine, and of maintenance-intensification therapy between 4 or 12 courses in adult acute myeloid leukemia. AML-87 Study of the Japan Adult Leukemia Study Group. Cancer. 1993; 71(12): 3888-95.(1iiDiv/3iDiv)
2) Kobayashi T, et al. Randomized trials between behenoyl cytarabine and cytarabine in combination induction and consolidation therapy, and with or without ubenimex after maintenance/intensification therapy in adult acute myeloid leukemia. The Japan Leukemia Study Group. J Clin Oncol. 1996; 14(1): 204-13.(1iiDiv/3iDiv)
3) Miyawaki S, et al. No beneficial effect from addition of etoposide to daunorubicin, cytarabine, and 6-mercaptopurine in individualized induction therapy of adult acute myeloid leukemia: the JALSG-AML92 study. Japan Adult Leukemia Study Group. Int J Hematol. 1999; 70(2): 97-104.(1iiDiv/3iDiv)
4) Ohtake S, et al. Randomized trial of response-oriented individualized versus fixed-schedule induction chemotherapy with idarubicin and cytarabine in adult acute myeloid leukemia: the JALSG AML95 study. Int J Hematol. 2010; 91(2): 276-83.(1iiDiv/3iDiv)
5) Miyawaki S, et al. A randomized, postremission comparison of four courses of standard-dose consolidation therapy without maintenance therapy versus three courses of standard-dose consolidation with maintenance therapy in adults with acute myeloid leukemia: the Japan Adult Leukemia Study Group AML 97 Study. Cancer. 2005; 104(12): 2726-34.(1iiDii/3iDiv)
6) Ohtake S, et al. Randomized study of induction therapy comparing standard-dose idarubicin with high-dose daunorubicin in adult patients with previously untreated acute myeloid leukemia: the JALSG AML201 Study. Blood. 2011; 117(8): 2358-65.(1iiDiv)
7) Othus M, et al. Prediction of CR following a second course of ‘7+3’ in patients with newly diagnosed acute myeloid leukemia not in CR after a first course. Leukemia. 2016; 30(8): 1779-80.(3iiiDiv)
8) Ravandi F, et al. Characteristics and outcome of patients with acute myeloid leukemia refractory to 1 cycle of high-dose cytarabine-based induction chemotherapy. Blood. 2010; 116(26): 5818-23.(3iiDiv)
9) Büchner T, et al. Double induction strategy for acute myeloid leukemia: the effect of high-dose cytarabine with mitoxantrone instead of standard-dose cytarabine with daunorubicin and 6-thioguanine: a randomized trial by the German AML Cooperative Group. Blood. 1999; 93(12): 4116-24.(1iiDi)
CQ5 若年者(65歳未満)初発CBF-AMLに対する寛解後療法としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
65歳未満のCBF-AMLの寛解後療法として,シタラビン大量療法はDFSの延長が期待でき,勧められる。
解説
Cancer and Leukemia Group B(CALGB)の行ったランダム化比較試験では,AML寛解後療法としてのシタラビン(AraC)標準量(100mg/m2/day,5日間持続),中等量(400mg/m2/day,5日間持続)およびAraC大量療法(3g/m2,1日2回3時間で静注,day1,3,5に投与)を前方視的に比較した。その結果,60歳以下でAraC大量療法の有効性が確認された1)。特にCBF白血病ではAraC大量療法が最も効果が高く2)また,CALGBの後方視的な解析でもt(8;21)AMLに対して3コース以上のAraC大量療法が有効であることを示している3)。inv(16)/t(16;16)AMLは再発後も移植により良好にサルベージされるためOSは影響されないが,AraC大量療法を3~4コース施行された患者群では,1コースのみ施行された患者群と比較して再発率が有意に減少する。わが国で行われた65歳未満を対象にした前方視的試験では,2g/m2,1日2回3時間で静注5日は,これまでの多剤併用療法と比較してDFS,OSともに差がなかったが,CBF白血病ではAraC大量療法群でDFSの改善傾向が認められた4)。
参考文献
1) Mayer RJ, et al. Intensive postremission chemotherapy in adults with acute myeloid leukemia. Cancer and Leukemia Group B. N Engl J Med. 1994; 331(14): 896-903.(1iiDii)
2) Bloomfield CD, et al. Frequency of prolonged remission duration after high-dose cytarabine intensification in acute myeloid leukemia varies by cytogenetic subtype. Cancer Res. 1998; 58(18): 4173-9.(1iiDii)
3) Byrd JC, et al. Repetitive cycles of high-dose cytarabine benefit patients with acute myeloid leukemia and inv(16)(p13q22)or t(16;16)(p13;q22): results from CALGB 8461. J Clin Oncol.2004; 22(6): 1087-94.(3iiiDii)
4) Miyawaki S, et al. A randomized comparison of 4 courses of standard-dose multiagent chemotherapy versus 3 courses of high-dose cytarabine alone in postremission therapy for acute myeloid leukemia in adults: the JALSG AML201 Study. Blood. 2011; 117(8): 2366-72.(1iiDii)
CQ6 CBF-AML以外の若年者(65歳未満)初発AMLに対する寛解後療法としてはどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
非交差耐性のアントラサイクリン系薬剤を用いた多剤併用化学療法4コースが推奨される。
- 推奨グレード
- カテゴリー3
シタラビン大量療法3コースが推奨される。しかし,多剤併用化学療法と比べ,感染症の増加が報告されており注意が必要である。
解説
AMLは寛解導入療法後に寛解を長期維持するため,寛解後療法を必要とする。欧米では以前から寛解後療法にシタラビン(AraC)が使用されており,その投与量が治療成績に及ぼす影響について多くの検討が行われている。Mayerらは60歳以下の症例において,AraC標準量(100mg/m2,400mg/m2)に比べAraC大量療法(3g/m2,1日2回,day1,3,5投与,4コース)がDFSで優れるとの結果を報告した1)。その後もAraC至適投与量について検討が行われ,一回投与量1~1.5g/m2まで減量した場合でも3g/m2と同等の治療成績が得られ,AraCの減量により輸血量の減少,好中球減少期間の短縮がみられたと報告されている2,3)。
標準量AraCを含む多剤併用療法とAraC大量療法との比較も行われている4,5)。JALSGにおいて,AraC大量療法(2g/m2,1日2回,5日間),と非交差耐性のアントラサイクリン系薬剤に標準量AraCを用いた多剤併用療法のランダム化比較試験が実施された5)。その結果,5年DFSはAraC大量療法群で43%,多剤併用療法群で39%と有意差は認められず,OSも同等であった。NRMの差も認めなかったが,Grade3~4の顕性感染症がAraC大量療法群20.9%,多剤併用群14.5%と有意に多い結果であった5,6)。層別化解析では,染色体予後良好群においてAraC大量療法群でDFSが優れる傾向を認めたが,中間,予後不良群では差は認められなかった。
近年,寛解導入に引き続いて,寛解後療法においてもゲムツズマブ オゾガマイシン(GO)やFLT3阻害薬を併用することの有用性が報告されている7,8)。しかし,本邦ではこれらの薬剤は初発AMLに対し承認が得られてない。また,自己末梢血幹細胞移植の効果についても検討が行われており,Vellengaらは第一寛解期AMLに対し強化地固め療法群と自己末梢血幹細胞移植を実施する群との比較を行い,自己末梢血幹細胞移植群でDFSが改善するものの,OSは同等であったと報告している9)。
以上より,CBF-AML以外の若年者初発AMLに対する寛解後療法として,非交差耐性のアントラサイクリン系薬剤を用いた多剤併用化学療法4コースが推奨される。AraC大量療法3コースも同等の効果が期待されるが,多剤併用に比べ白血球減少の程度が強く,感染症に注意が必要である。今後,わが国の薬剤承認状況次第では,分子標的薬の導入による寛解後療法の層別化が進む可能性が高い。なお,未治療FLT3-ITD変異陽性AMLに対しFLT3阻害薬キザルチニブ併用療法の有効性が示され10),2023年5月に保険承認された。このため,未治療FLT3-ITD変異陽性AMLに対する寛解後療法として,キザルチニブ併用AraC大量療法が推奨される。
参考文献
1) Mayer RJ, et al. Intensive postremission chemotherapy in adults with acute myeloid leukemia. Cancer and Leukemia Group B. N Engl J Med. 1994; 331(14): 896-903.(1iiA)
2) Schaich M, et al. Cytarabine dose of 36 g/m2 compared with 12 g/m2 within first consolidation in acute myeloid leukemia: results of patients enrolled onto the prospective randomized AML96 study. J Clin Oncol. 2011; 29(19): 2696-702.(1iiA)
3) Burnett AK, et al. Optimization of chemotherapy for younger patients with acute myeloid leukemia: results of the medical research council AML15 trial. J Clin Oncol. 2013; 31(27): 3360-8.(1iiA)
4) Moore JO, et al. Sequential multiagent chemotherapy is not superior to high-dose cytarabine alone as postremission intensification therapy for acute myeloid leukemia in adults under 60 years of age : Cancer and Leukemia Group B Study 9222. Blood. 2005; 105(9): 3420-7.(1iiDii)
5) Miyawaki S, et al. A randomized comparison of 4 courses of standard-dose multiagent chemotherapy versus 3 courses of high-dose cytarabine alone in postremission therapy for acute myeloid leukemia in adults: the JALSG AML201 Study. Blood. 2011; 117(8): 2366-72.(1iiDii)
6) Kato H, et al. Infectious complications in adults undergoing intensive chemotherapy for acute myeloid leukemia in 2001-2005 using the Japan Adult Leukemia Study Group AML201 protocols. Support Care Cancer. 2018; 26(12): 4187-98.(1iiC)
7) Hills RK, et al. Addition of gemtuzumab ozogamicin to induction chemotherapy in adult patients with acute myeloid leukaemia : a meta-analysis of individual patient data from randomised controlled trials. Lancet Oncol. 2014; 15(9): 986-96.(1iiA)
8) Stone RM, et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. N Engl J Med. 2017; 377(5): 454-64.(1iA)
9) Vellenga E, et al. Autologous peripheral blood stem cell transplantation for acute myeloid leukemia. Blood. 2011; 118(23): 6037-42.(1iiA)
10)Erba HP, et al. Quizartinib plus chemotherapy in newly diagnosed patients with FLT3-internal-tandem-duplication-positive acute myeloid leukaemia(QuANTUM-First): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2023; 401(10388): 1571-83.(1iA)
CQ7 強力化学療法が可能な高齢者(65歳以上)AMLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
ELN(2022)に基づく予後良好または予後中間群に属し,かつPS良好で適切な臓器機能を有する場合,シタラビンとアントラサイクリン併用による強力化学療法が勧められる。治療関連・二次性AMLに対してCPX-351が勧められる。
解説
高齢者AMLの治療は,若年者に準じた強力化学療法,非強力化学療法,緩和的支持療法に3大別される。白血病の予後因子,患者の身体・認知機能,患者・家人の希望,介護等社会的サポートの有無の4面から治療を選択する。高齢者においても,強力寛解導入療法を施行することで寛解率の向上と生存の延長につながる1)。ELN(2022)では染色体異常と遺伝子変異を用いてAMLの予後を3群に層別化する2)。高齢者では予後不良群の頻度が上がり,強力化学療法によるCR率,OSは予後不良群で低下する3-5)。一方,高齢者の身体能力は暦年齢だけで評価できないが,一般的に加齢とともに強力化学療法によるCR率とOSは低下する3,5)。また,75歳を超える高齢者やPS3,4では寛解導入療法による早期死亡が増加する5)。本邦で行われた高齢者AMLに対するJALSG-GML200試験の患者適格基準は,適切な肝機能(血清ビリルビン値<2.0mg/dL),腎機能(血清クレアチニン値<2.0mg/dL),心機能(左室駆出率>50%),肺機能を有し,PS0~2であった6)。以上から,強力化学療法の適応を考える際,ELN(2022)に基づく予後良好または予後中間群に属すること,PS良好で適切な臓器機能を有すること,年齢上限75歳がおおよその目安となる。PSは0~2を目安として,PS2については臓器機能,併存疾患等から総合判断する。
核となる薬剤はシタラビン(AraC)とアントラサイクリンである。寛解導入療法においてアントラサイクリンのどれを選択してもCR率,DFSに差は認められなかった4)。65歳以上においてダウノルビシン(DNR)増量(90mg/m2,3日)の優位性は示されなかった3)。また,高齢者でのAraC増量は治療効果改善に寄与しない。以上から,高齢者AMLにおける強力寛解導入療法としてAraC標準量+アントラサイクリン併用が目安となる。地固め療法として中等量AraC,ミトキサントロン(MIT)併用,アントラサイクリンの減量等さまざまに検討されたが,高齢者AMLにおける標準的地固め療法は未だ確立されていない7-9)。
本邦ではJALSG-GML200試験において,高齢者AML(65~79歳)に対して寛解導入療法として,DNR(40mg/m2,3日間固定)+AraC誘導体エノシタビン(BHAC)(200mg/m2,8日間固定)とDNR(40mg/m2,3日間以上)+BHAC(200mg/m2,8日間以上)(骨髄芽球減少に応じて薬剤を追加投与する)の2法が比較された(ただし,70歳以上ではDNR 30mg/m2)6)。薬剤平均総投与量は,固定法でDNR 109mg/m2,BHAC 1,605mg/m2,増量法でDNR 139mg/m2,BHAC 1,851mg/m2であった。CR率は固定法60.1%,増量法63.6%であった。引き続き地固め療法がBHAC併用療法として3コース施行された。予測4年RFSは固定法で9%,増量法で18%であった。本法は強力化学療法の選択肢のひとつとなる。AraC標準量がBHACの代替となる。
60~75歳の未治療の高リスク(治療関連・二次性・予後不良群に属するMDS関連染色体異常を有する)AML症例を対象に,初回治療としてシタラビンおよびダウノルビシンの併用療法(7+3療法)に対するダウノルビシン・シタラビン配合リポソーム注射剤(CPX-351)の有効性および安全性を検討する第Ⅲ相試験が行われた10)。主要評価項目であるOS中央値は,7+3療法群が5.95カ月であるのに対してCPX-351群は9.56カ月であり,有意な延長が認められた(p=0.003)。CPX-351群で骨髄抑制期間は延長し,重篤な有害事象は発熱性好中球減少症,敗血症,呼吸不全,肺炎であった。以上から,強力化学療法が可能な高リスクAML(治療関連AML,MDS/慢性骨髄単球性白血病の既往のあるAML,MDS関連細胞遺伝学的異常を有するAML)に対してCPX-351で寛解を目指し,引き続いて適切な症例に対して造血幹細胞移植を施行することが勧められる。
AZA-AML-001試験では造血幹細胞移植の対象でない高齢者初発AML(65歳以上,予後良好群を除く)においてアザシチジン(AZA)と通常治療(強力化学療法,低用量AraC,支持療法)が比較され,OSに差は認められなかった11)。予後不良染色体やAML-MRCでAZAの有効性が認められた。強力化学療法が可能な高齢者に対するAZAやベネトクラクス(VEN)等新規薬剤の臨床効果については今後さらなる検討が必要と考えられる12)。
参考文献
1) Löwenberg B, et al, On the value of intensive remission-induction chemotherapy in elderly patients of 65 + years with acute myeloid leukemia: a randomized phase III study of the European Organization for Research and Treatment of Cancer Leukemia Group. J Clin Oncol. 1989;7(9): 1268-74.(1iiA)
2) Döhner H, et al. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood. 2022; 140(12): 1345-77.(レビュー)
3) Löwenberg B, et al. High-dose daunorubicin in older patients with acute myeloid leukemia. N Engl J Med. 2009; 361(13): 1235-48.(1iiA)
4) Rowe JM, et al. A phase 3 study of three induction regimens and of priming with GM-CSF in older adults with acute myeloid leukemia: a trial by the Eastern Cooperative Oncology Group. Blood. 2004; 103(2): 479-85.(1iiDiv)
5) Appelbaum FR, et al. Age and acute myeloid leukemia. Blood. 2006; 107(9): 3481-5.(3iiiA)
6) Wakita A, et al. Randomized comparison of fixed-schedule versus response-oriented individualized induction therapy and use of ubenimex during and after consolidation therapy for elderly patients with acute myeloid leukemia: the JALSG GML200 Study. Int J Hematol. 2012; 96(1): 84-93.(1iiA)
7) Sperr WR, et al. A novel effective and safe consolidation for patients over 60 years with acute myeloid leukemia: intermediate dose cytarabine(2 x 1 g/m2 on days 1, 3, and 5). Clin Cancer Res. 2004; 10(12 Pt 1): 3965-71.(2A)
8) Stone RM, et al. Postremission therapy in older patients with de novo acute myeloid leukemia: a randomized trial comparing mitoxantrone and intermediate-dose cytarabine with standard-dose cytarabine. Blood. 2001; 98(3): 548-53.(1iiDii)
9) Lee JH, et al. Standard induction chemotherapy followed by attenuated consolidation in elderly patients with acute myeloid leukemia. Ann Hematol. 2006; 85(6): 357-65.(3iiiA)
10)Lancet JE, et al. CPX-351 (cytarabine and daunorubicin) liposome for injection versus conventional cytarabine plus daunorubicin in older patients with newly diagnosed secondary acute myeloid leukemia. J Clin Oncol. 2018;36(26):2684-92, (1iiA)
11)Dombret H, et al. International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with >30% blasts. Blood. 2015; 126(3): 291-9.(1iiA)
12)Cherry EM, et al. Venetoclax and azacitidine compared with induction chemotherapy for newly diagnosed patients with acute myeloid leukemia. Blood Adv. 2021; 5(24): 5565-73.(3iiiA)
CQ8 強力化学療法が適応とならない高齢者(65歳以上)AMLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
強力化学療法非適応高齢者AMLにおいては,ベネトクラクス+アザシチジンまたはベネトクラクス+低用量シタラビン併用療法が勧められる。しかし,高齢者AMLでは全身状態(PS),併存疾患などの程度により,治療強度の減弱やbest supportive careの選択を検討することが必要である。
解説
従来までは,標準化学療法が不適応とされた unfit高齢者AMLに対して,患者の臓器機能・併存疾患に応じて主治医判断により,治療強度を減弱した多剤併用化学療法や,低用量シタラビン(AraC)1),アザシチジン(AZA)単剤投与2),CAG療法(低用量AraC,ACR,G-CSF)などが行われてきた。減弱基準のエビデンスはなく,また寛解導入療法に続く地固め療法など治療骨格の規定はなく,治療奏効に応じて,選択された治療法の継続や変更,中止が主治医判断で行われてきた。unfit高齢者AMLに対する標準治療として,推奨するレジメンに一定の見解はなかった。
2020年BCL2阻害剤ベネトクラクス(VEN)の臨床試験が行われ,75歳以上あるいは75歳未満unfit AML初発例に対する,VENとAZA併用(VEN+AZA:VIALE-A試験)3)およびVENと低用量AraC併用4)の有効性が証明された。本試験でのunfitの基準は,PS2または3,治療を要する慢性心不全,EF50%以下,慢性安定狭心症の既往,DLCO 50%以下,1秒率65%以下,CCr 30mL/分以上45mL/分未満,総ビリルビン値が施設基準上限の1.5倍以上3倍以下の中等度肝機能障害などと定義された。VIALE-A試験では年齢中央値76歳(49~91歳)の431名に対して,VEN+AZA群とAZA単独群に割り付け,生存期間中央値[(VEN+AZA群14.7カ月,AZA 群9.6カ月(HR0.66,95%CI 0.52-0.85,p<0.001)],CR率[36.7% vs. 17.9%(p<0.001)],CR+CRi率[66.4% vs. 28.3%(p<0.001)]ともVEN+AZA群で良好な成績であった。遺伝子変異別の複合寛解率では,IDH1/2(75.4% vs. 10.7%,p<0.001),FLT3(72.4% vs. 36.4%,p=0.021),NPM1(66.7% vs. 23.5%),TP53(55.3% vs. 0%)とVEN+AZA群で良好であった。サブグループ解析では,de novo AML(HR 0.67,95% CI 0.51-0.90),二次性AML(HR 0.56,95%CI 0.35-0.91),骨髄異形成関連変化を有するAML-MRC(HR 0.73,95% CI 0.48-1.11),予後中間染色体(HR 0.57,95% CI 0.41-0.79),予後不良染色体(HR 0.78,95% CI 0.54-1.12)において生存率の改善をVEN+AZA群で認めた。有害事象としてGrade 3以上の発熱性好中球減少症(42% vs. 19%)はVEN+AZA群で高かった。血液毒性やアゾール系抗真菌薬など併用薬との相互作用を含めVEN+AZA療法のマネージメントに習熟する必要がある。従来までは有効な治療法がなかったunfit高齢者AMLに対して,VEN+AZA継続治療の有効性が示された5)。一方,VEN+AZA療法の治療効果の持続性,寛解後の維持療法,VEN+AZA療法再発・難治例に対する後治療,などの課題が残る。また,将来的には本邦でもactionable mutationを有する症例(IDH1/2,FLT3変異)に対する分子標的薬の導入も期待されており,VEN+AZA療法との使い分けなど含めて検討が必要となろう6)。
なお,重篤な併存疾患やPS3以上のunfit高齢者AMLにおいて,VENを基軸とした治療では治療関連死亡の危険性が高いと考えられる場合,より治療強度の低い治療法またはbest supportivecareの選択も考慮する。
参考文献
1) Burnett AK, et al. A comparison of low-dose cytarabine and hydroxyurea with or without all-trans retinoic acid for acute myeloid leukemia and high-risk myelodysplastic syndrome in patients not considered fit for intensive treatment. Cancer. 2007; 109(6): 1114-24.(1iiA)
2) Dombret H, et al. International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with >30% blasts. Blood. 2015; 126(3): 291-9.(1iiA)
3) DiNardo CD, et al. Azacitidine and Venetoclax in Previously Untreated Acute Myeloid Leukemia. N Engl J Med. 2020; 383(7): 617-29.(1iiA)
4) Wei AH, et al. Venetoclax plus LDAC for newly diagnosed AML ineligible for intensive chemotherapy: phase 3 randomized placebo-controlled trial. Blood. 2020; 135(24): 2137-45.(1iA)
5) Pratz KW, et al. Measurable Residual Disease Response and Prognosis in Treatment-Naïve Acute Myeloid Leukemia With Venetoclax and Azacitidine. J Clin Oncol. 2022; 40(8): 855-65.(3iiiD)
6) National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: Acute Myeloid Leukemia: Version 1.2022.(ガイドライン)
CQ9 FLT3変異陽性AMLに対してどのような治療が勧められるか。また,リューコストラットCDx FLT3変異検査を行う場合にどのような注意点があるか
- 推奨グレード
- カテゴリー2A
FLT3-ITD陽性AMLに対して初発若年例では化学療法とキザルチニブを併用して完全寛解に導入し,引き続いて適切な症例に対して造血幹細胞移植を施行することが勧められる。強力化学療法の適応とならない初発例ではアザシチジンとベネトクラクス併用が選択肢となる。再発・難治例ではFLT3阻害薬を用い,適切な症例に対して造血幹細胞移植を施行することが勧められる。FLT3阻害薬使用に際してリューコストラットCDx FLT3変異検査によりFLT3-ITD,FLT3-TKD陽性であることを確認する必要がある。
解説
FLT3遺伝子変異はAMLに最も多く認められる遺伝子変異で1),本邦では初発AMLの約25%に認められる2)。傍膜貫通ドメインの一部に生じる縦列重複配列(ITD)変異とチロシンキナーゼドメインのミスセンス変異(TKD)がある。FLT3-ITDは予後不良因子で3),本変異陽性例では再発率は上昇し,寛解持続期間やOSは短くなる4-8)。一方,FLT3-TKDは予後不良因子として確立されていない。
RATIFY試験では,初発FLT3-ITD,FLT3-TKD陽性若年AMLに対してFLT3阻害薬midostaurinを化学療法に併用する臨床試験が行われた。CR率はmidostaurin併用群で58.9%,非併用群で53.5%(p=0.15),OS中央値はmidostaurin群で74.7カ月,非併用群で25.6カ月(p=0.009)であった9)。本邦においてmidostaurinは承認されていない。JALSG-AML209-FLT3-SCT試験では,初発FLT3-ITD陽性若年AMLの第一寛解期での同種造血幹細胞移植が前方視的に検討され,3年のDFSは43.8%であった10)。また,Oranらの検討ではFLT3-ITD陽性AMLの第一寛解期での同種造血幹細胞移植は化学療法に比しRFS,OSを改善した11)。以上から,初発FLT3-ITD陽性若年AMLに対して化学療法によりCRを目指し,引き続いて適切な症例に対して同種造血幹細胞移植を行うことが勧められる。なお,本邦の後方視的解析では,ELN(2017)の予後良好に分類されるNPM1変異陽性かつFLT3-ITD低アレル比例12)の第一寛解期に同種造血幹細胞移植が施行された群のRFS,OSは非施行群よりも良好であった13)。ELN(2022)ではFLT3-ITDはアレル比やNPM1変異の有無に関わらず予後中間群に分類されることになった14)。
2023年5月,未治療のFLT3-ITD変異陽性AMLに対して化学療法との併用においてキザルチニブ(QUIZ)の使用が追加承認され,治療の選択肢となった。日本人を含む国際共同第Ⅲ相試験(QuANTUM-First)では,初発FLT3-ITD陽性AML(18~75歳)に対して化学療法とQUIZ併用の有用性が検討された15)。主要評価項目である全生存期間中央値はQUIZ併用群で31.9カ月、非併用群で15.1カ月であった。QUIZ併用群での有害事象は骨髄抑制,感染症,QT延長などであった。以上から,初発若年者FLT3-ITD変異陽性AMLに対しては,化学療法とQUIZ併用が勧められる。感染症等骨髄抑制に十分注意する。
強力化学療法の適応とならない初発FLT3-ITD陽性AMLに対する治療には確立したものはない。アザシチジン(AZA)とベネトクラクス(VEN)を併用したVIALE-A第Ⅲ相臨床試験のサブグループ解析ではFLT3変異陽性例(FLT3-ITD,FLT3-TKDとも含まれていた)における寛解率(CR+CRi)は72.4%,OS中央値は13.6カ月であった16, 17)。本患者群に対してVEN併用療法は選択肢の一つとなる。なお,FLT3-ITD例でのOS中央値は併用群9.9か月,AZA単剤8.5カ月,FLT3-TKD例ではぞれぞれ19.2カ月,10.0カ月であったことに注意する17)。
再発・難治性FLT3-ITD陽性AMLの予後は厳しい。Ravandiらの後方視的解析では再発例での化学療法による再寛解率はFLT3-ITD陽性例で24%,陰性例で38%であった(p=0.09)18)。本邦ではFLT3阻害薬であるギルテリチニブ(GIL)とQUIZが再発・難治例に保険適用を有する。GILはFLT3-ITD,FLT3-TKD双方に有効であるのに対し,QUIZはFLT3-ITDに対してのみ有効である。ADMIRAL試験では再発・難治FLT3-ITD,FLT3-TKD陽性AMLに対してGILと救援化学療法が比較検討された19)。OS中央値はGIL群で9.3カ月,救援化学療法群で5.6カ月,複合完全寛解率(CR+CRp+CRi)はGIL群で54.3%,救援化学療法群で21.8%であった。日本人のサブグループ解析でも同様の結果であった20)。QuANTUM-R試験では再発・難治FLT3-ITD陽性AMLに対してQUIZと救援療法が比較検討された21)。OS中央値はQUIZ群で6.2カ月,救援療法群で4.7カ月,複合完全寛解率はQUIZ群で48.2%,救援療法群で27.0%であった。いずれの試験においてもFLT3阻害薬により移植施行割合は増加した。
以上から,再発・難治例ではFLT3阻害薬を用い,適切な症例に対して造血幹細胞移植を施行することが勧められる。なお,ADMIRAL試験においてFLT3-TKD陽性サブグループのOS中央値はGIL群で8.0カ月,救援化学療法群で5.7カ月とGIL群で優位な傾向にあった。
初発時と再発時で遺伝子変異が変化することがある。FLT3阻害薬の使用に際してはリューコストラットCDx FLT3変異検査によりFLT3-ITD,FLT3-TKDが陽性であることを確認する必要がある22)。
参考文献
1) Papaemmanuil E, et al. Genomic Classification and Prognosis in Acute Myeloid Leukemia. N Engl J Med. 2016; 374(23): 2209-21.(3iiiA)
2) Kihara R, et al. Comprehensive analysis of genetic alterations and their prognostic impacts in adult acute myeloid leukemia patients. Leukemia. 2014; 28(8): 1586-95.(3iiiA)
3) Kiyoi H, et al. Prognostic implication of FLT3and N-RAS gene mutations in acute myeloid leukemia. Blood. 1999; 93(9): 3074-80.(3iA)
4) Kottaridis PD, et al. The presence of a FLT3 internal tandem duplication in patients with acute myeloid leukemia (AML)adds important prognostic information to cytogenetic risk group and response to the first cycle of chemotherapy: analysis of 854 patients from the United Kingdom Medical Research Council AML10 and 12 trials. Blood. 2001; 98(6): 1752-9.(3iiiA)
5) Fröhling S, et al; AMLStudy Group Ulm. Acute myeloid leukemia. Prognostic significance of activating FLT3 mutations in younger adults (16 to 60 years)with acute myeloid leukemia and normal cytogenetics: a study of the AMLStudy Group Ulm. Blood. 2002; 100(13): 4372-80.(3iiiA)
6) Gale RE, et al. The impact of FLT3 internal tandem duplication mutant level, number, size, and interaction with NPM1 mutations in a large cohort of young adult patients with acute myeloid leukemia. Blood. 2008; 111(5): 2776-84.(3iiiA)
7) Brunet S, et al. Impact of FLT3 internal tandem duplication on the outcome of related and unrelated hematopoietic transplantation for adult acute myeloid leukemia in first remission: a retrospective analysis. J Clin Oncol. 2012; 30(7): 735-41.(3iiiDii)
8) Döhner H, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 2017; 129(4): 424-47.(レビュー)
9) Stone RM, et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3Mutation. N Engl J Med. 2017; 377(5): 454-64.(1iA)
10)Kawashima N, et al. Allogeneic hematopoietic stem cell transplantation at the first remission for younger adults with FLT3-internal tandem duplication AML: The JALSG AML209-FLT3-SCT study. Cancer Sci. 2020; 111(7): 2472-81.(3iDii)
11)Oran B, et al. Allogeneic Transplantation in First Remission Improves Outcomes Irrespective of FLT3-ITD Allelic Ratio in FLT3-ITD-Positive Acute Myelogenous Leukemia. Biol Blood Marrow Transplant. 2016; 22(7): 1218-26.(3iiiA)
12)Schlenk RF, et al. Differential impact of allelic ratio and insertion site in FLT3-ITD-positive AML with respect to allogeneic transplantation. Blood. 2014; 124(23): 3441-9.(3iiiA)
13)Sakaguchi M, et al. Prognostic impact of low allelic ratio FLT3-ITD and NPM1 mutation in acute myeloid leukemia. Blood Adv. 2018; 2(20): 2744-54.(3iA)
14)Döhner H, et al. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood. 2022; 140(12): 1345-77.(レビュー)
15)Erba HP, et al. Quizartinib plus chemotherapy in newly diagnosed patients with FLT3-internal-tandem-duplication-positive acute myeloid leukaemia (QuANTUM-First): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2023; 401(10388): 1571-83.(1iA)
16)DiNardo CD, et al. Azacitidine and Venetoclax in Previously Untreated Acute Myeloid Leukemia. N Engl J Med. 2020; 383(7): 617-29.(1iiA)
17)Konopleva M, et al. Impact of FLT3Mutation on Outcomes after Venetoclax and Azacitidine for Patients with Treatment-Naïve Acute Myeloid Leukemia. Clin Cancer Res. 2022; 28(13): 2744-52.
18)Ravandi F, et al. Outcome of patients with FLT3-mutated acute myeloid leukemia in first relapse. Leuk Res. 2010; 34(6): 752-6.(3iiiDiv)
19)Perl AE, et al. Gilteritinib or Chemotherapy for Relapsed or Refractory FLT3-Mutated AML. N Engl J Med. 2019; 381(18): 1728-40.(1iiA)
20)Hosono N, et al. Gilteritinib versus chemotherapy in Japanese patients with FLT3-mutated relapsed/refractory acute myeloid leukemia. Int J Clin Oncol. 2021; 26(11): 2131-41.(1iiA)
21)Cortes JE, et al. Quizartinib versus salvage chemotherapy in relapsed or refractory FLT3-ITD acute myeloid leukaemia (QuANTUM-R): a multicentre, randomised, controlled, open-label, phase 3 trial. Lancet Oncol. 2019; 20(7): 984-97.(1iiA)
22)McCormick SR, et al. FLT3 mutations at diagnosis and relapse in acute myeloid leukemia: cytogenetic and pathologic correlations, including cuplike blast morphology. Arch Pathol Lab Med. 2010; 134(8): 1143-51.(3iiiDiv)
CQ10 第一寛解期AMLに対する同種造血幹細胞移植の適応基準は何か
- 推奨グレード
- カテゴリー1
現時点では初診時の染色体核型と遺伝子異常による予後層別化が重要である。予後中間および不良群に分類された患者においては,第一寛解期における造血幹細胞移植が勧められる。
解説
これまで,第一寛解期AMLにおける同種造血幹細胞移植と寛解後化学療法を比較した多数のランダム化比較試験が施行され,多くの症例で同種造血幹細胞移植がDFSを延長することが示されてきた。しかしながら,ほとんどの研究ではOSでの有効性を示すことができていない。これを補足する二次研究として,24件の臨床研究(3,638例)を対象としたメタアナリシスが行われ,第一寛解期AMLのうち,予後不良および中間染色体異常のある症例では,移植による生存率が有意に勝るが,予後良好染色体異常のある症例では移植の有効性は認められなかったことが報告されている1)。この結果から,染色体異常の有無およびその種類を考慮し,第一寛解期AMLの移植適応を決定することが妥当といえる。
多くのランダム化比較試験で検討されたドナーソースはHLA適合血縁者であるが,遺伝子レベルで適合している非血縁者間とHLA適合血縁者間移植はほぼ同じ成績であることが報告されている2,3)。また,9件の臨床研究(2,258例)を対象としたメタアナリシスの結果では,PTCY法を用いたHLA半合致移植とHLA適合移植はほぼ同じ成績であることが報告されている4)。
正常核型AMLは染色体核型に基づく分類では予後中間群に分類されるが,近年,予後因子として遺伝子変異の知見が集積され,2017年に続き2022年にELNからエキスパートコンセンサスが示された。ELN(2017)5)からELN(2022)6)では骨髄異形成関連遺伝子変異としてMECOMやKAT6A::CREBBP融合遺伝子,さらに反復性遺伝子異常ではBCOR, EZH2, SF3B1, SRSF2,STAG2, U2AF1, ZRSR2の変異が予後不良群に加えられ,第一寛解期での移植適応と考えられる(CQ1参照)。
RUNX1::RUNX1T1融合遺伝子,CBFB::MYH11融合遺伝子,さらにbZIP領域に変異を伴うCEBPAは予後良好群に分類され,第一寛解期での移植適応はない。NPM1変異がありFLT3-ITDのない症例も予後良好群に分類され,第一寛解期は移植適応から外れる7)。ELN(2022)においてFLT3-ITDは,アレル比やNPM1変異の有無に関係なく,すべて予後中間群に分類された。本邦からの後方視的研究でNPM1変異がありFLT3-ITD低アレル比に関して,第一寛解期で移植を行った群の方が,行わなかった群に比べてRFS,OSは良好であったと報告されている8)。NPM1変異がありFLT3-ITD低アレル比症例の第一寛解期での移植適応は結論が出ておらず,さらに,FLT3阻害薬の登場により今後状況が変化する可能性がある9)。また,MRDの評価が移植適応の決定に応用されることが期待される10)。
移植診療では染色体核型や遺伝子変異による疾患リスクに加え,移植関連毒性を加味した上で移植が選択される。このため患者背景が多様で,背景の一致した患者が得られにくく,未だ詳細なエビデンスが確立されていない。本邦では,骨髄バンク事業や造血幹細胞移植推進拠点病院,日本造血細胞移植データセンターなどにおいて症例の集積が進められており,データの解析が待たれている。
参考文献
1)Koreth J, et al. Allogeneic stem cell transplantation for acute myeloid leukemia in first complete remission: systematic review and meta-analysis of prospective clinical trials. JAMA. 2009; 301(22): 2349-61.(1iiA)
2)Kanda Y, et al. Allogeneic hematopoietic stem cell transplantation from family members other than HLA-identical siblings over the last decade (1991-2000). Blood. 2003; 102(4): 1541-7.(3iA)
3)Kanda J, et al. Related transplantation with HLA-1 Ag mismatch in the GVH direction and HLA-8/8 allele-matched unrelated transplantation: a nationwide retrospective study. Blood. 2012; 119(10): 2409-16.(3iA)
4)Gu Z, et al. Similar outcomes after haploidentical transplantation with post-transplant cyclophosphamide versus HLA-matched transplantation: a meta-analysis of case-control studies. Oncotarget. 2017; 8(38): 63574-86.(3iiA)
5)Döhner H, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 2017; 129(4): 424-47.(レビュー)
6)Döhner H, et al. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood. 2022; 140(12): 1345-77.(レビュー)
7)Schlenk RF, et al. Mutations and treatment outcome in cytogenetically normal acute myeloid leukemia. N Engl J Med. 2008; 358(18): 1909-18.(2Diii)
8)Sakaguchi M, et al. Prognostic impact of low allelic ratio FLT3- ITD and NPM1 mutation in acute myeloid leukemia. Blood Adv. 2018; 2(20): 2744-54.(3iA)
9)Döhner K, et al. Impact of NPM1/FLT3-ITD genotypes defined by the 2017 European LeukemiaNet in patients with acute myeloid leukemia. Blood. 2020; 135(5): 371-80.(3iA)
10)Othman J, et al. Postinduction molecular MRD identifies patients with NPM1 AML who benefit from allogeneic transplant in first remission. Blood. 2024; 143 (19): 1931–1936(3iA)
CQ11 再発・難治性AMLに対する救援療法としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
再発・難治性AMLに対して若年者ではシタラビン大量投与を主体とする救援化学療法により完全寛解に導入し,引き続いて適切な症例に造血幹細胞移植を施行することが勧められる。強力化学療法が適応とならない症例では非強力化学療法,緩和的支持療法が選択される。
解説
Kurosawaらの検討では再発AML(年齢中央値53歳,16~70歳)の50%が化学療法により再度CRに到達し,寛解率はinv(16)(p13.1q22)例 84%,t(8;21)(q22;q22)例58%,染色体予後中間群48%,不良群31%であった1)。染色体予後中間群,不良群では,第二寛解期での移植施行例のOSは非移植例より優っていた。Sarkozyらの検討では初回再発高齢者AML(年齢中央値64歳,50~80歳)において2/3に再寛解導入療法が施行されCR率は31%,再発後生存期間中央値は第二寛解到達例で17.3カ月,非寛解例では4.2カ月であった2)。このように再発・難治性AMLでの最善の策は化学療法でCRに導入し,引き続いて適切な症例に造血幹細胞移植を施行することと考えられる。
救援化学療法として多くのレジメンが検討されたが,標準治療は未だ確立されていない。一般的に若年者ではシタラビン(AraC)中等量~大量投与を主体とするレジメンが用いられ,30~50%で再寛解が得られる。アントラサイクリンが併用されることが多い3)。Herzigらは再発AML(年齢中央値37歳,16~60歳)に対するAraC大量投与の臨床効果を検討し,再CR率はAraC大量投与単独で47%,アントラサイクリン併用で59%であった4)。治療抵抗例ではAraC大量投与単独のCR率は20%と,アントラサイクリン併用例の56%に比して有意に劣った。なお,本邦での大量投与の保険適用は1回2g/m2を12時間ごとに最大6日間投与である。MEC療法はミトキサントロン(MIT),エトポシド(ETP),AraCの併用療法である。報告により薬剤の投与量,日数は少し異なる。再CR率は50~60%である5,6)。Yamamotoらの減量MEC療法では奏効率(完全寛解+末梢血回復不十分な寛解)は36.4%であった7)。AraC大量療法の変法としてFLAG療法(AraC,FLU,G-CSF)がある。本邦ではJALSGにより再発・難治性AML(年齢中央値52歳,18~64歳)に対してFLAGM療法(AraC,FLU,G-CSF,MIT)による第Ⅱ相試験が行われ,CR率は73%,2年OSは39.4%であった8)。
強力化学療法が適応とならない症例ではAraC低用量療法,ゲムツズマブ オゾガマイシン(GO)(CD33陽性例に対して),アザシチジン(AZA)単剤療法,ベネトクラクス(VEN)併用療法等の非強力化学療法,緩和的支持療法が選択される9-14)。本邦での再発・難治性AMLに対するGOの第Ⅰ/Ⅱ相試験においてCR率は25%,血小板未回復の寛解率は5%であった9)。近年GO少量分割投与の有効性が報告されているが10),本邦での保険適用は「1回量9mg/m2で,投与回数は,少なくとも14日間の投与間隔をおいて,2回」である。再発・難治性AML(年齢中央値62歳,19~81歳)に対するVENと脱メチル化薬併用の後方視的解析ではCR率は30%,奏効率64%,1年OS53%であった13,15)。
参考文献
1) Kurosawa S, et al. Prognostic factors and outcomes of adult patients with acute myeloid leukemia after first relapse. Haematologica. 2010; 95(11): 1857-64.(3iA)
2) Sarkozy C, et al. Outcome of older patients with acute myeloid leukemia in first relapse. Am J Hematol. 2013; 88(9): 758-64.(3iDiv)
3) Karanes C, et al. A phase III comparison of high dose ARA-C(HIDAC)versus HIDAC plus mitoxantrone in the treatment of first relapsed or refractory acute myeloid leukemia Southwest Oncology Group Study. Leuk Res. 1999; 23(9): 787-94.(1iiDiv)
4) Herzig RH, et al. High-dose cytosine arabinoside therapy with and without anthracycline antibiotics for remission reinduction of acute nonlymphoblastic leukemia. J Clin Oncol. 1985; 3(7): 992-7.(3iDiv)
5) Amadori S, et al. Mitoxantrone, etoposide, and intermediate-dose cytarabine: an effective and tolerable regimen for the treatment of refractory acute myeloid leukemia. J Clin Oncol. 1991;(97): 1210-4.(3iDiv)
6) Archimbaud E, et al. Timed sequential chemotherapy for previously treated patients with acute myeloid leukemia: long-term follow-up of the etoposide, mitoxantrone, and cytarabine-86 trial. J Clin Oncol. 1995; 13(1): 11-8.(3iDiv)
7) Yamamoto C, et al. Dose-reduced combination of mitoxantrone, etoposide, and cytarabine(miniMEC)for relapsed and refractory acute leukemia. Leuk Lymphoma. 2016; 57(11): 2541-7.(3iDiv)
8) Hatsumi N, et al. Japan Adult Leukemia Study Group(JALSG). Phase II study of FLAGM(fludarabine + high-dose cytarabine + granulocyte colony-stimulating factor + mitoxantrone)for relapsed or refractory acute myeloid leukemia. Int J Hematol. 2019; 109(4): 418-25.(3iDiv)
9) Kobayashi Y, et al. Phase I/II study of humanized anti-CD33 antibody conjugated with calicheamicin, gemtuzumab ozogamicin, in relapsed or refractory acute myeloid leukemia: final results of Japanese multicenter cooperative study. Int J Hematol. 2009; 89(4): 460-9.(2Div)
10)Taksin AL, et al. High efficacy and safety profile of fractionated doses of Mylotarg as induction therapy in patients with relapsed acute myeloblastic leukemia: a prospective study of the alfa group. Leukemia. 2007; 21(1): 66-71.(2iDii)
11)Hills RK, et al. Addition of gemtuzumab ozogamicin to induction chemotherapy in adult patients with acute myeloid leukaemia: a meta-analysis of individual patient data from randomised controlled trials. Lancet Oncol. 2014; 15(9): 986-96.(3iiiA)
12)DiNardo CD, et al. Clinical experience with the BCL2-inhibitor venetoclax in combination therapy for relapsed and refractory acute myeloid leukemia and related myeloid malignancies. Am J Hematol. 2018; 93(3): 401-7.(3iDiv)
13)Aldoss I, et al. Efficacy of the combination of venetoclax and hypomethylating agents in relapsed/refractory acute myeloid leukemia. Haematologica. 2018; 103(9): e404-7.(3iDiv)
14)Yoshimoto G, et al. Azacitidine for the treatment of patients with relapsed acute myeloid leukemia after allogeneic stem cell transplantation. Leuk Lymphoma. 2021; 62(12): 2939-48.(3iA)
15)Stahl M, et al. Clinical and molecular predictors of response and survival following venetoclax therapy in relapsed/refractory AML. Blood Adv. 2021; 5(5): 1552-64.(3iiiA)
CQ12 非寛解期AMLに対する同種造血幹細胞移植の適応基準は何か
- 推奨グレード
- カテゴリー3
再発AMLに対し再寛解導入療法を行わない非寛解のままでの移植の適応を決定する明確な指標は確立されていない。また,寛解導入療法不応非寛解症例に対する移植の適応を決定する明確な指標も確立されていない。現時点では後方視的解析に基づく予後因子と移植に関連する因子(ドナーソースなど)を総合的に評価し,患者とのshared-decision makingで移植適応を決めることが勧められる。
解説
初回再発期において同種造血幹細胞移植と化学療法の有用性を前方視的に比較検討した報告はない。Breemsらは15~60歳の初回再発AMLの移植成績を後方視的に解析し,4つの予後因子(第一寛解の期間,診断時の染色体異常,初回再発時の年齢,初回再発前の造血幹細胞移植の有無)を同定し,これを基に初回再発期を3つの予後グループに分類している。第二寛解期が達成できた症例に限定して移植と化学療法を比較した検討では,いずれの群においても5年OSで移植の優位性が示唆されている1)。わが国の初回再発期AMLの移植成績の後方視的解析で,第二寛解期に到達することで3年OSは有意に改善することが報告されている2)。一方,芽球の割合の少ない初回再発期に再寛解導入療法を行わずに同種移植を行うことで第二寛解期と同等の生存率が得られるとの報告もあるが,そのエビデンスレベルは低い3)。寛解導入療法不応症例においては,UK NCRI AML Working groupがAML8,907例を解析し,1回目の寛解導入療法で芽球が50%以上減少しない,あるいは15%を超える芽球が残存する場合,または2回の寛解導入療法不応症例において,同種造血幹細胞移植は予後を改善すると報告している4)。
非寛解期AMLに対する同種造血幹細胞移植の成績は散見されるが,少数例での報告が多いことと患者の選択バイアスにより,その移植適応の指標を導き出すことは難しいが,the Center for International Blood and Marrow Transplant Research(CIBMTR)はAML非寛解期移植1,673例を解析し,第一寛解期の持続期間,末梢血中の芽球%,ドナーの種類,PS,染色体異常の有無から,移植後の3年OS42%の予後良好群から6%の予後不良群までの患者の層別化が可能であることを報告している5)。Tachibanaらは,骨髄中芽球5%以上または末梢血中芽球が検出される非寛解期でのAML移植症例519例(寛解導入失敗282例,寛解後再発237例)を解析し,5つの予後因子(CRP,末梢血芽球,予後不良核型,PS,非血縁者間骨髄移植)を同定し,4つの予後グループ(Good, Int-1, Int-2,Poor)に分類している。Int-2,Poorの2年OSはそれぞれ8%,0%と不良であった6)。
疾患リスクに加え,非再発死亡のリスクをEBMTスコアとHCT-specific comorbidity index(HCT-CI)を用いて評価し,総合的に同種移植の適応を判断することが勧められる7)。
参考文献
1)Breems DA, et al. Prognostic index for adults patients with acute myeloid leukemia in first relapse. J Clin Oncol. 2005; 23(9): 1969-78.(2A)
2)Kurosawa S, et al. Prognostic factors and outcomes of adults patients with acute myeloid leukemia after first relapse. Hematologica. 2010; 95(11): 1857-64.(3iA)
3)Clift RA, et al. Allogeneic marrow transplantation during untreated first relapse of acute myeloid leukemia. J Clin Oncol. 1992; 10(11): 1723-9.(3iiA)
4)Ferguson P, et al. An operational definition of primary refractory acute myeloid leukemia allowing early identification of patients who may benefit from allogeneic stem cell transplantation Haematologica. 2016; 101(11): 1351-8(3iiA)
5)Duval M, et al. Hematopoietic stem-cell transplantation for acute leukemia in relapse or primary induction failure. J Clin Oncol. 2010; 28(23): 3730-8.(3iA)
6)Tachibana T, et al. Prognostic index for patients with relapsed or refractory acute myeloid leukemia who underwent hematopoietic cell transplantation: a KSGCT multicenter analysis. Leukemia. 2019; 33(11): 2610-8.(3iA)
7)Elsawy M, et al. Up-to-date tools for risk assessment before allogeneic hematopoietic cell transplantation. Bone Marrow Transplant. 2016; 51(10): 1283-300.(レビュー)
CQ13 治療関連・二次性AMLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A[若年者(65歳未満)で強力化学療法の適応のある症例],カテゴリー2B(高齢者や強力化学療法の適応とならない症例)
強力化学療法の適応のある症例に関しては,ダウノルビシン・シタラビン配合リポソーム注射剤(CPX-351)で寛解を目指し,引き続いて適切な症例に対して造血幹細胞移植を施行することが勧められる。高齢者や強力化学療法の適応とならない症例に対して,ベネトクラクスとアザシチジン併用療法が考慮される。
解説
AMLはその発症形式からde novo AMLと治療関連・二次性AMLに分類される。治療関連AMLは,他の悪性腫瘍に対して抗がん薬や放射線治療を受けたために発症し,二次性AMLは,骨髄異形成症候群や慢性骨髄増殖性腫瘍などから病型が移行して発症する。治療関連・二次性AMLの特徴は,高齢者が多く,予後不良のmonosomal karyotypeや複雑核型などの染色体異常を有することが多い1-3)。このため通常の化学療法の治療成績はde novo AMLと比較して不良である1,2)。またt(8;21)やinv(16)といった予後良好の染色体異常をもった症例においてもde novo AMLと比較して有意に予後不良であることから,治療関連・二次性AMLであることが独立した予後不良因子であると考えられる1,3)。
60~75歳の未治療の高リスク(治療関連・二次性・予後不良群に属するMDS関連染色体異常を有する)AML症例を対象に,初回治療としてシタラビンおよびダウノルビシンの併用療法(7+3療法)に対するダウノルビシン・シタラビン配合リポソーム注射剤(CPX-351)の有効性および安全性を検討する第Ⅲ相試験が行われた4)。全生存率(OS)中央値は,7+3療法群が5.95カ月であるのに対してCPX-351群は9.56カ月であり,有意な延長が認められた(p=0.003)。複合的完全寛解率においても7+3療法群が33.3%であるのに対してCPX-351群は47.7%と有意に高かった(p=0.008)。さらに,同種造血幹細胞移植を実施した症例において,移植実施時点を起点としたOS中央値は,7+3療法群で10.25カ月であるのに対してCPX-351群は未到達であり,有意な延長が認められた[ハザード比0.51(95%CI:0.28-0.90)]5)。
以上より,強力化学療法の適応のある症例に関しては,化学療法ダウノルビシン・シタラビン配合リポソーム注射剤(CPX-351)で寛解を目指し,引き続いて適切な症例に対して造血幹細胞移植を施行することが勧められる。
75歳以上や75歳未満であっても強力化学療法の適応とならない初発AML症例に対して,Bcl-2阻害薬であるベネトクラクス(VEN)とアザシチジン(AZA)併用投与群とVEN/プラセボ投与群(対照群)を比較した第Ⅲ相臨床試験が行われた(VIALE-A[M15-656]試験)6)。二次性AML患者におけるサブグループ解析では,VENとAZA併用投与群で有意に死亡リスクが減少した(HR 0.56,95%CI 0.35-0.91)。また,治療関連や慢性骨髄増殖性腫瘍からの二次性AMLで頻度の高いTP53変異陽性例では,対照群で複合CR率0%であったのに対し,VENとAZA併用投与群で55%であった。
以上より,高齢者や強力化学療法の適応とならない症例に対して,VENとAZA併用療法が考慮される。
参考文献
1)Granfeldt Østgård LS, et al. Epidemiology and Clinical Significance of Secondary and Therapy-Related Acute Myeloid Leukemia: A National Population-Based Cohort Study. J Clin Oncol. 2015; 33(31): 3641-9.(3iA)
2)Kayser S, et al. The impact of therapy-related acute myeloid leukemia (AML)on outcome in 2853 adult patients with newly diagnosed AML. Blood. 2011; 117(7): 2137-45.(3iiiA)
3)Borthakur G, et al. Survival is poorer in patients with secondary core-binding factor acute myelogenous leukemia compared with de novo core-binding factor leukemia. Cancer. 2009; 115(14): 3217-21.(3iiiA)
4)Lancet JE, et al. CPX-351 (cytarabine and daunorubicin) Liposome for Injection Versus Conventional Cytarabine Plus Daunorubicin in Older Patients With Newly Diagnosed Secondary Acute Myeloid Leukemia. J Clin Oncol. 2018;36(26):2684-92.(1iiA)
5)Uy GL, et al. Transplant outcomes after CPX-351 vs 7 + 3 in older adults with newly diagnosed high-risk and/or secondary AML. Blood Adv. 2022;6(17):4989-93.(1iiA)
6)DiNardo CD, et al. Azacitidine and Venetoclax in Previously Untreated Acute Myeloid Leukemia. N Engl J Med.2020; 383(7): 617-29.(1iiA)
CQ14 地固め療法後または移植後のAMLに対する維持療法は勧められるか
- 推奨グレード
- カテゴリー2B
再発・難治性FLT3変異陽性AMLに対する同種造血幹細胞移植後にFLT3阻害剤を維持投与することにより予後の改善が示唆されている。また,今後の状況により,維持療法が有効な対象は拡大する可能性がある。
解説
過去の研究結果から,急性前骨髄球性白血病(APL)以外のAMLに対し維持療法の実施は推奨されていなかった1-4)。しかし,近年,複数の薬剤について維持療法としての有効性が示され,APL以外のAMLにおける維持療法について認識が変わりつつある。
Weiらは,55歳以上の移植非適応かつ強力化学療法で寛解に到達し,染色体リスク中間および不良群のAML症例を対象に,経口アザシチジン(AZA)維持療法の効果を検証する第Ⅲ相ランダム化二重盲検比較試験を実施した5)。その結果,経口AZA維持療法群はOS(中央値24.7カ月),DFS(中央値10.2カ月)ともにプラセボ群(OS中央値14.8カ月,DFS中央値4.8カ月)より有意に優れる結果が示された。有害事象に関しては経口AZA群で消化器症状,好中球減少が増加するものの,QOLは維持され,両群で差を認めなかった。AZA注射剤の維持投与についても報告がある。Hulsらは,強力化学療法で寛解が得られた60歳以上のAMLに対し,AZA皮下注を4週間おき5日間,最大12コース維持投与を行うことについて検討を行った6)。その結果,DFSの延長を認めたものの,OSでは有意な差は認められなかった。
初発FLT3-ITD変異陽性AMLに対する同種造血幹細胞移植後,FLT3阻害剤維持投与について検討が行われている。Burchertらは,同種造血幹細胞移植後,寛解期FLT3-ITD変異AMLに対しソラフェニブ維持投与の有用性を検証するランダム化二重盲検試験を実施した。その結果,NRM,OSが維持投与群で優れると報告されている7)。また,同様にソラフェニブを移植後day180まで維持投与する第Ⅲ相ランダム化非盲検試験においても良好な結果が示されている8)。ソラフェニブ維持投与群は,GVHD発症率が高く,毒性による薬剤中止割合が多いととする報告7)がある一方,有害事象は同等との報告8)もあり一致した結果が得られていない。さらに,同種移植後のmidostaurin維持投与についての検討では,18カ月RFSはmidostaurin維持群で89%,コントロール群で76%と維持投与群で良好な結果であったが,有意差は認められていない(p=0.27)9)。再発・難治性FLT3-ITD変異陽性AMLでは,後方視的解析であるものの,同種移植後キザルチニブ(QUIZ),ギルテリチニブ(GIL)維持投与の有効性を示唆する結果が報告されている10-12)。
以上のように,一部のAML(染色体予後良好群を除いた55歳以上の移植非適応かつ強力化学療法で寛解に到達例),初発FLT3-ITD変異陽性AMLに対する同種造血幹細胞移植後において維持療法の有効性が示されている。しかし,現在,本邦においては経口AZA,AMLに対するソラフェニブの使用はできず,実施可能な確立された維持療法は少ない。今後の薬剤承認,新たな研究結果の報告が期待される。なお,未治療FLT3-ITD変異陽性AMLに対しFLT3阻害薬QUIZ併用治療の有効性が示され13),2023年5月に保険承認された。このため,未治療FLT3-ITD変異陽性AMLに対する維持療法として3年間のQUIZ投与が推奨される。
参考文献
1) Sauter C, et al. Acute myelogenous leukaemia: maintenance chemotherapy after early consolidation treatment does not prolong survival. Lancet. 1984; 1(8373): 379-82.(1iiA/1iiDii)
2) Löwenberg B, et al. Mitoxantrone versus daunorubicin in induction-consolidation chemotherapy--the value of low-dose cytarabine for maintenance of remission, and an assessment of prognostic factors in acute myeloid leukemia in the elderly: final report. European Organization for the Research and Treatment of Cancer and the Dutch-Belgian Hemato-Oncology Cooperative Hovon Group. J Clin Oncol. 1998; 16(3): 872-81.(1iiDiv)
3) Robles C, et al. Low-dose cytarabine maintenance therapy vs observation after remission induction in advanced acute myeloid leukemia: an Eastern Cooperative Oncology Group Trial(E5483). Leukemia. 2000; 14(8): 1349-53.(1iiA/1iiDii)
4) Miyawaki S, et al. A randomized, postremission comparison of four courses of standard-dose consolidation therapy without maintenance therapy versus three courses of standard-dose consolidation with maintenance therapy in adults with acute myeloid leukemia: the Japan Adult Leukemia Study Group AML 97 Study. Cancer. 2005; 104(12): 2726-34.(1iiDiv)
5) Wei AH, et al. Oral Azacitidine Maintenance Therapy for Acute Myeloid Leukemia in First Remission. N Engl J Med. 2020; 383(26): 2526-37.(1iA)
6) Huls G, et al. Azacitidine maintenance after intensive chemotherapy improves DFS in older AML patients. Blood. 2019; 133(13): 1457-64.(1iiDii)
7) Burchert A, et al. Sorafenib Maintenance After Allogeneic Hematopoietic Stem Cell Transplantation for Acute Myeloid Leukemia With FLT3-Internal Tandem Duplication Mutation(SORMAIN). J Clin Oncol. 2020; 38(26): 2993-3002.(1iiDii)
8) Xuan L, et al. Sorafenib maintenance in patients with FLT3-ITD acute myeloid leukaemia undergoing allogeneic haematopoietic stem-cell transplantation: an open-label, multicentre, randomised phase 3 trial. Lancet Oncol. 2020; 21(9): 1201-12.(1iiDii)
9) Maziarz RT, et al. Midostaurin after allogeneic stem cell transplant in patients with FLT3-internal tandem duplication-positive acute myeloid leukemia. Bone Marrow Transplant. 2021; 56(5): 1180-9.(1iDii)
10)Ganguly S, et al. Clinical Outcomes in Patients with FLT3-ITD-Mutated Relapsed/Refractory Acute Myelogenous Leukemia Undergoing Hematopoietic Stem Cell Transplantation after Quizartinib or Salvage Chemotherapy in the QuANTUM-R Trial. Transplant Cell Ther. 2021; 27(2): 153-62.(3iiiDiv)
11)Perl AE, et al. Outcomes in Patients with FLT3-Mutated Relapsed/ Refractory Acute Myelogenous Leukemia Who Underwent Transplantation in the Phase 3 ADMIRAL Trial of Gilteritinib versus Salvage Chemotherapy. Transplant Cell Ther. 2023; 29(4): 265.e1-10.(3iiiDiv)
12)Terao T, et al. Early initiation of low-dose gilteritinib maintenance improves posttransplant outcomes in patients with R/R FLT3mut AML. Blood Adv. 2023; 7(5): 681-6.(3iiiDiv)
13)Erba HP, et al. Quizartinib plus chemotherapy in newly diagnosed patients with FLT3-internal-tandem-duplication-positive acute myeloid leukaemia(QuANTUM-First): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2023; 401(10388): 1571-83.(1iA)
CQ15 治療後の好中球減少期のAMLに対してG-CSFの使用は勧められるか
- 推奨グレード
- カテゴリー2B(寛解導入療法),カテゴリー2A(寛解後療法)
AMLの寛解導入療法,寛解後療法時におけるG-CSF投与は,好中球減少期間の短縮やQOLの改善が期待でき,高齢者や重症感染症を併発した症例では検討されても良い。
解説
AMLに対する治療は,寛解導入療法,寛解後療法ともに強化され,若年者AMLにおける寛解率は80%,5年OSは50%前後と向上している。この治療の強化は,骨髄抑制による出血や易感染性の対策の向上により可能になった。
このAMLの寛解導入療法や寛解後療法後に出現する感染症を予防できるかどうか,これまでにいくつかのG-CSF投与の第Ⅲ相試験が実施された。
若年者AMLを対象とした第Ⅲ相試験では,好中球減少期間,発熱期間,非経口抗生剤の投与期間さらには入院期間の短縮が示されている1)。わが国で行われた研究でも,好中球減少期間,発熱期間の短縮が観察されている2)。
骨髄抑制が高度となる高齢者AMLを対象にした試験でも,好中球減少期間,発熱期間,非経口抗生剤の投与期間の短縮が認められている3,4)。また,死亡率は減少しなかったが,寛解率は向上したとの報告もある5)。
AML細胞はG-CSF受容体を発現することから,AMLへのG-CSFの投与は問題視されているが,再発率の増加はみられず,長期観察においても生存期間へも影響を与えていないと報告されている6,7)。
AMLの寛解導入,寛解後療法時においては,G-CSF投与により好中球減少期間は短縮するものの,重症感染症の発症率や死亡率は減少せず,生存期間の延長も認められていない8)。したがって,ELN(2017)の勧告では重症感染症を併発した症例や寛解後療法で好中球減少が遷延した症例以外のAML症例へのG-CSFの投与は推奨していない9)。一方で,ASCOのガイドラインでは寛解導入療法後のG-CSF投与は妥当,寛解後療法後は推奨できるとしている10)。また,NCCNのガイドラインでも,寛解後療法後はG-CSFの投与を考慮しても良いとしているが,治療効果判定を混乱させる恐れがあるため骨髄検査の少なくとも7日前からはG-CSFの使用を控えるべきとしている11)。
参考文献
1) Heil G, et al. A randomized, double-blind, placebo-controlled, phase III study of filgrastim in remission induction and consolidation therapy for adults with de novo acute myeloid leukemia. The International Acute Myeloid Leukemia Study Group. Blood. 1997; 90(12): 4710-8.(1iD)
2) Usuki K, et al. Efficacy of granulocyte colony-stimulating factor in the treatment of acute myelogenous leukemia: a multicentre randomized study. Brit J Haemato. 2002; 116(1): 103-12.(1iiD)
3) Godwin JE, et al. A double-blind placebo-controlled trial of granulocyte colony-stimulating factor in elderly patients with previously untreated acute myeloid leukemia: a Southwest oncology group study(9031). Blood. 1998; 91(10): 3607-15.(1iD)
4) Amadori S, et al. Use of glycosylated recombinant human G-CSF(lenograstim)during and/or after induction chemotherapy in patients 61 years of age and older with acute myeloid leukemia: final results of AML-13, a randomized phase-3 study. Blood. 2005; 106(1): 27-34.(1iiD)
5) Dombret H, et al A controlled study of recombinant human granulocyte colony-stimulating factor in elderly patients after treatment for acute myelogenous leukemia. AML Cooperative Study Group. N Eng J Med. 1995; 332(25): 1678-83.(1iiD)
6) Heil G, et al. Long-term survival data from a phase 3 study of Filgrastim as an adjunct to chemotherapy in adults with de novo acute myeloid leukemia. Leukemia. 2006; 20(3): 404-9.(1iD)
7) Ohno R, et al. Effect of granulocyte colony-stimulating factor after intensive induction therapy in relapsed or refractory acute leukemia. N Engl J Med. 1990; 323(13): 871-7.
8) Gurion R, et al. Colony-stimulating factors for prevention and treatment of infectious complications in patients with acute myelogenous leukemia. Cochrane Database Syst Rev. 2012: 2012(6): CD008238.(3iiiA)
9) Döhner H et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 2017; 129(4): 424-47.(レビュー)
10)Smith TJ, et al. Recommendations for the Use of WBC Growth Factors: American Society of Clinical Oncology Clinical Practice Guideline Update. J Clin Oncol. 2015; 33(28): 3199-212.
11)NCCN Clinical Practice Guidelines in Oncology. Acute Myeloid Leukemia. Version 1.2022-December 2, 2021.(ガイドライン)

